MHR、血尿酸与维持性血液透析患者预后的关系
2022-03-29申世华
申世华 杨 静
血液透析是慢性肾脏病(chronic kidney disease,CKD)患者进展到终末期肾病的最重要治疗手段之一,随着血液透析技术的不断进步,患者的生存时间明显得到延长,但维持性血液透析(maintenance hemodialysis,MHD)患者病死率仍较其他患者高[1]。早期识别并及时干预影响预后的相关因素对于提高血液透析患者预后至关重要。近年来研究发现,血液透析患者体内存在炎性状态,并且与众多并发症相关,增加患者死亡风险,因此炎性反应也受到越来越多的关注[2]。单核细胞/高密度脂蛋白比值(mononuclear cell high-density lipoprotein ratio,MHR)是全身炎性反应的代表性标志物,是心脑血管不良事件的危险因素[3,4]。近年来研究发现,MHR与MHD患者透析充分性、微炎症状态及营养状况密切相关[5]。目前尚无MHR与MHD患者预后间关系的研究,而关于血尿酸(serum uric acid,SUA)水平与MHD患者全因死亡之间的关系尚存在较大的争议,本研究旨在探索MHR、SUA与MHD患者预后中的关系。
对象与方法
1.对象:本研究获得笔者医院医学伦理学委员会的同意和批准(伦理审批号:伦研批第2020-009-01),选取2017年1月1日~2020年6月30日在合肥市第一人民医院治疗的维持性血液透析患者。纳入标准:(1)年龄≥18岁,性别不限。(2)透析龄≥3个月的规律进行透析的患者。(3)所需临床资料完整。排除标准:(1)合并血液系统疾病、消化道大出血等影响血常规结果的患者。(2)近期存在明确感染者。(3)合并恶性肿瘤、消化性溃疡等消耗性疾病患者。(4)合并精神或认知障碍或接受器官移植的患者。(5)同时行腹膜透析者。(6)拒绝参与本研究者。
2.方法:(1)资料收集及随访:收集所有筛查患者的基础情况,包括年龄、性别、身高、体重、疾病诊断等信息。其中男性144例(67%),女性71例(33%);患者平均年龄65.66±13.93岁,60岁及以上患者141例(65.6%);平均透析时间5.25±4.16年;原发病包括糖尿病肾病74例(34.4%),慢性肾小球肾炎64例(29.8%),高血压肾损伤36例(16.7%),多囊肾14例(6.5%),其他27例(12.5%)。(2)测定入组患者血液透析前的实验室指标:例如,血常规、血白蛋白、前白蛋白、肾功能、血脂、全段甲状旁腺激素、血清铁蛋白等。(3)所有患者随访:至研究终止日期2021年6月30日,终点事件为全因死亡。

结 果
1.患者死亡情况:至随访结束时,215例患者中死亡组57例,生存组158例。57例死亡患者中,死亡原因为心血管事件19例(33.3%),感染15例(26.3%),脑卒中7例(12.3%),消化道出血3例(5.3%),多器官衰竭2例(3.5%),原因不明11例(19.3%)。
2.两组生化指标比较:患者的性别、体重指数、透析时间、总胆固醇、甘油三酯、尿素氮、钙、高密度脂蛋白及全段甲状旁腺激素水平比较,差异无统计学意义(P>0.05)。与生存组比较,死亡组患者年龄更大,单核细胞及MHR水平更高,而SUA、血红蛋白、白蛋白、肌酐、血磷水平更低,差异均有统计学意义(P<0.05),详见表1。

表1 两组基本资料的比较
3.多因素Logistic回归分析: 在所有MHD患者中,以生存/死亡(0/1)为因变量,纳入了年龄、血红蛋白、单核细胞计数、MHR、白蛋白、肌酐、尿酸、磷多项因素后,多因素Logistic回归分析提示MHR、SUA是MHD患者全因死亡的独立危险因素,详见表2。
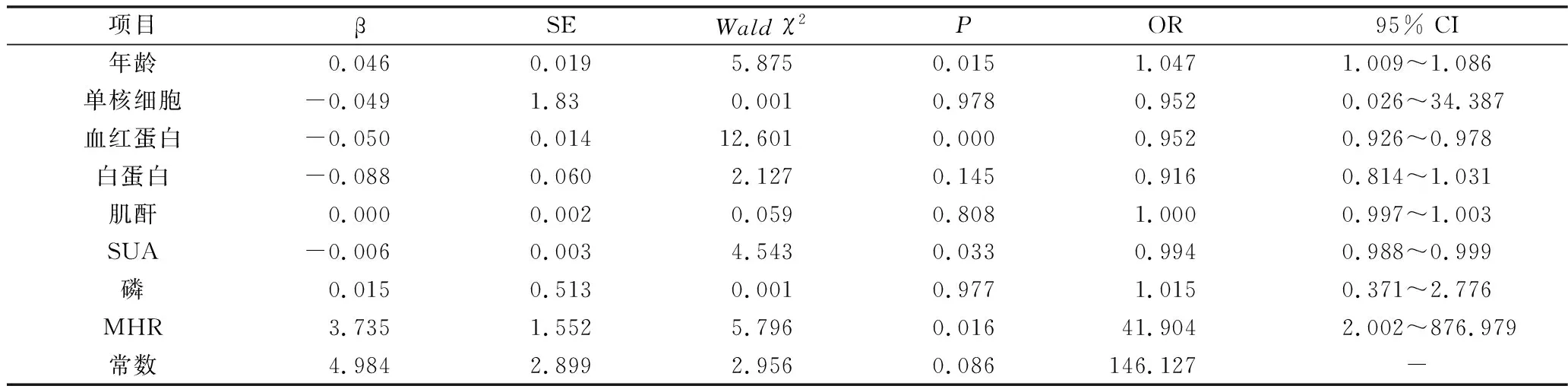
表2 维持性血液透析患者全因死亡的多因素Logistic回归分析
4.MHR、SUA对MHD患者全因死亡的预测价值:根据患者全因死亡绘制MHR、SUA的ROC曲线,选择约登指数最大值为截断值,MHR≥0.46时、SUA≤345.45μmol/L时,MHD死亡风险增加,详见表3。

表3 ROC分析结果(n=215)
讨 论
维持性血液透析患者普遍存在慢性微炎症状态,许多研究表明,慢性炎症是透析患者病死率和心血管事件的独立危险因素[2,6]。造成这种炎症状态的原因可能与尿毒症毒素、氧化应激、透析器及管路等透析耗材所造成的免疫反应、营养代谢紊乱等诸多因素相有关。同时慢性微炎症状态也与动脉粥样硬化、营养不良等透析并发症有关,而这些都是影响透析患者预后的重要因素。
MHR是近年来发现的敏感度和特异性均较高的新型炎症标志物,能准确地反映患者体内的炎性状态,可用于预测心血管疾病、动脉粥样硬化、代谢性疾病等疾病活动与预后[7~10]。单核细胞被认为在动脉粥样硬化的发病机制中起到重要作用,它可以通过黏附分子迁移到内皮下,在受损的血管内皮细胞上,转化为巨噬细胞,吞噬氧化的低密度脂蛋白,然后转化为泡沫细胞,与血管平滑肌细胞和细胞基质等一起形成纤维帽。而高密度脂蛋白具有抗动脉粥样硬化和内皮保护作用,可分别降低单核细胞和内皮细胞表面CD11b 和黏附因子的表达,抑制单核细胞趋化蛋白的产生,从而阻止单核细胞的活化,起到抗炎作用[11]。
有研究表明,高密度脂蛋白可通过抗氧化作用减轻足细胞损伤[12]。Kanbay等[13]研究显示,在透析前CKD患者中,MHR和估算的肾小球滤过率之间呈显著负相关。另有研究也表明,高水平MHR是CKD患者肾脏不良预后的独立危险因素,与CKD患者肾功能下降密切相关[14]。有研究发现,在腹膜透析患者中,MHR与腹膜透析患者心血管事件的风险以及全因死亡风险独立相关[15,16]。目前尚未有MHR在维持性血液透析患者全因死亡的相关报道。而本研究发现,MHR也是MHD患者全因死亡的独立危险因素(OR=41.904,P<0.05)。考虑与尿毒症患者体内毒素可明显抑制肝脏合成高密度脂蛋白,导致患者血清高密度脂蛋白降低,而高密度脂蛋白水平的降低削弱了其抗炎和抗氧化作用,减轻了对单核细胞活性的抑制作用。本研究中也发现,死亡组患者单核细胞计数明显高于生存组,但回归分析中发现单核细胞计数并非MHD患者全因死亡的独立危险因素,所以MHD的全因死亡风险可能是基于MHR的单核细胞促炎作用和高密度脂蛋白抗炎作用的共同协同作用。本研究中ROC曲线显示,根据MHR预测MHD患者全因死亡的曲线下面积为0.717(95%CI:0.634~0.8,P<0.01)。表明使用MHR评估MHD患者的预后是有意义的,并确定了MHR为0.46是预测MHD患者全因死亡的最佳临界值。
本研究发现,校正多项混杂因素后,低SUA也是预测MHD患者全因死亡的独立危险因素。而在一般人群中,高尿酸血症已是心血管事件和全因死亡的独立危险因素。而在血液透析患者中SUA的浓度与预后的关系则远较普通患者和CKD患者复杂。有研究认为高血尿酸水平是MHD患者预后的危险因素[17]。也有研究发现血液透析患者的病死率与尿酸水平呈“J”型相关[18]。而本研究发现低血尿酸水平是MHD患者预后的独立危险因素,这与相关研究结果是一致的[19,20]。对于血液透析患者低尿酸水平与全因病死率之间关联的机制目前尚未完全清楚,研究认为血尿酸是透析患者营养状况的指标,低血尿酸的血液透析患者病死率上升被认为是营养不良的结果[21];另一方面血尿酸也是一种强大的氧自由基清除剂,具有抗氧化和抗炎作用,低尿酸组患者炎性状态可能更明显。ROC曲线显示,根据SUA预测MHD患者全因死亡的曲线下面积为0.644(95%CI:0.553~0.735,P<0.05),表明使用SUA评估MHD患者的预后也是有意义的,并确定了SUA为345.45μmol/L是预测MHD患者全因死亡的最佳临界值。
综上所述,MHR、SUA可独立于其他因素预测MHD患者全因死亡的风险, 且作为透析患者常规检测指标,操作简单,价格低廉,有望成为MHD患者预后评估的新的生物学标志物。本研究存在一定局限性,首先,本研究为单中心研究,样本量相对较少。其次,本研究为回顾性研究设计,排除了部分数据资料不完整的患者,导致在一定程度上出现选择偏倚。今后仍需开展大样本量、多中心、前瞻性试验研究,且增加对患者的长期预后的随访,获得更多MHR、SUA对于预测MHD患者预后的确切临床意义的证据。
