TGF-β1通过NF-κB上调成骨细胞自噬的作用
2022-03-29龚永庆徐宏志
秦 晗 龚永庆 徐宏志
牙齿萌出需要多种细胞因子通过多条信号通路协同调节,共同维持成骨细胞和破骨细胞间动态平衡,从而保证萌出通道的正常形成[1]。TGF-β1是由成骨细胞产生的,目前被认为是最为复杂和多样化的生长因子之一,然而,其与成骨细胞相互作用的机制尚不清楚[2]。NF-κB信号通路是调节骨代谢的重要途径,它通过调节成骨-破骨细胞分化信号和骨基质的形成,在牙齿萌出通道形成过程中起着关键的调节作用[3]。自噬是一种保守的细胞自我降解方式,在维持细胞稳态中具有重要意义[4,5]。
笔者前期研究发现,阻断 NF-κB信号通路后,成骨细胞的自噬功能降低,提示NF-κB信号通路和自噬间呈正相关[6]。那么作为成骨细胞的重要调节因子,TGF-β1与NF-κB信号通路和自噬之间存在怎样的关系,能否通过对其相关性的探讨为牙齿萌出通道形成机制研究提供新的实验依据是本项目的研究重点。本研究对体外培养的成骨细胞进行相应的分组,分别观察不同浓度的TGF-β1对成骨细胞自噬功能的影响,以及SN50阻断NF-κB信号通路后,再次加入的TGF-β1对成骨细胞自噬因子表达的影响,以期揭示TGF-β1、NF-κB信号通路和自噬在调节成骨细胞功能中相互作用,进而为牙齿萌出过程中分子信号转导相关机制的研究提供新的理论和实验依据。
材料与方法
1.成骨细胞培养和分组:从液氮罐中取出小鼠成骨细胞(中国科学院上海细胞库),复苏后吸去冻存液上清,加入新鲜培养基,置于37℃、5%CO2培养箱中静态培养。当细胞达到对数生长期时,用胰酶消化制备成单细胞悬液,并以2×104/cm2密度接种到已加入消毒盖玻片的培养板中。分别加入NF-κB信号通路阻断剂SN50(美国Senta Cruz公司)和人重组TGF-β1蛋白(英国Abcam公司)。按照加入NF-κB信号通路阻断剂SN50和TGF-β1浓度不同,将成骨细胞分为以下12组:①NC组:无SN50+无TGF-β1;②KD1组:无SN50+TGF-β1(0.01ng/ml);③KD2组:无SN50+TGF-β1(100ng/ml); ④KD3组: SN50(6.25μg/ml)+无TGF-β1;⑤KD4组:SN50 (6.25μg/ml)+TGF-β1(0.01ng/ml); ⑥KD5组: SN50 (6.25μg/ml)+TGF-β1(100ng/ml);⑦KD6组:SN50 (12.25μg/ml)+无TGF-β1; ⑧KD7组: SN50 (12.25μg/ml)+TGF-β1 (0.01ng/ml);⑨KD8组: SN50 (12.25μg/ml)+TGF-β1 (100ng/ml); ⑩KD9组: SN50 (25μg/ml)+无 TGF-β1;KD10组: SN50 (25μg/ml)+TGF-β1 (0.01ng/ml);KD11组: SN50 (25μg/ml)+TGF-β1 (100ng/ml),加入药物后继续培养24h。
2.MDC法检测自噬小体:将贴壁培养的成骨细胞于培养板内爬片至所需要的汇合度,弃去培养液,加入300μl 1×Wash Buffer清洗2次。MDC染色试剂盒(江苏凯基生物技术有限公司,KGATG001)。按照1×Wash Buffer∶MDC染色液体积比=9∶1的比例进行染色液稀释,计算一次实验所需要的染色液体积,配制MDC染色工作液,轻轻混匀。而后每孔加入100μl MDC染色工作液,室温避光染色20~30min后,弃去染色液,以1×Wash Buffer,300μl清洗3次,再以100μl收集缓冲液覆盖盖玻片,使用激光共聚焦显微镜观察绿色荧光颗粒形成和分布情况, 400倍高倍镜下计数1000个细胞,计算绿色荧光颗粒细胞数占总细胞数的百分比,而后进行拍照。
3.Simple Western assays 检测LC3a表达:从培养箱中取出细胞,PBS洗涤2次加入适量的RIPA裂解液,于冰上裂解1h。使用移液枪头吹打至细胞充分裂解后将细胞裂解样品转入EP管中, 4℃,12000×g,离心 5min后放入沸水浴 10min。而后4℃,12000×g,离心1min,-80℃保存备用。使用WES全自动蛋白质印迹定量分析系统(美国ProteinSimple公司,WS-2471)检测待测样本中目的基因的蛋白表达量。选用Wes12-230kDa 试剂盒(美国ProteinSimple公司,#77960),将上机前稀释的抗体及其他试剂和稀释变性后的蛋白样本按设定程序加入板中。一抗使用兔抗 MAP1 LC3a (英国Abcam公司,ab52628,1∶30,16kDa),内参使用鼠抗β-actin (美国Santa Cruz公司,sc-69879,1∶20,49kDa),二抗分别使用抗鼠IgG抗体(美国ProteinSimple公司,PS-MK15,1∶1000) 和抗兔IgG抗体(美国ProteinSimple公司,PS-MK 15,1∶1000)。抗体封闭15min,一抗、二抗各孵育30min。使用WES 全自动蛋白质印迹定量分析系统的Compass软件对检测结果进行灰度分析,制作实验报告。
4.统计学方法:应用SPSS 19.0统计学软件对实验组和对照组数据进行t检验,以P<0.05为差异有统计学意义。
结 果
1.MDC染色结果:实验结果显示,NC组成骨细胞内可见少许点状绿色荧光颗粒,KD1、KD2、KD3、KD4、KD5、KD6和KD7 组中成骨细胞胞质和细胞突起内均可见大量点状绿色荧光颗粒。但在KD8、KD9、KD10和KD11组中成骨细胞内点状绿色荧光颗粒明显减少(图1)。
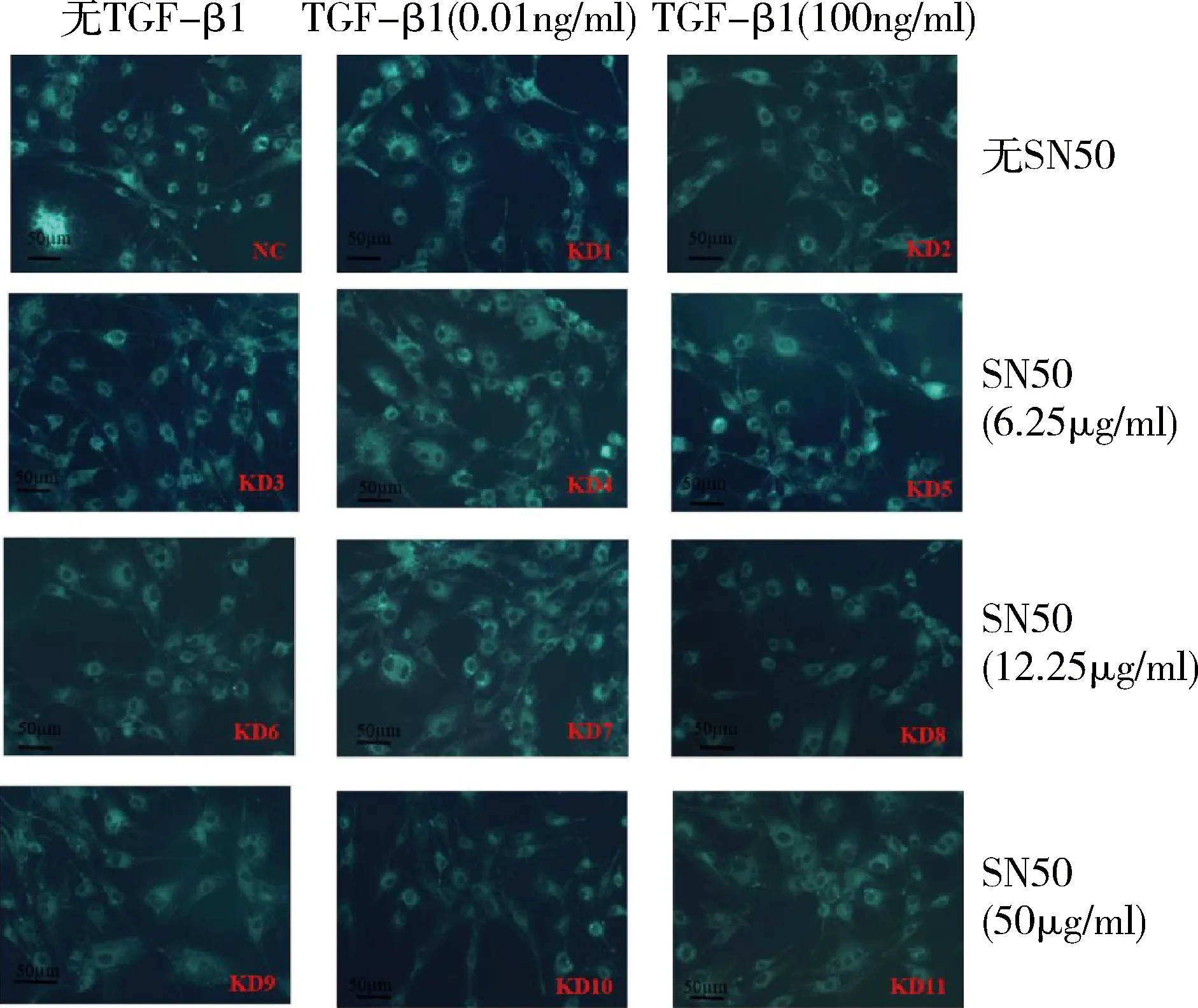
图1 MDC法检测自噬小体形成,绿色荧光颗粒为阳性表达(×400)
2.MDC染色结果:400倍高倍镜下计数1000个细胞,计算各组中点状绿色荧光颗粒细胞数占总细胞数的百分比并进行统计学分析,结果提示KD1、KD2、KD3、KD4、KD5、KD6和KD7 组绿色荧光颗粒细胞数所占总细胞数比例多于NC组,差异有统计学意义(P<0.05)。KD8、KD9、KD10和KD11组中绿色荧光颗粒细胞数所占总细胞数比例少于NC 组,差异有统计学意义(P<0.05,图2)。
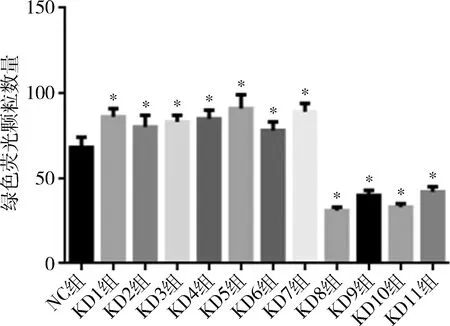
图2 MDC染色结果统计学分析与NC组比较,*P<0.05
3.Simple Western assays结果:LC3a蛋白检测实验结果显示KD1、KD2、KD3、KD4、KD5、KD6和KD7 组中 LC3a蛋白表达明显高于NC组。但是KD8、KD9、KD10和KD11组中LC3a蛋白表达明显低于NC组(图3)。

图3 Simple Western assays法检测LC3a蛋白表达
4.Simple Western assays结果:使用Compass软件对各组LC3a蛋白检测结果进行灰度分析,分析数据显示,KD1、KD2、KD3、KD4、KD5、KD6和KD7 组中MAP1 LC3a/β-actin密度比数值大于NC组,差异有统计学意义(P<0.05)。KD8、KD9、KD10和KD11组中MAP1 LC3a/β-actin密度比数值小于NC组, 差异有统计学意义(P<0.05,图4)。
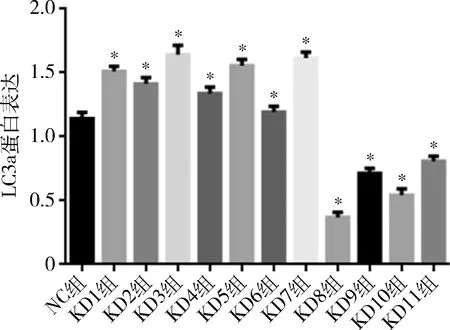
图4 Simple Western assays法检测LC3a蛋白表达与NC组比较,*P<0.05
讨 论
牙齿萌出通道的正常形成需要成骨-破骨细胞间维持动态平衡,这种平衡受到局部骨微环境中各种细胞生长因子的调节[7,8]。TGF-β1是迄今为止已知的最为复杂和最为多样的生长因子,它可以通过作用于成骨细胞调节骨代谢,在牙齿萌出通道形成的骨动态平衡过程中发挥重要作用[9]。自噬是细胞自我保护的重要机制,在维持细胞存活和内环境稳定方面具有重要意义[10,11]。有研究表明,自噬基因在牙齿发育不同阶段均有表达,提示自噬与牙齿发生发育和萌出密切相关[12]。TGF-β1与自噬间关系在不同细胞中呈现不同形式,但在成骨中存在怎样的关系尚不明确[13]。
本研究分别通过检测自噬小体形成和自噬蛋白的表达观察TGF-β1和自噬间可能存在的相关性。MDC法检测自噬小体的形成,结果显示,NC组成骨细胞中可见点状绿色荧光颗粒,KD1、KD2、KD3、KD4、KD5、KD6和KD7组中可见大量绿色荧光颗粒,与NC组比较,差异有统计学意义。Simple Western assays法检测LC3a蛋白表达,结果表明KD1、KD2、KD3、KD4、KD5、KD6和KD7组 LC3a蛋白表达明显高于NC组。以上结果提示: ①成骨细胞本身具有较强的自噬能力;②TGF-β1能显著增强成骨细胞的自噬功能;③TGF-β1对成骨细胞自噬功能的影响可能与其浓度无关。有研究表明,TGF-β1对成骨细胞既有激活作用又有抑制作用,这种差异可能与TGF-β1的局部浓度、作用时间和靶细胞的分化阶段有关[14, 15]。本研究结果显示,与NC组比较,TGF-β1可以促进成骨细胞的自噬功能,但是浓度的进一步增加并不会提高成骨细胞的自噬水平,这为转化生长因子生物学功能研究提供新的实验依据。
TGF-β1作为骨组织局部微环境的重要调节因子,如何调节成骨细胞和破骨细胞的功能来维持骨骼的动态平衡一直是研究的热点[16,17]。通过对小鼠成骨细胞的研究发现,TGF-β1可以通过增加OPG和降低RANKL表达,抑制破骨细胞的形成和减少骨吸收[18]。NF-κB信号通路是维持成骨和破骨细胞动态平衡的重要通路,其通过调节 RANK/RANKL 表达,控制成骨细胞和破骨细胞分化相关信号的表达,影响牙齿萌出通道的形成,在牙齿萌出过程中起着关键作用[19,20]。笔者前期研究发现,当NF-κB信号通路被阻断时,成骨细胞自噬功能下降,提示成骨细胞可能通过NF-κB信号通路调节其自噬功能[6]。
根据前期成熟的实验条件,分别使用浓度为6.25、12.5和25μg/ml的SN50阻断NF-κB信号通路,而后进行功能检测。结果表明,浓度为25μg/ml的SN50(KD9组)与NC组比较,成骨细胞中绿色荧光颗粒细胞的数量明显减少。Simple Western assays分析结果显示,KD9组LC3a蛋白的表达较NC组明显降低,提示浓度为25μg/ml的 SN50可以成功阻断成骨细胞 NF-κB信号通路,并且当NF-κB通路被阻断后成骨细胞自噬功能受到抑制。为了进一步探讨TGF-β1、NF-κB信号通路和自噬三者之间关系,笔者在阻断NF-κB信号通路的成骨细胞中再次加入不同浓度的TGF-β1 (KD10、KD11组),再次观察自噬小体的形成和自噬相关因子LC3a蛋白的表达。KD10和 KD11组绿色荧光颗粒细胞数明显少于NC 组。Simple Western assays分析结果显示,KD10组和 KD11组LC3a蛋白的表达明显低于NC组,提示当NF-κB通路被阻断时,再次加入的TGF-β1不能上调成骨细胞的自噬水平,即TGF-β1可能介导NF-κB 信号通路影响成骨细胞的自噬功能。
牙齿萌出通道骨动态平衡机制的深入探讨将为牙齿萌出障碍的诊治提供有效理论基础。TGF-β1、NF-κB信号通路和自噬均与成骨细胞生物学性能密切相关,本研究初步探讨了三者在成骨细胞分化中的可能调控机制,为进一步了解牙齿萌出通道形成中骨动态平衡调节提供一定的理论和实验依据。由于实验条件的限制,本研究并没有完全阐明 TGF-β1、NF-κB信号通路和自噬之间的关系,通过增加实验指标和动物模型来进一步探讨三者之间的相关性,是今后研究的重点。
