生物制剂在口腔扁平苔藓治疗中的应用
2022-03-29孙雨桐
孙雨桐,江 潞
口腔扁平苔藓(oral lichen planus,OLP)是一种慢性炎性黏膜疾病,病程迁延,好发于中老年女性[1-2]。OLP病因不明,目前认为主要与局部或全身超敏反应、T细胞介导的免疫应答、丙型肝炎病毒感染、心理精神因素等有关[3]。有证据提示OLP是一种自身免疫性疾病,其发病机制可分为特异性免疫和非特异性免疫。特异性免疫机制主要是CD4+辅助T淋巴细胞和CD8+毒性T淋巴细胞发挥关键作用;非特异性免疫机制与上皮基底膜、基质金属蛋白酶(matrix metalloproteinases,MMPs)、趋化因子和肥大细胞介导的病理过程相关[4-5]。皮质类固醇目前仍然是治疗OLP的一线药物。环孢素、他克莫司、硫唑嘌呤、霉酚酸酯等免疫抑制剂也常用于OLP的治疗[3,6]。对于大多数OLP患者,皮质类固醇和免疫抑制剂能有效控制病损并减轻症状,但一些患者表现为不敏感或治疗抵抗。生物制剂是一类在特定的活细胞中进行工程设计,通过注射使用的大分子蛋白质(包括单克隆抗体和受体融合蛋白)可直接作用于免疫细胞表面或胞外分子[7]。生物制剂已被用于银屑病、克罗恩病、类天疱疮等自身免疫相关疾病的治疗[8-10]。研究发现生物制剂对常规药物治疗不敏感或抵抗的OLP患者显示出有效性[11-12]。本文就近年来生物制剂治疗OLP的机制、疗效、预后及不良反应进行回顾与总结,以期为OLP的临床治疗提供参考。
1 生物制剂的种类及应用
1.1 T细胞靶向生物制剂
1.1.1 阿法赛特(Alefacept) Alefacept是一种人淋巴细胞功能相关抗原-3(lymphocyte function associated antigen-3,LFA-3)/免疫球蛋白G1(immunoglobulin G1,IgG1)的融合蛋白,可与T细胞表面的白细胞分化抗原2(cluster of differentiation,CD2)分子相结合,达到阻断抗原呈递细胞(antigen-presenting cells,APC)表面LFA-3与T细胞表面CD2的结合的作用。它还可选择性地靶向记忆T细胞,抑制T细胞的激活并诱导记忆T细胞凋亡[7]。2006年报道了2例OLP患者皮质类固醇、抗组胺药、羟氯喹、硫唑嘌呤、环孢素及他克莫司治疗均未获得明显疗效,肌注Alefacept后病情迅速缓解[13]。2008年一项临床研究随机纳入7例OLP患者,5例接受安慰剂治疗,2例接受Alefacept治疗,结果同样显示出Alefacept治疗的有效性(表1)[14]。
1.1.2 依法利珠单抗(Efalizumab) Efalizumab是一种针对CD11a(LFA-1的亚基)的人源化单克隆IgG1抗体,能阻断T细胞表面LFA-1和APC表面细胞间粘附分子1之间的相互作用,干扰APC对T细胞的刺激,从而影响抗原呈递。Efalizumab还可以抑制循环淋巴细胞外渗及活化T细胞与角质形成细胞的相互作用[7]。病案报道显示,对1例全身使用强的松联合他克莫司局部使用无效的OLP患者注射Efalizumab,患者症状明显改善且未见明显不良反应[15]。随后的一项临床研究显示,4例糜烂型OLP患者利用Efalizumab治疗后症状与体征明显缓解(表1)[16]。
1.1.3 巴利昔单抗(Basiliximab) Basiliximab是一种白细胞介素-2(interleukin-2,IL-2)/IgG1嵌合的单克隆抗体,它可以竞争结合T细胞表面IL-2受体α链从而抑制IL-2依赖的T细胞活化,已经应用于预防成人肾移植急性器官排斥反应的诱导治疗[17-18]。2002年1例糖尿病患者因长期口服环孢素治疗OLP出现牙龈增生,在停用环孢素后静脉输注Basiliximab,症状得到迅速缓解,但由于费用问题未能继续用药后症状复发,经环孢素治疗,病情得到控制(表1)[19]。除可能出现免疫排斥反应外[17],Basiliximab暂无其他不良反应。
1.2 B细胞靶向生物制剂
利妥昔单抗(Rituximab)是一种人鼠嵌合的抗CD20(B淋巴细胞膜特异性标志物)的IgG1抗体,靶向正常和恶性的B淋巴细胞,已被证实对包括寻常型天疱疮在内的多种自身免疫性疾病具有良好的疗效[9,20]。1例OLP患者在全身使用皮质类固醇及局部使用他克莫司治疗3个月后出现骨量减少及肾功能异常,随后接受了Rituximab治疗,患者症状明显改善[21]。另有2例OLP患者,其中1例患者采用局部皮质类固醇和他克莫司联合全身泼尼松龙和麦考酚酸酯治疗后症状无明显缓解,随后注射Rituximab同时口服泼尼松龙4周后症状缓解。另1例患者使用曲安奈德局部治疗无效,口服类固醇类药物时出现过严重的精神症状,并且对麦考酚酸酯过敏,在接受了Rituximab治疗后8个月病情无复发(表1)[11]。Rituximab在OLP中的疗效提示B细胞在OLP的发病过程中可能发挥重要作用。Rituximab治疗的常见副作用包括输液反应、寒战、发热、皮疹、白细胞减少和感染、重新激活乙型肝炎病毒进而造成严重的肝损伤[22]。
1.3 TNF-α抑制剂
1.3.1 依那西普(Etanercept) Etanercept是一种重组人肿瘤坏死因子(tumour necrosis factor-α,TNF-α)受体融合蛋白,由2个可溶性人TNF-α受体的细胞外结构域和1个稳定分子的人IgG Fc片段组成。它可以结合两个TNF-α分子来作为内源性TNF-α的竞争性抑制剂[7,23]。1例糜烂型OLP患者在局部使用皮质类固醇、他克莫司,口服硫唑嘌呤、维A酸后无明显改善,全身使用强的松后出现糖尿病和高血压。改用Etanercept后,症状改善,糜烂愈合,未见严重不良反应[24]。有报道提示,Etanercept导致的皮肤黏膜不良反应包括注射部位荨麻疹样反应、皮肤感染、湿疹、牛皮癣、多形性红斑和鳞状细胞癌[25]。
1.3.2 英夫利昔单抗(Infliximab) Infliximab是一种人鼠嵌合的IgG1单克隆抗体,通过结合可溶性TNF-α及膜结合TNF-α,中和体内TNF-α与细胞表面受体结合产生的相互作用[7, 23]。由于Infliximab的嵌合组分比Etanercept和Adalimumab具有更高的免疫原性,可能增加了抗药物抗体的产生和输液反应发生的风险。2008年有学者报道了1例严重糜烂的OLP患者,口服皮质类固醇及霉酚酸酯类药物无明显好转,采用静脉输注Infliximab后,病情好转(表1)[26]。
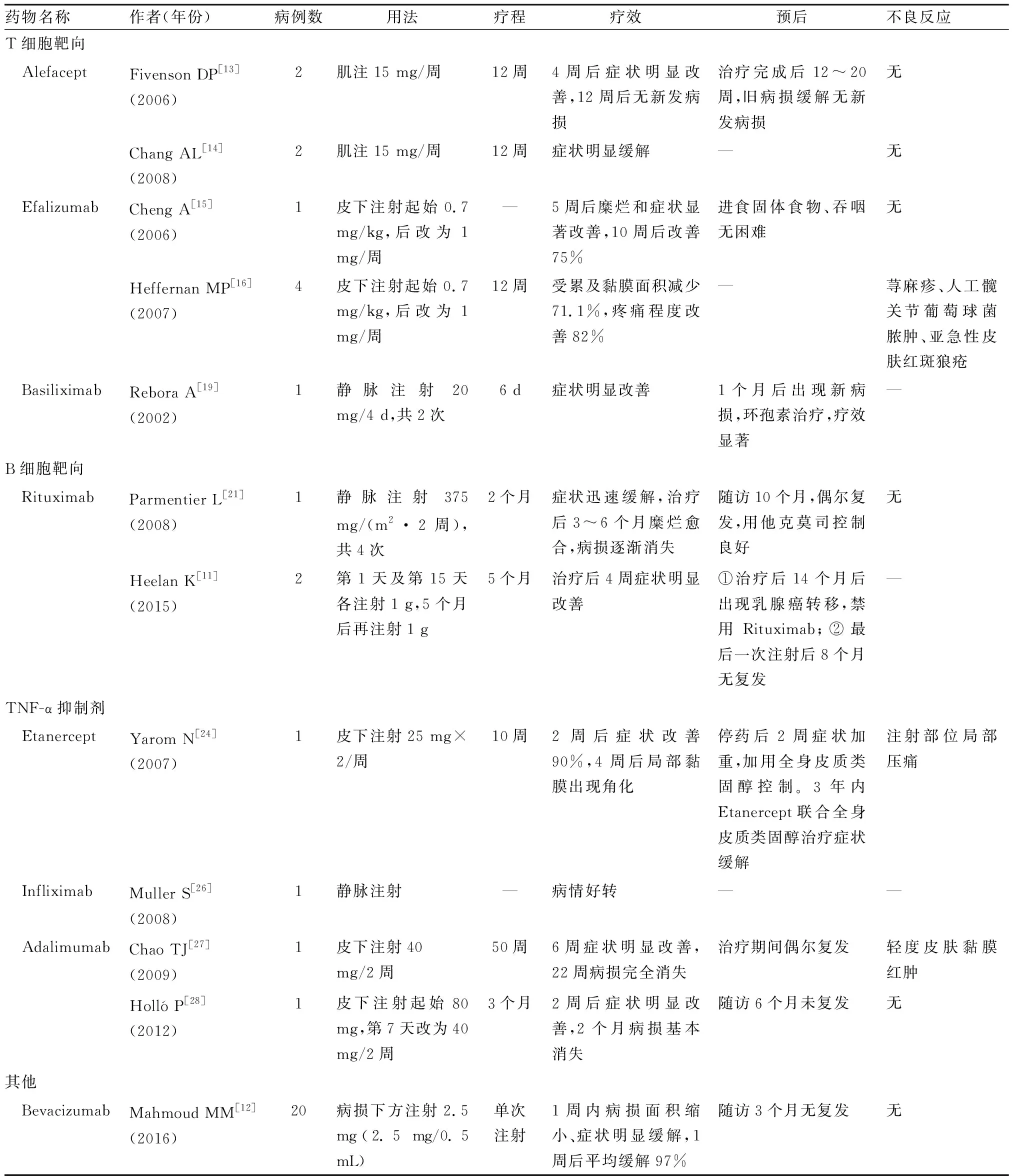
表1 生物制剂治疗OLP的病案报道Tab.1 Cases of biologics for OLP treatment
1.3.3 阿达木单抗(Adalimumab) Adalimumab是一种完全人源IgG1亚型单克隆抗体,能结合可溶性及膜结合的TNF-α,具有较高的亲和力和特异性[7,23]。2009年报道了1例OLP患者由于向心性肥胖、高胆固醇血症、2型糖尿病希望减少使用泼尼松,对甲氨蝶呤、维A酸联合局部药物的治疗方案不敏感,在接受Adalimumab治疗后,病损几乎完全消退[27]。2012年一篇病案分析显示1例OLP患者在局部及全身应用类固醇、补骨脂素+UVA(A波段紫外线)、阿维A治疗3个月后无明显疗效,改用Adalimumab后,病情迅速得到控制,随访6个月病情无复发且无明显不良反应[28]。Adalimumab可能会引起皮肤扁平苔藓或者苔藓样反应[29-30]。
1.4 其他
贝伐珠单抗(Bevacizumab)是一种重组的人源IgG1单克隆抗体,可结合血管内皮生长因子-A(vascular endothelial growth factor-A,VEGF-A)家族所有亚型及其生物活性蛋白水解片段,阻止内皮细胞上的血管内皮生长因子受体1(vascular endothelial growth factor receptor1,VEGFR1)和血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)激活,从而抑制新生血管生成,减少免疫细胞浸润和炎症因子产生,有效切断活跃的炎症反应和营养物质供应[31]。一项随机对照试验显示,针对糜烂及萎缩型OLP患者,局部注射Bevacizumab疗效明显优于外用0.1%曲安奈德丙酮酸软膏,且无明显不良反应[12]。据报道Bevacizumab常见的不良反应包括血栓栓塞、蛋白尿和高血压[31]。
2 总 结
OLP的发病与自身免疫系统相关,可分为特异性免疫和非特异性免疫。特异性免疫指由角质形成细胞抗原呈递(MHC Ⅰ类),角质形成细胞和朗格汉斯细胞抗原呈递(MHC Ⅱ类)导致的CD4+辅助T细胞活化并诱导其释放细胞因子(如IL-2和干扰素-γ(interferon-γ,IFN-γ)),通过以上两种方式激活CD8+毒性T细胞,释放多种细胞因子(如IL-2、TNF-α)。活化后的CD8+毒性T细胞通过分泌TNF-α与角质形成细胞表面相应受体作用,诱导角质形成细胞凋亡[1,4]。Alefacept、Efalizumab和Basiliximab可以通过与T细胞表面CD2、LFA-1和IL-2受体结合,阻断抗原呈递,抑制T细胞活化,从而减少上皮角质形成细胞的损伤。非特异性免疫是由肥大细胞释放促炎介质(如TNF-α)辅助CD8+毒性T细胞从血管内迁移到细胞外基质中,释放糜蛋白酶,上调MMPs,破坏基底膜,使CD8+毒性T细胞向上皮迁移,进一步诱导角质形成细胞凋亡[5,32]。活化的CD8+毒性T细胞产生的趋化因子可募集肥大细胞等炎性细胞,继续释放TNF-α和趋化因子,使炎症持续[4]。Etanercept、Infliximab和Adalimumab作为TNF-α抑制剂可以结合可溶性TNF-α以及膜结合TNF-α,减少T细胞活化浸润,从而抑制角质形成细胞发生凋亡。另外血管生成在OLP中有重要作用,新生的血管会促进淋巴细胞、单核细胞等炎症细胞的浸润[33],其他生物制剂如Bevacizumab通过结合VEGF-A抑制病变部位新生血管形成,从而有效切断活跃的炎症反应过程中营养的供应。Rituximab通过作用于B细胞表面特异性受体CD20来清除B细胞进而达到治疗OLP的目的(图1)。

LFA-3:人淋巴细胞功能相关抗原-3;CD2:白细胞分化抗原2;APC:抗原呈递细胞;LFA-1:人淋巴细胞功能相关抗原-1;ICAM-1:细胞间粘附分子-1;IL-2:白细胞介素-2;IL-2R:白细胞介素-2受体;CD20:白细胞分化抗原20;TNF-α:肿瘤坏死因子-α;TNF-αR:肿瘤坏死因子-α受体;VEGF-A:血管内皮生长因子-A家族;VEGF-R:血管内皮生长因子受体
生物制剂在OLP治疗中的运用优势主要针对于OLP患者几个特点:①对于全身使用皮质类固醇、环孢素以及其他免疫抑制剂如硫唑嘌呤、霉酚酸酯等后表现为不敏感甚至抵抗;②对于上述药物过敏或治疗后发生严重不良反应;③因严重的基础性疾病不能使用上述药物。目前研究生物制剂治疗OLP的随访时间从2个月到1年不等,大部分患者在使用生物制剂治疗2周到3个月后病情获得显著控制(表1)。关于治疗相关的不良反应,除使用Efalizumab的1例患者发生严重感染及亚急性皮肤红斑狼疮外,其余生物制剂在治疗OLP过程中均无严重不良反应的报道。值得注意的是,有研究报道患者使用TNF-α抑制剂治疗类风湿关节炎、银屑病、炎性肠病后会发生扁平苔藓或苔藓样反应[29,34],可能与TNF-α抑制剂的使用破坏了TNF-α与IFN-α之间的平衡导致免疫失调相关[35]。
综上,生物制剂在OLP的治疗中显示出有效性,但临床应用目前还存在以下问题:治疗成本高;缺乏长期疗效的相关资料;治疗相关的不良反应;尚无正式的临床应用指南。未来关于生物制剂在OLP治疗中的应用还有待进一步研究。
