苦杏仁皮中膳食纤维和黄酮同步提取工艺的优化
2022-03-29黄琼连周敏贤龙江玲黄莹莹杨婷夏荃
黄琼连 周敏贤 龙江玲 黄莹莹 杨婷 夏荃

中图分类号 R284.2 文献标志码 A 文章编号 1001-0408(2022)06-0724-06
DOI 10.6039/j.issn.1001-0408.2022.06.13
摘 要 目的 优化苦杏仁皮中膳食纤维和黄酮的同步提取工艺。方法 采用酶-重量法计算膳食纤维含量,采用紫外分光光度法测定黄酮含量;以料液比、pH、木瓜蛋白酶溶液浓度、α-淀粉酶溶液浓度、酶解温度和酶解时间为因素,膳食纤维和黄酮含量为指标,采用单因素实验和正交实验设计优化提取工艺。结果 最优提取工艺为料液比1 ∶ 10(g/mL)、pH5、木瓜蛋白酶溶液浓度0.5%、α-淀粉酶溶液浓度0.5%、酶解温度50 ℃、酶解时间1 h。经3次实验验证,得膳食纤维的平均含量为0.801 g/g(RSD=1.95%),黄酮的平均含量为2.135 mg/g(RSD=2.44%),平均综合评分为0.988分(RSD=0.81%)。结论 所得最优提取工艺稳定、可行。
关键词 苦杏仁皮;膳食纤维;黄酮;正交实验设计;同步提取;工艺优化
Optimization of the simultaneous extraction technology of dietary fiber and flavonoids from the peel of Prunus armeniaca
HUANG Qionglian1,ZHOU Minxian2,LONG Jiangling3,HUANG Yingying3,YANG Ting3,XIA Quan3(1. Institute of Chinese Medical Surgery, Longhua Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China; 2. Guangzhou Hangu Traditional Chinese Medicine Clinic Co., Ltd., Guangzhou 510620, China; 3. College of Traditional Chinese Medicine, Guangzhou University of Chinese Medicine, Guangzhou 510006, China)
ABSTRACT OBJECTIVE To optimize the simultaneous extraction technology of dietary fiber (DF) and flavonoids from the peel of Prunus armeniaca. METHODS The content of DF was calculated with enzyme-gravimetric method, and the content of flavonoids was determined by ultraviolet spectrophotometry. The orthogonal design and single factor test were used to optimize the extraction technology, with the factors of liquid-solid ratio, pH, papain concentration, α-amylase concentration, temperature of enzymatic hydrolysis and time of enzymatic hydrolysis as factors, using the contents of DF and flavonoids as indexes. RESULTS The optimal extraction technology included the solid-liquid ratio of 1 ∶ 10 (g/mL), pH5, 0.5% papain and 0.5% α-amylase, enzymatic hydrolysis at 50 ℃ for 1 h. After three times of validation, the average content of DF was 0.801 g/g (RSD=1.95%), and the average content of flavonoids was 2.135 mg/g (RSD=2.44%). The average comprehensive score was 0.988 (RSD=0.81%). CONCLUSIONS The optimal extraction technology is stable and feasible.
KEYWORDS the peel of Prunus armeniaca; dietary fiber; flavonoids; orthogonal design; simultaneous extracxtion; technology optimization
苦杏仁為蔷薇科植物山杏Prunus armeniaca L. var.ansu Maxim.、西伯利亚杏Prunus sibirica L.、东北杏Prunus mandshurica(Maxim.)Koehne或杏Prunus armeniaca L.的干燥成熟种子,具有降气、止咳平喘、润肠通便的功效,可用于临床治疗肠燥便秘、咳嗽气喘、胸满痰多等[1]。苦杏仁是常用大宗中药品种,同时也是药食两用品种,需求量大。苦杏仁常采用 法去除种皮后应用,因此作为苦杏仁的副产物,苦杏仁皮的年丢弃量较大[2]。这既会造成苦杏仁皮堆积浪费、苦杏仁应用成本增加,又会使其成为药品或食品生产企业工业废弃物的来源之一,给环境治理造成一定压力[3]。
有研究指出,苦杏仁皮中含有多种功能性成分,如膳食纤维(dietary fiber,DF)、黄酮、酚酸和黑色素、花青素、绿原酸等[3-6]。其中,DF被称为第7类营养元素,在苦杏仁皮中的含量高达45%以上,具有改善肠道菌群、调节血脂血糖、预防结肠癌和清除自由基等药理作用[3,7];黄酮类化合物具有抗氧化、抗炎、改善心血管功能等作用[8-9],文连君等[10]以微波辅助工艺提取了苦杏仁皮总黄酮,发现其含量可达9~15 mg/g。可见,如何提高苦杏仁皮的高值化利用、避免資源浪费,已成为相关研究的热点之一。目前,虽有学者对苦杏仁皮中功能性成分的提取进行了相关研究,但仅限于单一成分,且存在设备要求高、经济效益低、二次环境污染等问题[10-13]。生物酶辅助提取可根据植物药材细胞壁的结构特点,利用酶反应使细胞壁组分水解或降解,具有高度专一、反应条件温和、操作简便、提取率高、环境污染少等优点[14-15]。同步提取可综合利用苦杏仁皮的有效成分,具有一提多效的效果,可提高苦杏仁皮的利用率。基于此,本研究以生物酶辅助同步提取法提取苦杏仁皮中的DF和黄酮,采用酶-重量法测定DF含量[16],采用紫外分光光度法检测黄酮含量(以芦丁计);同时以料液比、pH、木瓜蛋白酶溶液浓度、α-淀粉酶溶液浓度、酶解温度和酶解时间为考察因素,DF和黄酮含量为指标,采用正交实验设计对其提取工艺进行优化,旨在为苦杏仁皮的高值化利用提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有T2602S型双光束紫外分光光度计(上海佑科仪器仪表有限公司)、T1000型电子天平(常熟市双杰测试仪器厂)、AUY120型电子分析天平(广州湘仪机电设备有限公司)、KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司)等。
1.2 主要药品与试剂
芦丁对照品(批号T27F10Z81699,纯度≥98%)购自上海源叶生物科技有限公司;α-淀粉酶(批号C11581550,规格4 000 U/g)购自上海麦克林生化科技有限公司;木瓜蛋白酶(批号170108,规格≥1 000 000 U/g)购自上海蓝季科技发展有限公司;无水乙醇、乙酸乙酯、氢氧化钠、亚硝酸钠、硝酸铝、冰醋酸均为分析纯,水为蒸馏水。
苦杏仁皮(批号YY-190501)由岭南中药饮片有限公司提供,经广州中医药大学中药学院吴文如副教授鉴定为蔷薇科植物杏P. armeniaca L.的干燥成熟种皮。苦杏仁皮经干燥、粉碎,过40目筛,密封保存,备用。
2 方法与结果
2.1 苦杏仁皮中DF和黄酮的同步提取
取苦杏仁皮粉末约10 g,精密称定,置于圆底烧瓶中,按料液比1 ∶ 10(g/mL,下同)加水适量,超声(功率500 W,频率70 kHz)处理5 min,在pH5(以10%乙酸溶液和4%氢氧化钠溶液调节pH值)条件下加入0.5%的木瓜蛋白酶溶液(取木瓜蛋白酶,用蒸馏水溶解)和0.5%的α-淀粉酶溶液(取α-淀粉酶,用蒸馏水溶解),在50 ℃水浴中酶解1 h,煮沸10 min灭活,冷却;加入4倍体积的60%乙醇,醇沉30 min后,抽滤,收集滤液,回收乙醇至170~200 mL,用等体积乙酸乙酯萃取3次,每次30 min,收集萃取液,挥干溶剂,即得黄酮浸膏;滤渣干燥至恒定质量[17],即得DF。
2.2 DF的含量测定
参考相关文献[16],采用酶-重量法计算DF含量:DF含量(g/g)=DF质量/苦杏仁皮粉末质量。
2.3 黄酮的含量测定
采用亚硝酸钠-硝酸铝-氢氧化钠显色法显色,以紫外分光光度计进行检测[18]。
2.3.1 对照品贮备液的制备 取芦丁对照品适量,精密称定,加50%乙醇溶解,混匀,制得质量浓度为204.4 µg/mL的对照品贮备液。
2.3.2 供试品溶液的制备 取苦杏仁皮粉末10 g,按“2.1”项下方法制得萃取液,蒸干,残渣加50%乙醇溶解并定容至10 mL,混匀,即得供试品溶液。
2.3.3 线性关系考察 精密移取质量浓度为162.2 µg/mL的芦丁对照品溶液(按“2.3.1”项下方法制得)1.0、2.0、2.5、3.0、4.0、4.5 mL,分别置于10 mL量瓶中,加5%亚硝酸钠溶液0.4 mL,摇匀,静置6 min后,加10%硝酸铝溶液0.4 mL,摇匀,静置6 min后,加4%氢氧化钠溶液4 mL,再加50%乙醇定容,摇匀,静置15 min,用50%乙醇定容,混匀,制成质量浓度为16.22、32.44、40.55、48.66、64.88、72.99 µg/mL的系列线性工作溶液。以50%乙醇为空白对照,采用紫外分光光度计于510 nm波长处测定吸光度[18]。以芦丁质量浓度(X)为横坐标、吸光度(Y)为纵坐标进行线性回归,得回归方程为Y=11.481 0X+0.043 5(r=0.999 5),表明芦丁检测质量浓度在16.22~72.99 µg/mL范围内与吸光度成良好的线性关系。
2.3.4 精密度试验 精密移取“2.3.1”项下对照品贮备液,用50%乙醇稀释至质量浓度为20.44 µg/mL,取适量按“2.3.3”项下方法显色后(自“加5%亚硝酸钠溶液0.4 mL”开始操作,下同),以50%乙醇为空白对照,采用紫外分光光度计于510 nm波长处连续测定5次吸光度。结果显示,吸光度的RSD为0.09%(n=5),表明仪器精密度良好。
2.3.5 重复性试验 取苦杏仁皮粉末约10 g,精密称定,共5份,分别按“2.3.2”项下方法制备供试品溶液,再按“2.3.3”项下方法显色后,以50%乙醇为空白对照,采用紫外分光光度计于510 nm波长处测定吸光度并按标准曲线法计算样品中黄酮的质量浓度,然后按下式计算含量:黄酮含量(mg/g)=c×V×n/m。式中,c为样品中黄酮的质量浓度;V为最初定容的体积;n为稀释倍数;m为苦杏仁皮粉末的质量[19]。结果显示,黄酮含量的RSD为3.80%(n=5),表明方法重复性良好。
2.3.6 稳定性试验 取“2.3.2”项下供试品溶液,分别于室温下放置10、20、30、40、50、60 min时按“2.3.3”项下方法显色后,以50%乙醇为空白对照,采用紫外分光光度计于510 nm波长处测定吸光度。结果显示,吸光度的RSD为2.42%(n=6),表明供试品溶液于室温下放置60 min内稳定性良好。
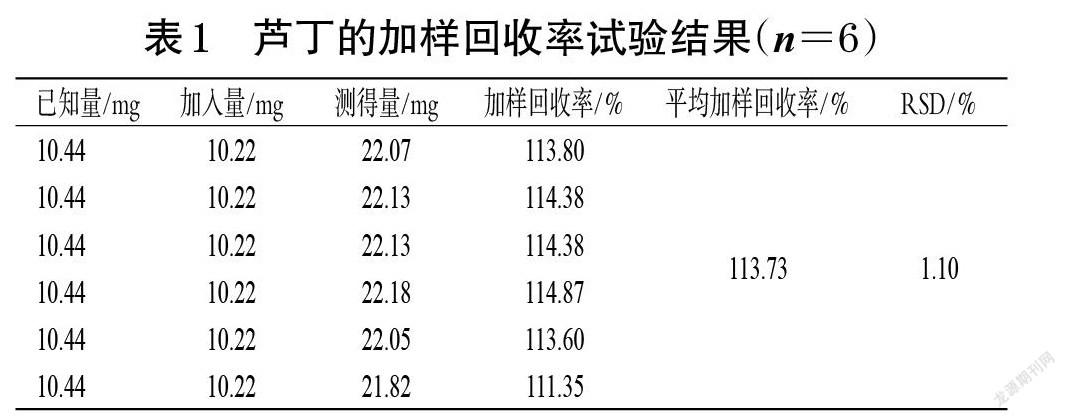
2.3.7 加样回收率试验 取苦杏仁皮粉末约5 g,精密称定,共6份,分别加入“2.3.1”項下对照品贮备液10 mL,按“2.3.2”项下方法制备供试品溶液,再按“2.3.3”项下方法显色后,以50%乙醇为空白对照,采用紫外分光光度计于510 nm波长处测定吸光度并计算加样回收率,结果见表1。
2.3.8 样品含量测定 取苦杏仁皮粉末约10 g,精密称定,按“2.3.2”项下方法制备供试品溶液,再按“2.3.3”项下方法显色后,以50%乙醇为空白对照,采用紫外分光光度计于510 nm波长处测定吸光度并按“2.3.5”项下方法计算样品含量。
2.4 苦杏仁皮中DF和黄酮提取工艺优化的单因素实验
2.4.1 料液比 取苦杏仁皮粉末约10 g,精密称定,固定pH6、木瓜蛋白酶溶液浓度0.5%、α-淀粉酶溶液浓度1.5%、酶解温度65 ℃、酶解时间2 h,按“2.1”项下方法同步提取DF和黄酮,分别按“2.2”“2.3.8”项下方法计算两者含量,考察不同料液比(1 ∶ 10、1 ∶ 20、1 ∶ 30)对DF和黄酮含量的影响。各条件平行操作3次,取平均值,结果见图1A。由图1A可知,随着料液比的降低,DF含量逐渐降低,黄酮含量呈先增加后降低的趋势;当料液比为1 ∶ 10时,DF含量最高;当料液比为1∶20时,黄酮含量最高;经one-way ANOVA检验可知,料液比对DF和黄酮含量的影响均有统计学意义(P<0.05),故选择料液比1 ∶ 10~1 ∶ 30进行后续实验。
2.4.2 pH 取苦杏仁皮粉末约10 g,精密称定,固定料液比1 ∶ 20、木瓜蛋白酶溶液浓度0.5%、α-淀粉酶溶液浓度1.5%、酶解温度65 ℃、酶解时间2 h,按“2.1”项下方法同步提取DF和黄酮,分别按“2.2”“2.3.8”项下方法计算两者含量,考察不同pH(5、6、7)对DF和黄酮含量的影响。各条件平行操作3次,取平均值,结果见图1B。由图1B可知,随着pH的增加,DF含量呈先略降低后略增加的趋势,但总体较平稳,黄酮含量逐渐降低;当pH为7时,DF含量最高;当pH为5时,黄酮含量最高;经one-way ANOVA检验可知,pH对DF和黄酮含量的影响均有统计学意义(P<0.05),故选择pH5~7进行后续实验。
2.4.3 木瓜蛋白酶溶液浓度 取苦杏仁皮粉末约10 g,精密称定,固定料液比1 ∶ 20、pH6、α-淀粉酶溶液浓度1.5%、酶解温度65 ℃、酶解时间2 h,按“2.1”项下方法同步提取DF和黄酮,分别按“2.2”“2.3.8”项下方法计算两者含量,考察不同木瓜蛋白酶溶液浓度(0.1%、0.5%、0.9%)对DF和黄酮含量的影响。各条件平行操作3次,取平均值,结果见图1C。由图1C可知,随着木瓜蛋白酶溶液浓度的增加,DF和黄酮含量均呈先降低后增加的趋势,均在木瓜蛋白酶溶液浓度为0.1%时达到峰值;经one-way ANOVA检验可知,木瓜蛋白酶溶液浓度对DF和黄酮含量的影响均有统计学意义(P<0.05),故选择木瓜蛋白酶溶液浓度0.1%~0.9%进行后续实验。
2.4.4 α-淀粉酶溶液浓度 取苦杏仁皮粉末约10 g,精密称定,固定料液比1 ∶ 20、pH6、木瓜蛋白酶溶液浓度0.5%、酶解温度65 ℃、酶解时间2 h,按“2.1”项下方法同步提取DF和黄酮,分别按“2.2”“2.3.8”项下方法计算两者含量,考察不同α-淀粉酶溶液浓度(0.5%、1.5%、2.5%)对DF和黄酮含量的影响。各条件平行操作3次,取平均值,结果见图1D。由图1D可知,随着α-淀粉酶溶液浓度的增加,DF含量呈先降低后增加的趋势,当α-淀粉酶溶液浓度为0.5%时达到最高;黄酮含量呈先增加后降低的趋势,当α-淀粉酶溶液浓度为1.5%时达到最高;经one-way ANOVA检验可知,α-淀粉酶溶液浓度对DF和黄酮含量的影响均有统计学意义(P<0.05),故选择α-淀粉酶溶液浓度0.5%~2.5%进行后续实验。
2.4.5 酶解温度 取苦杏仁皮粉末约10 g,精密称定,固定料液比1 ∶ 20、pH6、木瓜蛋白酶溶液浓度0.5%、α-淀粉酶溶液浓度1.5%、酶解时间2 h,按“2.1”项下方法同步提取DF和黄酮,分别按“2.2”“2.3.8”项下方法计算两者含量,考察不同酶解温度(50、65、80 ℃)对DF和黄酮含量的影响。各条件平行操作3次,取平均值,结果见图1E。由图1E可知,随着酶解温度的增加,DF和黄酮含量均无明显变化;经one-way ANOVA检验可知,酶解温度对DF含量的影响无统计学意义(P>0.05),而对黄酮含量的影响有统计学意义(P<0.05),故从经济和节能角度考虑,暂不将酶解温度作为后续正交实验的考察因素,选择酶解温度50 ℃。
2.4.6 酶解时间 取苦杏仁皮粉末约10 g,精密称定,固定料液比1 ∶ 20、pH6、木瓜蛋白酶溶液浓度0.5%、α-淀粉酶溶液浓度1.5%、酶解温度50 ℃,按“2.1”项下方法同步提取DF和黄酮,分别按“2.2”“2.3.8”项下方法计算两者含量,考察不同酶解时间(1、2、3 h)对DF和黄酮含量的影响。各条件平行操作3次,取平均值,结果见图1F。由图1F可知,随着酶解时间的延长,DF和黄酮含量均无明显变化;经one-way ANOVA检验可知,酶解时间对DF和黄酮含量的影响均无统计学意义(P>0.05),故从经济和节能角度考虑,暂不将酶解时间作为后续正交实验的考察因素,选择酶解时间1 h。
2.5 苦杏仁皮中DF和黃酮提取工艺优化的正交实验
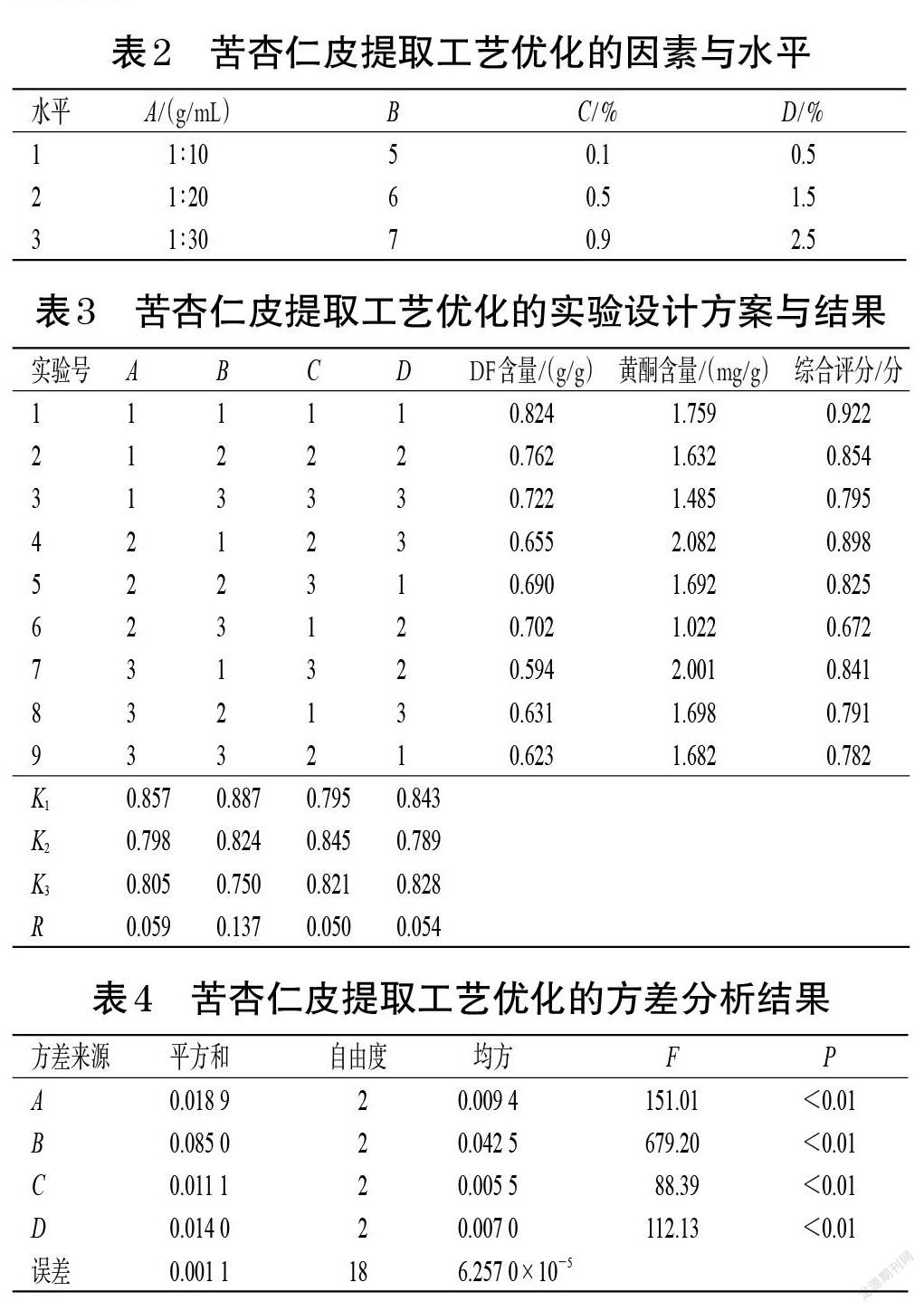
2.5.1 正交实验 在单因素实验的基础上,以料液比(A)、pH(B)、木瓜蛋白酶溶液浓度(C)、α-淀粉酶溶液浓度(D)为考察因素,DF和黄酮含量为指标,采用L9(34)正交表进行实验设计。将DF和黄酮含量分别赋予50%的权重计算综合评分:综合评分=(DF含量/DF含量最大值)×0.5+(黄酮含量/黄酮含量最大值)×0.5。综合评分越高,表示在该实验因素条件下,苦杏仁皮中DF和黄酮的含量越高[20-21]。苦杏仁皮提取工艺优化的因素与水平见表2,实验设计方案与结果见表3,方差分析结果见表4。
由表3可知,各因素对DF和黄酮含量影响的大小顺序依次为B>A>D>C,即pH>料液比>α-淀粉酶溶液浓度>木瓜蛋白酶溶液浓度,得到最优提取工艺为A1B1C2D1,即料液比1 ∶ 10、pH5,木瓜蛋白酶溶液浓度0.5%、α-淀粉酶溶液浓度0.5%。各因素对DF和黄酮含量的影响均有统计学意义(P<0.01),其中pH的影响最大,随后依次为料液比、α-淀粉酶溶液和木瓜蛋白酶溶液浓度,方差分析结果和极差分析结果一致。
2.5.2 最优提取工艺的确定 综合分析单因素和正交实验结果,得到最优提取工艺如下:料液比1 ∶ 10、pH5、木瓜蛋白酶溶液浓度0.5%、α-淀粉酶溶液浓度0.5%、酶解温度50 ℃、酶解时间1 h。
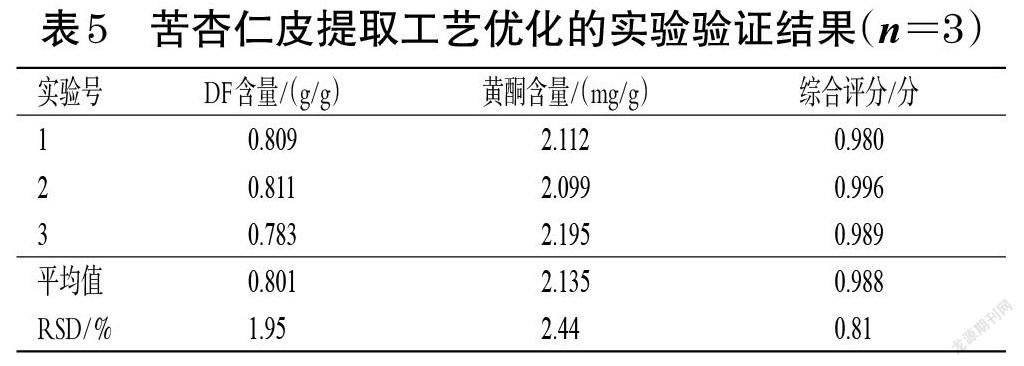
2.5.3 验证实验 取苦杏仁皮粉末约10 g,精密称定,按上述最优提取工艺同步提取DF和黄酮,分别按“2.2”“2.3.8”项下方法计算两者含量。平行操作3次,取平均值,结果见表5。由表5可知,DF的平均含量为0.801 g/g(RSD=1.95%,n=3),黄酮的平均含量为2.135 mg/g(RSD=2.44%,n=3),平均综合评分为0.988分(RSD=0.81%,n=3),表明所得最优提取工艺稳定、可行。
3 讨论
随着苦杏仁及其炮制品在药品、保健品、食品等领域的广泛应用,使得其副产物苦杏仁皮的废弃量较大,考虑到苦杏仁皮中DF、黄酮的药用价值,故有必要对其资源化利用方法进行探讨,以挖掘其潜在价值,减少环境污染,促进其在保健、医药和轻工日化等方面的高值化利用。苦杏仁皮中的DF可通过改善肠道菌群来促进胃肠运动,维持大肠上皮细胞健康,具有预防慢性肾病的功效[22];此外,DF可提高食品的营养阈值,还具有改善棉织物涂层的微观结构、成为新型抗氧化包装膜等应用价值[23-24]。黄酮作为抗氧化剂,具有清除羟基自由基和1,1-二苯基-2-三硝基苯肼自由基的能力,可抑制自由基生成、修复损伤细胞、延缓细胞衰老与凋亡、改善心血管平滑肌的收缩/舒张功能、扩张血管,可用于防治心血管疾病、偏头痛、动脉粥样硬化等症[8-10]。
本研究采用生物酶辅助提取了苦杏仁皮中的DF和黄酮,并以料液比、pH、木瓜蛋白酶溶液浓度、α-淀粉酶溶液浓度、酶解温度和酶解时间为考察因素,DF和黄酮含量为指标,进行了单因素实验。结果显示,随着料液比的降低,DF含量逐渐降低,而黄酮含量呈先增加后降低的趋势。笔者分析原因可能为:当提取溶剂较少时,苦杏仁皮中的溶质溶出不充分;而当料液比为1 ∶ 30时,杂质成分不断析出,使得黄酮的溶出受到影响,加之在此料液比条件下的操作时间更长,可能造成黄酮损耗。随着pH的增加,DF含量变化总体较平稳,而黄酮含量逐渐减少,这可能与部分黄酮被中和有关。木瓜蛋白酶溶液浓度对DF和黄酮含量的影响趋势均为先降低后升高,对前者的影响可能是不同酶用量对可溶性DF与不溶性DF转化综合影响的结果,对后者则可能是过低的酶溶液浓度不足以破碎细胞壁,而过高的酶溶液浓度提取出的杂质更多。当α-淀粉酶溶液浓度为0.5%时,α-淀粉酶可能优先与淀粉或其他物质发生催化反应,而未及时与黄酮作用;当增加α-淀粉酶溶液浓度时,黄酮含量增加,但过饱和的酶则与黄酮形成复合物,反而使得黄酮含量降低[25]。随着α-淀粉酶溶液浓度的增加,DF含量呈先降低后增加的趋势,这可能与可溶性DF和原料中淀粉的减少有关。
经综合评分法分析后可知,pH对DF和黄酮含量的影响较大,其次分别为料液比、α-淀粉酶溶液浓度和木瓜蛋白酶溶液浓度,结合正交实验得到最优提取工艺为料液比1 ∶ 10、pH5、木瓜蛋白酶溶液浓度0.5%、α-淀粉酶溶液浓度0.5%、酶解温度50 ℃、酶解时间1 h。经验证,DF的平均含量为0.801 g/g(RSD=1.95%,n=3),黄酮的平均含量为2.135 mg/g(RSD=2.44%,n=3),平均综合评分为0.988分(RSD=0.81%,n=3)。
综上所述,所得最优提取工艺稳定、可行。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:210-211.
[ 2 ] 朱伟群,王丽君,梁攀,等.中药资源可持续发展的现状与未来[J].世界中医药,2018,13(7):1752-1755.
[ 3 ] 吴东栋,张清安,范学辉,等.苦杏仁皮中生物活性成分的研究进展[J].食品与发酵工业,2019,45(7):288-293.
[ 4 ] 王将,郑亚军,冯翠萍.杏仁皮中黄酮类化合物抗氧化性的研究[J].中国粮油学报,2010,25(1):78-81.
[ 5 ] 刘策,曹清明,刁其玉,等.固态发酵对杏仁皮产品营养成分及瘤胃降解率的影响[J].中国畜牧杂志,2014,50(9):67-71.
[ 6 ] GARRIDO I,URPI-SARDA M,MONAGAS M,et al. Targeted analysis of conjugated and microbial-derived phe- nolic metabolites in human urine after consumption of an almond skin phenolic extract[J]. J Nutr,2010,140(10):1799-1807.
[ 7 ] MANDALARI G,TOMAINO A,ARCORACI T,et al. Characterization of polyphenols,lipids and dietary fibre from almond skins(Amygdalus communis L.)[J]. J Food Compos Anal,2010,23(2):166-174.
[ 8 ] HUANG W C,CHEN C Y,WU S J. Almond skin polyphenol extract inhibits inflammation and promotes lipo- lysis in differentiated 3T3-L1 adipocytes[J]. J Med Food,2017,20(2):103-109.
[ 9 ] CHEN L,CAO K,GU Y R,et al. Kaempferol attenuates spinal cord injury by interfering inflammatory and oxidative stress by targeting the p53 protein:a molecular docking analysis[J]. Mol Cell Toxicol,2021,17(3):257- 266.
[10] 文连君,张清安,张志琪.响应曲面法优化苦杏仁皮总黄酮的微波提取工艺研究[J].南方农业学报,2011,42(1):74-78.
[11] MANDEGARY A,POURNAMDARI M,SHARIFIFAR F,et al. Alkaloid and flavonoid rich fractions of fenugreek seeds(Trigonella foenum-graecum L.)with antinociceptive and anti-inflammatory effects[J]. Food Chem Toxicol,2012,50(7):2503-2507.
[12] 申辉,范学辉,张清安,等.苦杏仁皮水不溶性膳食纤维提取工艺优化及其特性分析[J].食品科学,2014,35(20):6-10.
[13] ARRÁEZ-ROMÁN D,FU S P,SAWALHA S M S,et al. HPLC/CE-ESI-TOF-MS methods for the characterization of polyphenols in almond-skin extracts[J]. Electropho- resis,2010,31(13):2289-2296.
[14] TEETS A S,MINARDI C S,SUNDARARAMAN M,et al. Extraction,identification,and quantification of flavonoids and phenolic acids in electron beam-irradiated almond skin powder[J]. J Food Sci,2009,74(3):C298- C305.
[15] 宁建红,张杰,李霞.膳食纤维的生理功能、制备方法和改性技术的研究进展[J].中国食物与营养,2019,25(1):43-45.
[16] 李成忠.响应面优化乳酸菌发酵法提取柑橘皮渣膳食纤维工艺[J].食品工业,2017,38(7):38-40.
[17] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:13.
[18] 龙旭,唐于平,史亚军,等.竹叶黄酮提取工艺及体外抗氧化性研究综合实验[J].化学教育(中英文),2019,40(18):65-69.
[19] 孙美玲,邱学志,周婧,等.水晶冰菜总黄酮提取工艺优化、结构表征及组成成分分析[J/OL].食品工业科技,2022,43(4):196-204[2022-02-08]. http://www.spgykj.com/article/doi/10.13386/j.issn1002-0306.2021060123.
[20] 袁敏.正交试验设计优选利湿通淋颗粒的醇提工艺研究[J].中南药学,2021,19(7):1330-1333.
[21] 魏玉梅,哈斯其美格,刘华.响应面优化双酶法提取马铃薯渣膳食纤维工艺[J].食品与发酵科技,2020,56(2):33-39.
[22] 李平,刘志红.膳食营养与慢性肾脏病[J].肾脏病与透析肾移植杂志,2020,29(1):66-70.
[23] PASQUALONE A,LADDOMADA B,BOUKID F,et al. Use of almond skins to improve nutritional and functional properties of biscuits:an example of upcycling[J]. Foods,2020,9(11):1705.
[24] SADALAGE P S,NIMBALKAR M S,SHARMA K K K,et al. Sustainable approach to almond skin mediated synthesis of tunable selenium microstructures for coating cotton fabric to impart specific antibacterial activity[J]. J Colloid Interface Sci,2020,569:346-357.
[25] 李夢洋,常远,冯国军,等. α-淀粉酶抑制剂构效关系及应用研究进展[J/OL].食品工业科技:1-17(2021-10-20)
[2022-02-15]. http://doi.org/10.13386/j.issn1002-0306.
2021080293.
(收稿日期:2021-11-02 修回日期:2022-02-18)
(编辑:陈 宏)
