基于公众视角的我国药品生产企业不良反应上报渠道畅通性现状调查及建议
2022-03-29林枭伍红艳王龙黄艳郝兴敏李星辰余江霞田柳丹荣艺
林枭 伍红艳 王龙 黄艳 郝兴敏 李星辰 余江霞 田柳丹 荣艺


中圖分类号 R95 文献标志码 A 文章编号 1001-0408(2022)06-0653-08
DOI 10.6039/j.issn.1001-0408.2022.06.02
摘 要 目的 为提高公众上报不良反应(ADR)的积极性、促进药品生产企业提高公众ADR上报渠道的畅通性及承担药品安全主体责任的主动性提供建议,并为我国监管部门开展药品安全监管工作提供参考。方法 编写调查问卷,以我国进入全球前1 000位的180家药品生产企业为对象,选取企业联系电话、邮箱、官网和新媒体(包括微信和微博)4个渠道进行ADR上报渠道畅通性调查,内容包括公众上报渠道的建立情况、企业记录和反馈情况等,对调查发现的问题进行分析并提出建议。结果与结论 我国超过70%的药品生产企业已建立公众ADR上报渠道,以联系电话和邮箱常规渠道为主,且每个渠道都存在ADR信息无法上报的现象;超过60%的企业建立的公众渠道缺少对上报信息遗漏部分的询问补充;仅收到24家企业对ADR信息的反馈,且反馈内容单一。建议药品生产企业加强对公众ADR监测的重视,在保障渠道畅通性的同时考虑增加多种上报渠道,加强对员工信息收集能力的培训以提高信息的质量,对公众上报的ADR信息及时进行反馈,增加公众较为关注的反馈内容。
关键词 公众报告;药物不良反应上报;药品生产企业;上报渠道;畅通性
Investigation and suggestions on the smoothness of reporting channels for adverse drug reaction of pharmaceutical manufacturers in China based on the public perspective
LIN Xiao1,WU Hongyan1,2,3,WANG Long4,HUANG Yan5,HAO Xingmin1,LI Xingchen1,YU Jiangxia1, TIAN Liudan5,RONG Yi5(1. School of Medical and Health Management, Guizhou Medical University, Guiyang 550025, China; 2. Guizhou Institute of Health Development, Guizhou Medical University, Guiyang 550025, China; 3. Key Laboratory of Environmental Pollution and Disease Control of Ministry of Education, Guizhou Medical University, Guiyang 550025, China; 4. Dept. of Pathology, Guiqian International General Hospital, Guiyang 550024, China; 5. School of Public Health, Guizhou Medical University, Guiyang 550025, China)
ABSTRACT OBJECTIVE To provide the suggestions for improving the enthusiasm of the public to report adverse drug reactions (ADRs), promoting pharmaceutical manufacturers to improve the smoothness of ADR reporting channels by the public and the enthusiasm of assuming the main responsibility for drug safety, and to provide reference for the performance of drug safety supervision by regulatory departments in China. METHODS Taking 180 pharmaceutical manufacturers that had entered the top 1 000 in the world as the objects, the questionnaire was prepared to investigate the smoothness of ADR reporting channels through 4 channels: contact number, e-mail, official website and new media (including Wechat and microblog) of enterprise. The questionnaire involved the establishment of public reporting channels, the records and the feedback of enterprises. The existing problems were analyzed and suggestions were put forward. RESULTS & CONCLUSIONS More than 70% of pharmaceutical manufacturers in China had established the channels for reporting ADR by the public, which were mainly regular channels such as contact numbers and e-mail, and each channel had the phenomenon that ADR information couldnt be reported. More than 60% of the public channels established by manufactures lacked inquiry and supplement for the missing part of the reported information; only 24 pharmaceutical manufacturers provided feedback on ADR information, and the feedback contents were monotonous. It is suggested that pharmaceutical manufacturers should pay more attention to ADR monitoring among the public, consider increasing multiple reporting channels while ensuring the smoothness of channels,strengthen the training of employees information collection ability to improve the quality of information, timely feed back the ADR information reported by the public, and increase the feedback content concerned by the public.
KEYWORDS public reports; reports of adverse drug reaction; pharmaceutical manufacturer; reporting channal; smoothness
我国2019年新修订的《药品管理法》规定,药品生产企业应及时上报药品不良反应(adverse drug reactions,ADR)信息[1]。2021年,国家药品监督管理局颁布的《药物警戒质量管理规范》对药品上市许可持有人主动开展药品上市后监测、完善信息收集途径作了进一步规范[2]。药品生产企业作为药品安全的责任主体,对ADR信息进行收集与报告,是保证药品上市后安全性风险被及时发现与控制的重要手段,也是其开展药物警戒活动的核心内容[3]。但根据《国家药品不良反应监测年度报告(2020年)》发布的数据,来自药品上市许可持有人和个人的ADR报告占ADR报告总数的比例均不超过6%[4]。因此,为提高我国药品生产企业和个人的ADR上报数量及报告质量,帮助药品监管部门完善药物警戒相关监管内容,有必要对我国药品生产企业收集ADR的现状进行实际调研。
目前,国内药物警戒的相关研究主要是基于药品生产企业角度进行的药物警戒现状调查[5-7],也有部分研究通过问卷调查的方式分析了公众对ADR的认知及上报现状[8-9],但少有学者调研公众向药品生产企业上报ADR渠道的畅通性,而该渠道的畅通性将直接影响公众上报ADR的积极性和用药安全。为推动我国药品生产企业深入开展药物警戒活动,进一步保障公众健康,本课题组开展了针对药品生产企业ADR公众上报渠道畅通性的调查,并基于公众视角对相关渠道的建立、公众上报内容的记录和企业收到ADR信息后的反馈3个方面进行研究,以期为提高公众上报ADR的积极性以及企业提高公众ADR上报渠道的畅通性、承担药品安全主体责任的主动性提供建议,并为我国药品监管部门开展药品安全监管工作提供参考。
1 资料与方法
1.1 调查对象
本研究参考2021年Torreya发布的《全球1 000强医药企业报告(2020年)》(The Pharma 1 000:the Worlds Most Valuable Pharmaceutical Companies:A Torreya Report)[10],选择我国入围全球前1 000位的208家医药企业为研究对象,剔除其中主营业务是兽药、原料药、医疗器械、保健品的28家企业后,最终纳入180家企业作为本次调研对象。
1.2 研究方案设计及内容
我国《药物警戒质量管理规范》第三十五条规定:“持有人应当通过药品说明书、包装标签、门户网站公布的联系电话或邮箱等途径收集患者和其他个人报告的疑似药品不良反应信息,保证收集途径畅通”[2]。本研究根据上述法规条例对药品上市许可持有人进行ADR监测和上报的要求,选取企业联系电话、邮箱、官网和新媒体(包括微信和微博)4个渠道进行畅通性调查。
调查问卷由企业基本信息和ADR公众上报渠道畅通性调查两部分组成。企业基本信息包括企业排名、企业类型、注册地、成立时间、主营药品类型、主要治疗领域、2020年年收入和是否被纳入全国药品集中带量采购名单等。为保证数据的准确性,受访企业的企业类型、注册地和成立时间由本课题组在国家药品监督管理局官网查询获得;企业主营药品类型和主要治疗领域在企业官网和国家信用信息公示系统查询获得;企业是否被纳入集中带量采购名单根据国家组织的药品集中招标采购中选结果判断(截止日期为2021年6月28日;企业有任意1种药品中选即判断为纳入企业);企业排名和企业2020年年收入数据则来自Torreya发布的《全球1 000强医药企业报告(2020年)》。调研时间为2021年7-9月。
根据文献检索结果和相关法规的要求,经本课题组成员讨论确定,渠道畅通性部分由企业建立公众上报ADR的渠道情况、企业对公众上报ADR信息的记录情况和企业对公众上报ADR信息的反馈情况3个部分组成,同时咨询相关专家意见并结合各渠道特点设计相应调查内容。
(1)企业建立公众上报ADR的渠道情况:查询企业官网、所生产药品的外包装和说明书、企业官方微信公众号、企业官方微博和搜索引擎等,对受访企业是否建立公众上报ADR的相关渠道、渠道上报方式的标识是否醒目、是否明确有“不良反应上报”“药物警戒”等相关文字标识等情况进行记录。其中,企业官方微信公众号和微博以是否经企业或微信/微博平台认证判断;官方联系电话以是否为400或800(即公众拨打电话产生的通讯费部分或全部由企业承担)开头判断;渠道上报方式的标识是否醒目以相关信息是否处于公示页面的中心区域并与同位置的其他信息相比字号大小如何等进行判断。
(2)企业对公众上报ADR信息的记录情况:由调研员根据企业在上述渠道中提供的方式进行ADR上报,内容为本课题组统一制订的示例信息;记录上报过程中与企业沟通的内容信息,包括该渠道是否接受ADR上报,是否为专业人员处理、企业是否询问了其他相关信息、处理情况及是否承诺反馈等,若不接受上报则询问原因、是否有其他上报方式。为保证上报信息的一致性,本次调查上报的ADR示例信息仅包含患者基本信息、原患疾病、药品信息、ADR描述4个部分;其中,药品信息和ADR描述根据受访企业生产的药品品种而相应变动。对于企业询问了上报者其他相关信息的,应予以记录,并将其内容与原国家食品药品监督管理局统一印制的《药品不良反应/事件报告表》(以下简称“《报告表》”)进行比较。调研过程中,若企业联系电话无法接通,调研员需做好记录并在接下来的7个工作日的工作时间内连续拨打,超过时限的则记录为“无法接通”;邮箱调研需设置邮件回执,对已读未回复或发送失败的邮件进行记录。对于企业官网、官方微信公众号和官方微博的查詢,除药品说明书和官网公布的以外,还需利用搜索引擎进行补充,并以带有平台认证标志的为准。本研究只纳入了与药品质量、药物警戒等内容相关的联系电话和邮箱地址,未纳入企业招聘信息等专用电话和邮箱地址。
(3)企业对公众上报ADR信息的反馈情况:反馈以企业收到上报ADR信息后30个工作日为限,详细记录企业的反馈时间、反馈方式和反馈内容等,超过上述时限则视为无反馈。
以联系电话为例,具体调查流程详见图1。
1.3 质量控制方法
向调研员统一发放调研手册并进行培训,以规范调研行为。在小范围内进行预试后进一步对调研方案进行修改完善。采取两人一组合作调查的方式对同一家企业展开正式调研。由数据审核员对调研当日的调研结果进行审核并录入。
1.4 统计学方法
采用EpiData 3.0软件进行数据录入,使用SPSS 19.0软件进行统计分析。计量资料以x±s表示,计数资料采用频数和率表示。
2 调研结果
受访的180家企业共覆盖我国29个省、自治区、直辖市和特别行政区,其中164家企业(91.1%)为上市企业。《全球1 000强制药企业报告(2020年)》中我国排名最前的企业是江苏恒瑞医药(全球第21位),排名最末的是浙江莎普爱思药业(全球第1 000位);截至2021年7月1日,企业平均成立时间为(22.92±6.93)年,成立时间最早的是沈阳兴齐眼药(1977年),最晚的是欧康维视生物医药(上海)(2018年);调研企业的2020年平均年收入为(65.12±105.61)亿元,年收入最高的是扬子江药业(768亿元),最低的是诺诚健华(64万元)。从主营药品类型和治疗领域来看,180家企业中,包含中药企业33家、生物药企业53家、化学药企业24家和混合型(主营药品类型2种及以上)企业70家,覆盖肿瘤、眼科、心血管系统、呼吸系统、中枢神经系统等11个治疗领域。此外,纳入我国前五批集中带量采购的企业共有54家。
统计结果显示,超过70%的企业已建立公众ADR信息上报渠道,但可供公众上报的渠道以联系电话和邮箱常规渠道为主,且每个渠道都存在ADR信息无法上报的现象;超过60%的企业建立的公众上报渠道缺少对上报信息遗漏部分的询问补充;仅收到24家企业对上报的ADR信息的反饋,且反馈内容较为单一。4个渠道的具体调研结果如下。
2.1 联系电话上报渠道
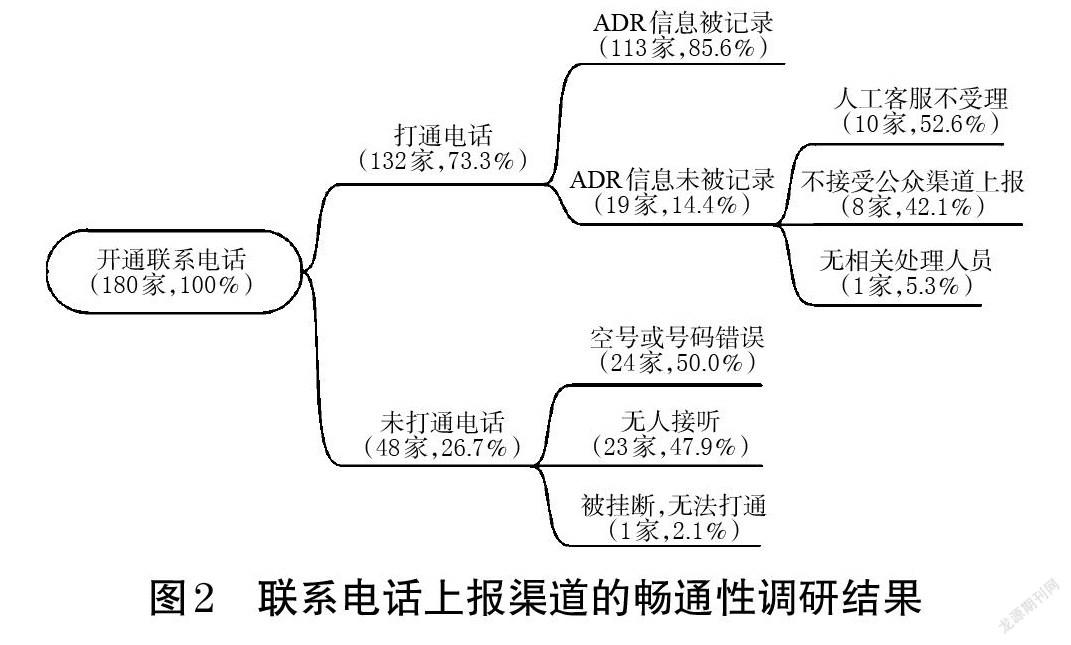
2.1.1 渠道建立情况 所有企业在其药品外包装、说明书或官网上均公开了联系电话,且联系电话都放在醒目位置,字体大小适中。180家企业中,有52家企业(28.9%)的联系电话以400或800开头;有35家企业(19.4%)明确标注了ADR上报或药物警戒的专用热线,其中1家企业还明确将ADR上报电话与销售电话进行区分,并标明了热线开通时间。尽管所有企业都公布了联系电话,但有48家企业(26.7%)的电话为空号或号码错误、在连续7个工作日内拨打均无人接听或直接被挂断。联系电话上报渠道的畅通性调研结果见图2。
调查结果显示,在19家未记录ADR上报信息的企业中,有企业人工客服不受理的理由为“企业主要关注医疗机构的反馈,公众可向医疗机构反馈,企业将向医生跟进实际情况”;有企业无相关部门负责公众上报,建议调研员与企业其他部门联系,而调研员与其提供的其他部门联系却被告知也不属于其工作职责范围;还有企业客服在记录ADR信息时告知调研员暂无相关处理人员,后续将请示上级分配处理部门。
2.1.2 企业记录情况 在打通联系电话的132家企业中,有121家企业(91.7%)为人工客服,有11家(8.3%)为智能语音客服;除2家(1.5%)需要转接2次才可联系到相关客服以外,其余130家企业均可直接拨通。在121家以人工客服接待的企业中,有93家企业(76.8%)设置有专门负责ADR信息上报、处理的人员,其余28家仅设置有问题记录人员。
在记录了上报信息的113家企业中,有96家企业(85.0%)对遗漏信息进行了询问。在这96家企业中,38家企业(39.6%)询问和记录的内容符合《报告表》的要求;56家企业(58.3%)虽对部分遗漏信息进行了询问,但并未涵盖《报告表》的全部内容;另有2家企业(2.1%)除记录《报告表》的相关内容外,还询问了调研员的其他信息,如是否为首次服药、是否就诊及就诊采取的治疗措施等。上述96家企业询问的遗漏信息中,既往ADR史/家族ADR史的记录率最低(41家,42.7%),其次是相关重要信息(吸烟史、饮酒史、妊娠期、肝病史、肾病史、过敏史等)和ADR后续情况(停药或减量后症状是否消失或减轻、再次使用可疑药品后是否出现同样反应/事件等),分别为58家(60.4%)、62家(64.6%)。值得注意的是,仍有17家企业(15.0%)未对调研员上报的ADR信息进行任何补充询问,甚至有企业客服明确表示对上报内容的完整性没有要求,其只负责记录上报信息。
根据《报告表》的填报要求,除需填写发生ADR的药品信息并描述ADR症状外,还需记录上报者的联系方式,以便于后续信息的追踪。打通联系电话的132家企业中,有68家企业(51.5%)会详细记录上报者联系方式,如某企业的客服还对上报者与用药患者的身份加以区分,详细记录上报者和用药患者的关系及各自的联系方式,并回访了用药患者;但仍有64家(48.5%)企业未记录上报者的联系方式。
2.1.3 企业反馈情况 在受访企业记录上报信息的过程中,有14家企业(10.6%)承诺会有反馈。在上报后的30个工作日内,调研员最终共收到15家企业的反馈信息,其中曾承诺会有反馈的企业有11家(73.3%),另有4家企业(26.7%)未曾承诺但也向调研员进行了信息反馈。
在反馈时间方面,13家企业(86.7%)在收到ADR上报信息的1周内进行了反馈,另有2家分别在信息上报的15、23 d后向调研员进行了反馈。其中,最快的1家企业在收到上报信息后4 h内即给予了反馈,有2家企业在24 h内给予了反馈。
反馈内容主要包括企业对调研员上报事件的处理进度及后续安排、调查结果、用药建议和解决方案4类。15家企业中,有6家企业(40.0%)在反馈中表明其收到ADR上报信息后就已经开始启动调查并告知调研员当前进度及后续安排;有4家企业(26.7%)反馈了此次ADR的调查结果,并对出现ADR的原因进行了说明;有4家企业(26.7%)的反馈中包含了安全用药的建议,对药品的配伍禁忌、服药时间和注意事项进行了说明;有2家企业(13.3%)反馈了此次ADR的赔偿方案,建议调研员/用药患者先去医疗机构进行全面检查,若后续调查确定ADR与服用本企业药品有关,愿意承担全部费用。13家企业(86.7%)通过电话向上报者反馈信息,其余2家(13.3%)则通过专业客服添加上报者微信的方式进行反馈。
2.2 邮箱上报渠道
2.2.1 渠道建立情况 有120家企业(66.7%)已在官网、药品外包装和说明书中标明了联系邮箱地址,且大部分公示位置都易于公众查询,但仍有2家企业官网公布的联系邮箱位于网页最底部,字体偏小且不够醒目。120家公布了联系邮箱的企业中,有8家企业(6.7%)的邮箱地址错误或设置了禁止接收,其余112家企业(93.3%)均可成功收到邮件(调研员收到了邮件已读回执)。邮箱上报渠道的畅通性调研结果见图3。
2.2.2 企业记录情况 收到已读回执的112家企业中,仅22家(19.4%)针对ADR上报信息回复了邮件,包括17家自动回复和5家人工回复。回复信息的22家企业中,有13家(59.1%)对邮件中上报的遗漏信息进行了询问,但未有企业能完整询问《报告表》中的所有内容。询问并记录的信息中,除既往ADR史/家族ADR史的信息未有任何企业进行询问外,记录率較低的3项分别是药品信息(2家,15.4%)、原患疾病(4家,30.8%)和ADR后续情况(5家,38.5%)。在对遗漏信息进行邮件询问记录的企业中,要求填报上报者联系方式的仅5家(38.5%),其中有1家企业不仅询问了上报者的联系电话,还派专业客服添加了上报者微信以便开展后续追踪。
2.2.3 企业反馈情况 在通过邮箱发送ADR上报信息后的30个工作日内,调研员最终共收到5家企业的反馈信息,反馈时间均在24 h内。从反馈内容来看,有4家企业以邮件形式反馈了ADR的处理进度及后续安排,内容较为统一:首先向上报者表示该企业高度重视此次ADR,其次反馈了此次ADR的调查方案以及当前进度。还有1家企业通过电话反馈,向上报者再次确认上报信息,并告知该事件当前正由研发部门处理,处理结果将再次反馈给上报者。
2.3 官网上报渠道
2.3.1 渠道建立情况 有173家企业(96.1%)建立了官方网站,其中标明公众ADR上报或药物警戒专用上报渠道的企业仅36家(20.8%)。值得一提的是,有1家企业的官网专门建立了ADR上报平台,并有在线客服服务,该平台不仅向公众科普了ADR相关知识,鼓励其积极上报ADR信息,而且公布了旗下所有企业药物警戒部门的联系方式。在建立了官网上报渠道的企业中,有17家企业(37.8%)可在网页留言处选择问题类型进行ADR上报,20家企业(44.4%)要求上报者填写相关电子表格进行上报,调研员的ADR信息均提示上报成功;另有9家企业(20.0%)开通了在线客服入口,可联系人工客服(8家,88.9%)或电子客服(1家,11.1%)进行上报,其中有1家企业未记录上报信息,理由是该人工客服不受理此类问题。特别值得一提的是,有1家企业为公众提供了多种上报方式,包括官网填写表格、在线提交报告表、专用的热线电话(标明了热线开通时间)及邮箱、手机扫码填写报告表等,便于上报者选择。官网上报渠道的畅通性调研结果见图4。
2.3.2 企业记录情况 17家采取网页在线留言进行上报的企业中,由于留言方式的局限性,15家企业(88.2%)对留言的填报内容无要求,仅2家企业的留言模块是根据《报告表》的内容来设计的。20家采取电子表格收集上报信息的企业中,有19家企业(95.0%)使用了自行设计的表格,仅1家采用了《报告表》原表。相较于《报告表》的内容,有18家企业(94.7%)自行设计的表格存在部分内容缺失。而9家通过在线客服上报的企业均未对上报信息有所要求。
记录了ADR信息的44家企业中,有8家企业(18.2%)要求上报者提供联系方式,包括网页在线留言上报的7家(87.5%)和电子表格上报的1家(12.5%),而在线客服均未要求上报者提供联系方式。
2.3.3 企业反馈情况 在通过官网上报ADR信息后,调研员最终共收到3份反馈信息,反馈时间均在24 h内,皆以电话回访的方式进行反馈。3家企业的反馈内容侧重点有所不同:1家企业主要向上报者说明了此次ADR的解决方案,包括患者在医院检查费用的报销、企业会上门对药品进行回收检查等;1家企业则反馈了当前ADR的处理进度及后续安排,表示目前已有药物警戒部门跟进此次ADR,将在7个工作日内再次向上报者反馈调查结果;还有1家企业表示将对药品开展追踪,希望上报者提供药品生产批次信息。
2.4 新媒体上报渠道
2.4.1 渠道建立情况 分别有161家企业(89.4%)和80家企业(44.4%)开通了官方微信公众号和官方微博。有11家企业(31.4%)在其官方微信公众号中设立了药品质量反馈入口,并标注了ADR或“药物警戒上报”等字样。有7家企业(8.8%)在其官方微博中设立了药品质量反馈入口,但仅有1家(14.3%)有ADR或药物警戒上报的相关标注。还有4家企业(2.2%)同时开通了官方微信公众号和微博,但也仅有1家企业在其官方微信公众号和微博的醒目处设置了ADR或药物警戒上报的专用标识。公众通过新媒体上报ADR畅通性的调研结果见图5。
由图5可见,在开通了官方微信公众号或微博的企业中,分别仅有1家企业对上报的ADR信息进行了记录。有1家企业在官方微信公众号上开通了微官网入口,公众可以通过人工客服进行ADR信息上报;而另一家记录了上报信息的企业将其标注了ADR在线上报的微博设置为置顶微博。官方微信公众号未记录上报信息的主要原因是上报渠道无响应、需要机构账号登录(33家,97.1%),或该渠道仅供内部销售人员及医护人员上报使用而不对公众开放(1家,2.9%)。官方微博上报失败的原因则与该上报渠道反应迟缓、无法识别上报信息属于何种问题等因素有关。
2.4.2 企业记录及反馈情况 唯一一家官方微信公众号记录ADR信息的企业除记录了调研员上报的信息外,还询问了ADR的后续症状和减药、停药后的症状变化等遗漏信息,但未记录上报者或用药患者的联系方式,接待的人工客服并非ADR专业服务人员,未承诺是否反馈处理结果,调研员也未收到反馈。唯一一家记录了上报信息的企业官方微博是由专业处理ADR上报的人工客服接待的,但上报过程未向调研员询问其他遗漏信息和联系方式,未承诺反馈处理结果,调研员也未收到反馈。
3 讨论与建议
3.1 公众通过企业上报ADR信息存在的问题
截至2020年底,我国共有4 460家药品生产企业,我国药品监督管理工作取得较大成效,药品监管部门总共收到167.58万份ADR报告[11]。本研究调查的180家药品生产企业属于我国综合实力及创新性较强的企业,尽管如此,调查结果显示,我国药品生产企业在公众ADR上报渠道的畅通性方面仍存在以下问题:
第一,部分企业缺乏对上报渠道的定期维护。根据调查结果显示,我国药品生产企业已不同程度地建立起公众上报ADR信息的相关渠道,主要以联系电话、邮箱和官网等渠道为主,但有超过1/3的企业所建上报渠道并不能记录ADR信息。公众较常用的上报渠道中,常出现电话无人接听或邮箱禁止接收邮件等情况,主要原因可能与工作人员未及时更新公众上报渠道的联系电话和邮箱设置了禁止接收陌生邮件有关。
第二,企业建立的ADR上报渠道仍然以传统的电话联系为主,较为单一,对于公众接触日渐密切的新型社交媒体使用较少。本次调研结果显示,在180家受访企业中,官方微信公众号和微博的开通率分别为89.4%、44.4%,而这些开通官方微信公众号或微博的企业中仅有少部分开通了公众上报ADR信息的渠道,且大部分渠道无法完成ADR上报。从2021年腾讯与新浪微博官方发布的数据来看,微信和微博的月活跃人数已经分别达到了12.02亿和5.3亿,这样庞大的用户群背后隐藏着巨大的数据挖掘潜力[12-13],相关企业若能将其合理利用,可有助于填补药品临床试验数据的不足,尽早发现真实世界用药中存在的潜在风险。
第三,人员的专业性普遍不足。首先,企业内部尚未建立完善的信息收集制度是影响公众上报ADR的原因之一。在本次调查中,部分企业的客服仅负责记录上报信息,需等待相关专业人员进行处理。其次,虽有部分企业内部已建立了信息收集制度,但客服或处理人员对上报信息的处理流程不够熟悉,甚至出现客服记录了上报信息却不知交由哪个部门处理的情况。最后,客服人员的专业性有待加强。本次调查结果显示,超过60%的企业未对调研员上报的信息进行询问补充或询问内容不够完整,与原国家食品药品监督管理局统一印制的《报告表》的要求还有一定差距。此外,调查中还发现,各渠道中都存在部分企业仅记录ADR信息但未记录上报者联系方式的现象,有超过60%的企业客服未记录上报者的联系方式,这不利于企业对新的或严重的ADR信息进行后续追踪。
第四,企业对公众上报的ADR信息未形成闭环处理,反馈内容与公众需求存在差异。有研究表明,大多数上报者对反馈的信息都存在一定的需求,“对患者ADR症状的处理建议”“报告的信息是否属于ADR”等信息是公众最希望得到反馈的内容,若反馈内容不能满足公众上报需求,会在一定程度上影响公众上报ADR的参与度[14-15]。本次调查结果显示,超过80%的企业在收到ADR信息后未向上报者进行反馈,仅记录了ADR信息或告知上报者随后会上报给药物警戒小组或ADR监测部门处理,而并未公开调查结果或处理方案。从企业反馈的内容来看,多数反馈的内容较为单一,主要是反饋ADR的调查方案或调查结果,而公众需求的其他信息(如出现的ADR如何进行处理、是否属于正常现象等)则较少得到满足。
3.2 建议
3.2.1 定期对ADR上报渠道进行维护 ADR上报渠道的畅通与否是接收公众上报信息的基础,药品上市许可持有人应提高对ADR信息收集的重视,对于企业已经建立的公众上报专用渠道应加强维护。第一,建议将维护上报渠道的畅通性划入药物警戒或ADR监测部门的职责,由专业人员定期检查渠道的上报方式是否正常运行或及时更新,确保公众上报的信息能通过相关渠道被及时记录。第二,为确保信息收集工作的高效开展,建议将公众上报渠道与销售人员或医疗机构人员的上报渠道进行区分,以便公众选择更为自由的上报方式,同时也有利于企业对不同来源的数据进行挖掘分析。第三,相关联系方式应放置渠道醒目处,且明确标注“药物警戒上报”“ADR”等字样,引导并鼓励公众积极上报ADR信息。
3.2.2 拓展多种公众上报渠道及方式 除常见的联系电话、邮箱和官网上报渠道外,药品生产企业应满足公众上报的易操作性、便利性等特点,建立多种渠道以供公众自由选择。社交媒体是深入人们日常生活并影响其生活行为和习惯的重要平台,数据显示,社交媒体用户平均每天在社交媒体上花费的时间超过2 h[16]。有数以亿计的用户曾讨论过ADR经历或有相关咨询的需求[17],企业可考虑在微信、微博或视频应用软件等新型社交媒体上建立上报渠道,为药品上市后安全性监测提供大量的真实世界数据,弥补现有安全性监测临床数据的不足,甚至可能发现新的非预期ADR信息。上报方式可根据渠道的不同进行具体的开发设计,形式不局限于文字或表格,如可考虑以短视频的方式展示在企业官方网站上。面向公众建立专门的ADR上报平台也是一种值得借鉴的具体措施,所有上报者可在任何时间通过平台上报ADR,而企业可通过对平台所获ADR信息进行数据挖掘,进而对存在安全风险的药品加强监管,并可在平台发布警示,让公众或医务人员及时知晓用药风险,甚至还可借助平台对赔偿方案的细则进行公示。此外,企业还应考虑特殊群体(如农村老龄人口、留守儿童或不会使用智能设备的群体等)上报的便捷性,可定期委派专人前往乡镇或社区,设置用药安全咨询点,加强对ADR上报的宣传,协助困难人群ADR信息上报。
3.2.3 加强员工培训 ADR监测是一项涉及药学、临床医学、流行病学、统计学等学科的综合性工作,不仅需要组建多学科团队,而且需加强对员工的培训。首先,建议药品生产企业对ADR监测和收集的人员开展定期培训,加强其对ADR信息收集的重视,尤其对通过电话或网络等直接与上报者进行沟通的客服,可重点培训其如何引导上报者详细描述ADR信息,以及如何针对遗漏信息进行询问补充。其次,对于日常检查中梳理出的问题,应进行针对性的优化培训。最后,企业可考虑建立专项工作考核机制,对员工ADR监测与上报工作进行日常考核,提高ADR监测工作质量。
3.2.4 合理设计公众上报渠道的填报内容 ADR上报信息越全面、完整,越有利于安全信息分析评价和病例跟踪。药品生产企业在建立公众上报渠道时,应根据各渠道的特点设计填报内容,如在线留言上报方式可根据《报告表》设计信息填报模块,信息填报完整方可允许其进行上报。设计渠道填报内容时,建议将国家药品ADR监测上报内容设置为必填项。每例ADR上报完成后,应及时发送给企业相关药师对该信息进行评价,包括ADR类型鉴别、上报信息完整性评价等,必要时应进行临床跟踪。考虑到公众可能不熟悉专业术语信息、不注意保存产品包装、不知如何描述ADR具体症状等实际问题,不同上报者上报信息的准确性和可利用性存在差异,故渠道设计应在满足监测需要的同时,考虑如何引导公众进行完整描述。如邮箱渠道,应在收到公众上报邮件时,自动回复电子表格及上报示例以供公众完善遗漏信息。此外,在设计公众信息上报渠道时,还需考虑公众填写的便利性,选择简单易懂的提示词引导其完成信息填报,在保护上报者隐私的基础上加强对上报者联系方式的记录。
3.2.5 建立处理ADR信息的闭环流程 国家药品监督管理局在2018年发布的《个例药品不良反应收集和报告指导原则》中明确提出,有必要对个例ADR开展随访和反馈,以形成完整的ADR信息收集闭环[18]。企业应根据上述要求,按照药品的不同风险等级建立相应的ADR反馈机制,对上报信息进行及时反馈,完善工作流程。企业的反馈应根据公众上报信息的需求,合理设计反馈内容以提高公众ADR上报的积极性。当企业接收到严重或致死ADR上报时,应及时将ADR调查结果在其官网或官方微信公众号进行公示。此外,企业可考虑建立药品ADR损害救济制度,设立应对严重ADR的救济基金,此举不仅可激励公众主动进行ADR上报,而且有利于树立企业形象[19]。当发现严重ADR时,在确定该事件与企业生产药品有因果关系后,企业应及时向患者反馈赔偿方案,调取相关基金对患者检查和治疗费用予以报销和补偿。
4 结语
本研究调查了我国180家药品生产企业面对公众开放的ADR信息上报渠道的畅通性,结果显示,我国药品生产企业面对公众开放的ADR上报渠道存在ADR信息不能被记录、拒收等情况;上报渠道以联系电话渠道为主,渠道的多样性和人员的专业性不足;对公众上报ADR信息的工作流程存在一定的欠缺,未形成完整的闭环。总体来说,我国药品生产企业在收集公众上报ADR信息和维护上报渠道畅通性方面存在一定的不足。建议药品生产企业加强对公众ADR监测的重视,在保障渠道畅通性的同时考虑增加多种上报渠道,加强对员工信息收集能力的培训以提高信息的质量,并对公众上报的ADR信息及时进行反馈,增加公众较为关注的反馈内容。
参考文献
[ 1 ] 全国人民代表大会.中华人民共和国药品管理法[EB/OL].(2019-08-27)[2021-10-26]. https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20190827083801685.html.
[ 2 ] 國家药品监督管理局.国家药监局关于发布《药物警戒质量管理规范》的公告:2021年第65号[EB/OL].(2021- 05-13)[2021-10-26]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210513151827179.html.
[ 3 ] 孙京林,余伯阳.药品上市许可持有人制度下的质量管理体系[J].中国药学杂志,2020,55(23):1919-1922.
[ 4 ] 国家不良反应监测中心.国家药品不良反应监测年度报告:2020年[EB/OL].(2021-05-14)[2021-10-26]. https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/fgwj/gzwj/gzwjyp/20210325170127199.html.
[ 5 ] 王佳域,柳鹏程,陈巧云,等.江苏省不同规模药品生产企业药物警戒工作现状对比研究[J].中国药房,2020,31(17):2070-2075.
[ 6 ] 王丹,李馨龄,董铎,等. 药品生产企业直接报告不良反应能力调查研究[J].中国药物警戒,2019,16(11):654- 661.
[ 7 ] 司玮,吴晶,李尧,等.南京市药品生产企业不良反应报告和监测检查情况分析[J].中国卫生产业,2018,15(35):162-163.
[ 8 ] 蔡蓝,高亚,李嘉伟,等.广东省公众对药品不良反应的认知现状调查分析[J].中国药房,2015,26(21):2887-2889.
[ 9 ] 胡永建,梁世民,申梦迪,等.河南省居民药品不良反应认知调查[J].中国公共卫生,2018,34(2):234-237.
[10] Torreya. The pharma 1 000:the worlds most valuable pharmaceutical companieshttps:a Torreya report[EB/OL].(2020-09-23)[2021-8-26]. https://torreya.com/publications/pharma-1000-worlds-most-valuable-pharmaceutical-
companies-in-2020_executive-summary.php.
[11] 国家药品监督管理局综合和规划财务司,国家药品监督管理局信息中心.药品监督管理统计年度报告:2020年[EB/OL].(2021-03-26)[2021-10-26]. http://www.gov.cn/xinwen/2021-05/14/content_5606276.htm.
[12] 杨羽,王胜锋,詹思延.社交媒体数据在药品上市后安全性监测的应用[J].北京大学学报(医学版),2021,53(3):623-627.
[13] ZHOU Z Y,HULTGREN K E. Complementing the US Food and Drug Administration adverse event reporting system with adverse drug reaction reporting from social media:comparative analysis[J]. JMIR Public Health Surveill,2020,6(3):e19266.
[14] 王晓骏,路长飞,赵玉娟,等.我国药品不良反应公众报告途径和报告内容调研和思考[J].中国药物警戒,2017,14(7):413-418.
[15] 严珺怡,王尚尧,于泳.国内外药品不良反应公众报告的比较研究[J].中国合理用药探索,2020,17(9):15-20.
[16] Wearesocial. Digital use around the world in July 2020[EB/OL].(2020-09-06)[2021-10-26]. https://wearesocial.com/blog/2020/07/digital-use-around-the-world-in-july-2020#.
[17] TENBARGE A M,RIGGINS J L. Responding to unsoli- cited medical requests from health care professionals on pharmaceutical industry-owned social media sites:three pilot studies[J]. J Med Internet Res,2018,20(10):e285.
[18] 国家药品监督管理局.国家药监局关于发布个例药品不良反应收集和报告指导原则的通告:2018年第131号
[EB/OL].(2018-12-21)[2021-10-26]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20181221172901438.html.
[19] 張枫,徐晓媛.日本与我国台湾地区药品不良反应损害救济基金制度的比较及对我国的启示[J].中国药房,2017,28(22):3036-3039.
(收稿日期:2021-11-22 修回日期:2022-01-11)
(编辑:孙 冰)
