石英及方石英的碱浸动力学研究
2022-03-28王子如曹泽平汪佳瑶王洪阳
王子如,曹泽平,汪佳瑶,王洪阳
安徽理工大学 材料科学与工程学院, 安徽 淮南 232001
前言
铝硅酸盐矿物(包括高岭石、偏高岭石和莫来石)与氧化铁在950~1 200 ℃下的还原焙烧,还原焙烧产物中除铝酸亚铁外,还有以石英和方石英形式存在的二氧化硅,且焙烧温度的升高会促使石英进一步转变为方石英[1-3]。已有研究结果表明,天然纯石英在约1 470 ℃才会转变为方石英[4]。从物相转变角度分析可知,还原焙烧产物中的石英和方石英有别于天然的石英和方石英,因此被重新定义为石英固溶体和方石英固溶体[5-7]。此外,碱浸溶出结果表明,还原焙烧产物中的石英固溶体和方石英固溶体均可在约110 ℃的氢氧化钠溶液中剧烈反应,其溶出率可达到95%以上[3,8]。然而,针对天然石英及方石英的碱浸溶出行为研究较少。
石英被认为是铝土矿中的杂质矿物,很多研究者对其在碱溶液中的反应行为进行了研究[9-11]。在拜耳法溶出铝土矿时(140~260 ℃),石英首先与碱溶液反应生成硅酸钠溶液,然后进一步与铝酸钠溶液反应生成固体水合铝硅酸钠,其反应过程见反应式(1)和(2)[12]。因此,铝土矿中石英的存在会造成拜耳法溶出过程中铝和碱的损失[10,13]。普遍认为石英在≤100 ℃碱溶液中可稳定存在,只有温度≥180 ℃时,石英才会与碱溶液剧烈反应[12]。Knauss 等[14]控制溶液pH 值在1.4~11.8 和温度70 ℃的条件下,考察了石英的溶解速率。Balitsky 等[15]在浸出温度100 ℃、200 ℃和300 ℃条件下,考察了石英在4% NaOH 溶液中的浸出动力学和溶出性。然而,针对石英在氢氧化钠溶液中的碱浸溶出行为则缺乏系统的研究。此外,由于方石英是石英在1 470 ℃温度下的相变产物,在自然界中仅有少量的存在,对其碱浸溶出行为研究则鲜有报道。
溶解:
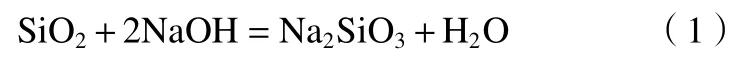
析出:
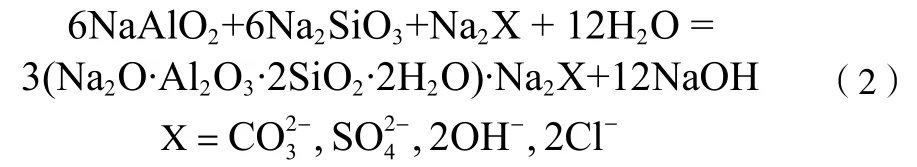
为进一步探讨石英固溶体与石英以及方石英固溶体与方石英的差异,针对石英及方石英在氢氧化钠溶液中的碱浸溶出行为需要进行系统的研究。本文通过对石英和方石英的碱浸溶出结果分析以探讨其溶出动力学,进一步借助透射电镜分析探讨其在氢氧化钠溶液中的浸出差异性。
1 试验
1.1 试验原料
本试验所用的石英为纯矿物,取自湖北省黄石市某石英选矿厂。经破碎、研磨后控制其粒度-74 μm,然后置于105 ℃烘箱中干燥5 h,最终获得用于碱浸的石英样品。将石英置于1 600 ℃的高温马弗炉(KSL-1700X-A3, 合肥科晶材料技术有限公司,中国)中焙烧2 h,再经破碎、研磨后控制其粒度-74 μm,最终获得方石英样品。石英和方石英的X 射线荧光分析(Xray fluorescence, XRF)和X 射线衍射(X-ray diffraction,XRD)结果见表1 和图1。
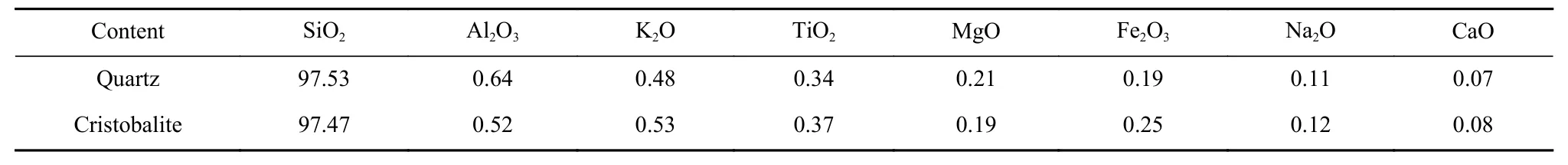
表1 石英和方石英的X 射线荧光分析结果 /% Table 1 XRF results of quartz and cristobalite (mass fraction)
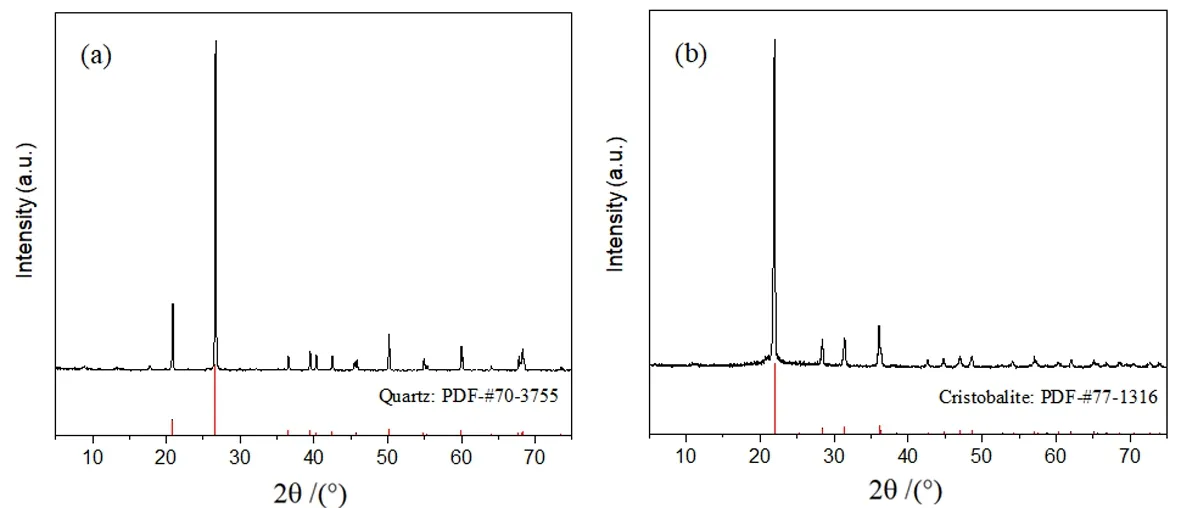
图1 石英(a)和方石英(b)的X 射线衍射图谱Fig. 1 XRD patterns of quartz (a) and cristobalite (b)
从表1 可知,石英中SiO2含量达到97.53%, 其杂质元素主要有Al2O3、K2O、TiO2等。经焙烧后,方石英中各元素含量与石英中各元素含量无明显变化。图1(a)表明,石英样品具有良好的结晶度,其XRD 图谱与标准图谱PDF-#70-3755 完全重叠。此外,石英经1 600 ℃焙烧2 h 后可完全转变为方石英,且方石英的XRD 图谱与标准图谱PDF-#77-1316 完全重叠(图1(b))。
1.2 试验过程
石英及方石英的碱浸溶出试验是在型号为GS-0.25 的高压反应釜(威海鼎达化工机械有限公司,中国)中进行。将100 mL 质量浓度为160 g/L 的氢氧化钠溶液倒入反应釜中,然后再加入10 g 石英或方石英粉末,高压反应釜密封后控制其转速为300 r/min 并加热至反应温度后开始计时。待反应时间结束立即通入自来水将釜体冷却至70 ℃以下,之后打开反应釜并经过滤、洗涤和烘干后,称取浸出渣的质量。鉴于石英及方石英均为纯矿物,其浸出率可通过公式(3)求出。
式中:α为石英或方石英的浸出率,%;ma指入料质量,g;mb指浸出渣质量,g。
1.3 分析测试
石英及方石英的物相分析采用型号为D/MAXRB 的X 射线衍射仪(Rigaku Co., Japan)进行分析,试验条件为:衍射角度5°~75°,步长0.02°,扫描速度10(°)/min。石英及方石英的化学组成采用型号为Zetium的X 射线荧光光谱仪(PANalytical B.V., Netherlands)进行分析,首先将样品与一定质量的硼酸混匀,经压制成块后置于荧光光谱仪中进行元素分析。石英及方石英的微观组成采用型号为JEM-2100F 的高分辨透射电子显微镜(TEM, JEOL Ltd, Japan)进行分析,首先在超声作用下将样品均匀分散在无水乙醇中,然后取少量液体滴在具有多孔结构的铜网上,经干燥后即可置于场发射高分辨透射电子显微镜进行微观分析。
2 试验结果与讨论
2.1 浸出动力学模型的选择
石英或方石英与氢氧化钠溶液反应时,首先颗粒表面溶解并生成高模数硅酸钠液体(Na2O·nSiO2,n≥1),然后高模数硅酸钠液体与氢氧化钠溶液继续反应,生成低模数硅酸钠液体(Na2O·SiO2)并最终进入液相。因此,石英或方石英与氢氧化钠溶液的反应如式(4)和(5)所示[16],其反应机理示意图如图2 所示。
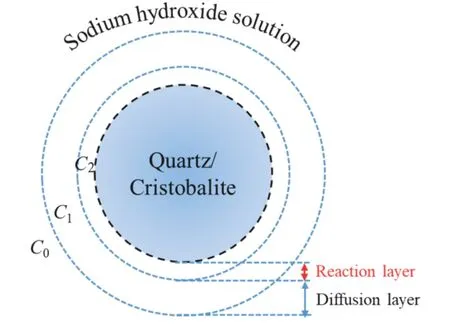
图2 石英或方石英在氢氧化钠溶液中的浸出示意图[16]Fig. 2 Schematic illustration of quartz/cristobalite leaching in NaOH solution
由图2 可知,石英或方石英在氢氧化钠溶液中的溶解包括3 个步骤:(1) 氢氧化钠溶液往颗粒表面的内扩散;(2) 颗粒表面的化学反应;(3) 高模数硅酸钠溶液向氢氧化钠溶液中的外扩散。由于浸出过程中颗粒表面的产物为高模数硅酸钠溶液,氢氧化钠溶液向颗粒表面的内扩散作用比较微弱。因此,石英或方石英在氢氧化钠溶液中的溶解控制步骤主要为颗粒表面的化学反应或高模数硅酸钠溶液往氢氧化钠溶液中的外扩散。当浸出过程为化学反应控制时,其反应动力学模型如公式(6)所示。当浸出过程为外扩散控制时,其反应动力学模型如公式(7)所示[17-19]。
式中:α 为石英或方石英的浸出率,%;ka和kb为反应速率常数,min-1;t为浸出时间,min。
2.2 浸出动力学模型的验证
在氢氧化钠浓度160 g/L、固液比10 g/100 mL 及搅拌速度300 r/min 的浸出条件下,考察了石英和方石英在不同温度及时间下的浸出行为,其结果见图3。由图3(a)可知,石英在100 ℃的NaOH 溶液中比较稳定,120 min 时的溶出率仅为5.15 %。随着浸出温度的升高,石英的溶出率逐渐增大。当溶出温度≥180 ℃时,石英在40 min 时的溶出率即达到90.08 %,且随着浸出时间的延长进一步增大。图3(b)表明,在90 ℃的NaOH 溶液中反应120 min,方石英的溶出率即达到39.29%。方石英的溶解度随着浸出温度的升高而快速上升。当浸出温度≥130 ℃时,方石英在60 min时的溶出率即达到98.82 %。因此,方石英比石英更易溶于NaOH 溶液。
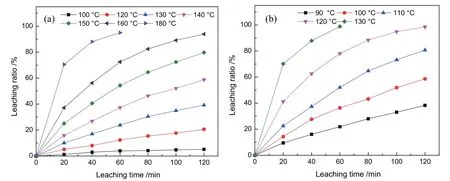
图3 不同温度下的SiO2 浸出率(a 石英;b 方石英)Fig. 3 Effect of leaching temperature on silica leaching ratio
将图3 中的试验结果带入公式(6)和公式(7)进行拟合,其结果分别见图4 和图5。由图4(a)可知,石英在120~160 ℃下的溶出率在公式(6)具有很好的拟合结果,其各温度下的R2均在0.980 0 以上。而方石英在90~120 ℃下的溶出率在公式(6)同样具有很好的拟合结果,其各温度下的R2均在0.990 0 以上(图4(b))。
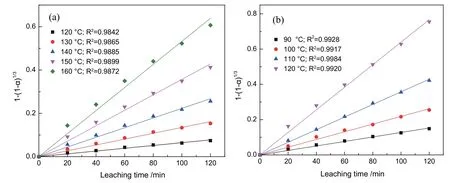
图4 不同温度下1-(1-a)1/3 与浸出时间的关系(a 石英;b 方石英)Fig. 4 Relationship between 1-(1-a)1/3 and leaching time at different temperatures
将图3 的试验结果带入公式(7)时,石英(图5(a))在120~140 ℃溶出率具有很好的拟合结果,其各温度下的R2均在0.970 0 以上。当溶出温度达到150 ℃时,其R2降低至0.959 6,且R2随着浸出温度的升高而急剧降低。图5(b)的拟合结果也表明,方石英溶出率在公式(7)的拟合结果随浸出温度的升高而变差。
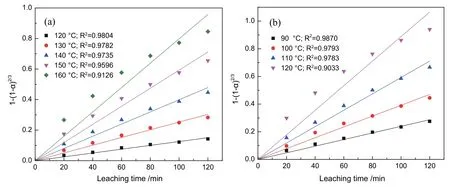
图5 不同温度下1-(1-a)2/3 与浸出时间的关系(a 石英;b 方石英)Fig. 5 Relationship between 1-(1-a)2/3 and leaching time at different temperatures
为进一步对比图3 的试验结果在公式(6)和公式(7)中的拟合结果,将石英及方石英的表观速率常数和回归系数的拟合结果列于表2 中。由表2 的拟合结果可知,石英不同温度的溶出率在公式(6)的拟合结果明显优于公式(7)的拟合结果,具体表现在前者不同温度下的R2均高于后者。因此,石英在氢氧化钠溶液中溶解的控制环节为化学反应控制。此外,方石英在不同温度的溶出率在公式(6)的拟合结果同样优于公式(7)的拟合结果。公式(6)的R2均高于0.990 0,而公式(7)的R2均低于0.990 0 且随浸出温度的升高而降低。因此,方石英在NaOH 溶液中的溶解同样受化学反应控制。
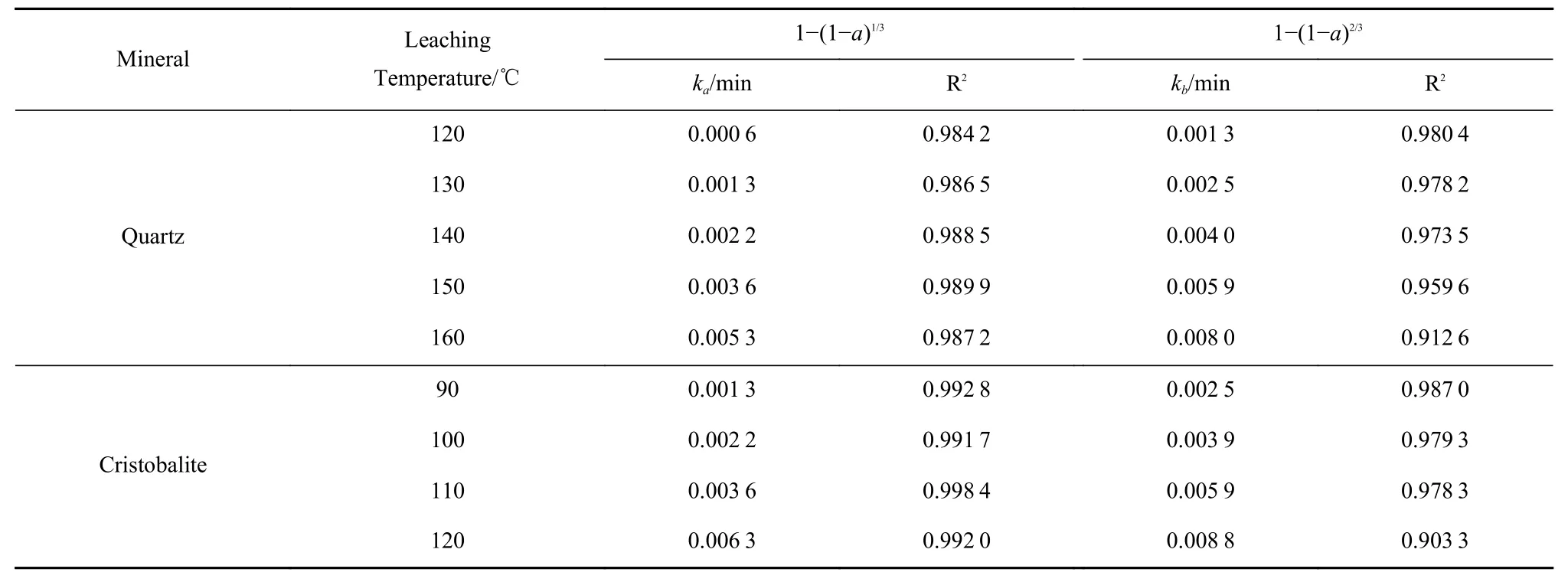
表2 石英及方石英的反应速率常数和拟合回归系数Table 2 Reaction rate constants and fitting regression coefficient of quartz and cristobalite
根据阿伦尼乌斯方程,反应速率常数与活化能存在如式(8)的关系[20-21]。对石英及方石英在不同温度下的表观速率常数进行拟合,可根据其拟合直线的斜率求得石英及方石英在氢氧化钠溶液中的化学反应活化能,其结果见图6。经计算可知,石英和方石英在氢氧化钠溶液中的反应活化能分别为9.26 kJ/mol 和5.02 kJ/mol。进一步说明方石英比石英更易溶于氢氧化钠溶液。
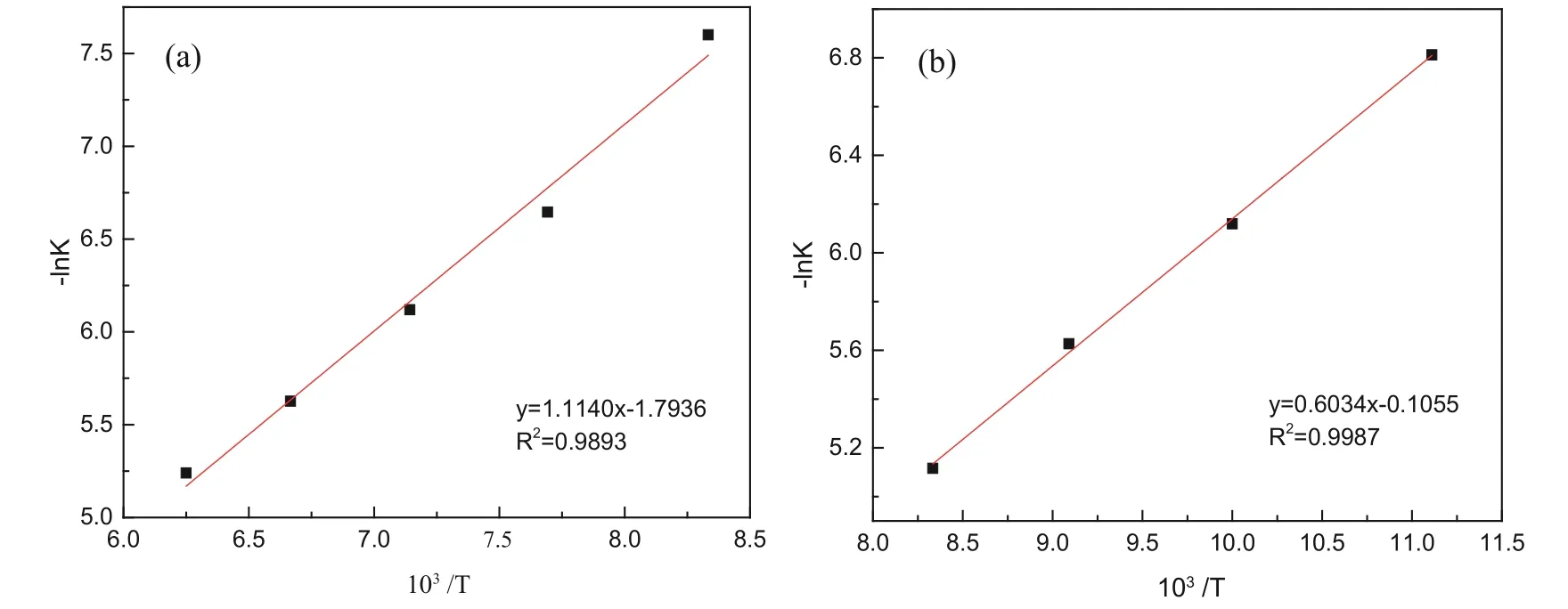
图6 函数1-(1-a)1/3 下-lnK 与103/T 的阿伦尼乌斯图(a 石英;b 方石英)Fig. 6 Arrhenius plot of -lnK vs 103/T of 1-(1-a)1/3 function
式中:k是反应速率常数,min-1;A是频率因子,min-1;E是反应活化能,J/mol;R是通用气体常数,8.314 J/(K·mol);T是反应温度,℃。
2.3 TEM 分析
为探讨石英及方石英在氢氧化钠溶液中的浸出差异,采用TEM 对石英及方石英进行分析,其结果见图7。由图7(a1)可知,本试验所用的石英为片状结构。而选区衍射花样分解结果表明(图7(a2)),石英具有三方晶系,且有规则的晶面(图7(a3))。经1 600 ℃煅烧后,方石英颗粒表面因融化而呈现出规则的椭圆结构(图7(b1))。图7(b2)的选区衍射花样分解结果表明,方石英具有四方晶系结构。然而,图7(b3)的TEM 结果表明方石英的晶面呈现出无规则排布。石英在长程和短程上均具有有序结构,在氢氧化钠溶液中比较稳定。方石英则呈现出长程无序而短程有序的特点,在低温下即与氢氧化钠溶液剧烈反应。该现象揭示了石英和方石英在氢氧化钠溶液中的溶出差异。

图7 石英及方石英的高分辨透射电子显微镜分析结果Fig. 7 TEM results of quartz and cristobalite
3 结论
(1)在110 ℃氢氧化钠溶液中浸出120 min 时,石英的溶出率低于10%,而方石英的溶出率则达到80%。因此,方石英比石英更易溶于氢氧化钠溶液。
(2)石英和方石英在氢氧化钠溶液中的浸出控制步骤均为化学反应控制,其反应活化能分别为9.26 kJ/mol和5.02 kJ/mol。
(3) TEM 分析结果表明,方石英具有短程有序和长程无序的特点,有别于石英的短程有序和长程有序特点,从而证实了方石英比石英更易溶于氢氧化钠溶液。
