“自主漫步”DNA机器人,可精准调控细胞行为,转化工作已提上日程
2022-03-27
2021年9月,湖南大学聂舟团队开发出了一种“自漫步”的DNA分子机器人,其能够在DNAzyme(DNA酶)的催化驱动下在细胞膜表面自主移动,从而控制细胞的迁移行为。研究表明,DNA机器人在细胞膜表明的连续行走能够超灵敏调控MET/AKT信号以及细胞骨架重建,以此增强细胞迁移。这项研究有望为在纳米尺度分辨率下精确调控细胞行为提供了一种新方法。
“在这项研究中,我们首次将分子机器人与生物学功能结合在一起,实现分子机器人对细胞的行为调控。”据聂舟介绍,论文中开发的DNA分子机器人是首个在活细胞的细胞膜表面行走的机器人,而此前的大部分DNA分子机器人是在体外给定路径行走。

相关论文
聂舟是湖南大学化学化工学院教授,还是生物大分子化学生物学湖南省重点实验室主任。他本人拥有生物化学、分子生物学、物理化学、分析化学等多学科交叉科研背景,曾获中国化学会青年化学奖,主持国家自然科学基金杰出青年基金以及国家重点研发计划等项目课题。聂舟课题组的科研方向包括通过非遗传改造方式调控细胞功能、RNA成像以及CRISPR/Cas检测工具。

湖南大学聂舟教授
除了编码遗传物质的能力以外,近年来不断发展的功能核酸和核酸纳米技术等领域使得DNA还具有分子识别与催化、纳米精准自组装、动态可调自组装等一整套非遗传功能。利用DNA纳米工具基于非遗传改造方式调控细胞行为是聂舟实验室的一大重要研究方向。
“与传统的基因工程和合成生物学思路不同,我们的思路是通过非遗传学方式赋予细胞新的特征和表型,精确控制细胞的迁移、增殖和分化等行为,而无需改造或者导入基因。”聂舟说。
例如,细胞迁移是细胞行为中的一种重要类型。如何让细胞能对特定化学物质具有定向迁移性,即实现人工定制的化学趋向性,聂舟实验室的策略是为细胞安装一个基于DNA纳米装置的“化学雷达”,从而使细胞能够对特定的化学分子进行迁移。“我们通过利用DNA纳米装置,把细胞膜受体原有的识别界面屏蔽掉,然后再生成一个新的小分子识别界面,从而利用小分子介导受体激活引起化学趋向性调控此前对这些小分子无法进行迁移的细胞。”
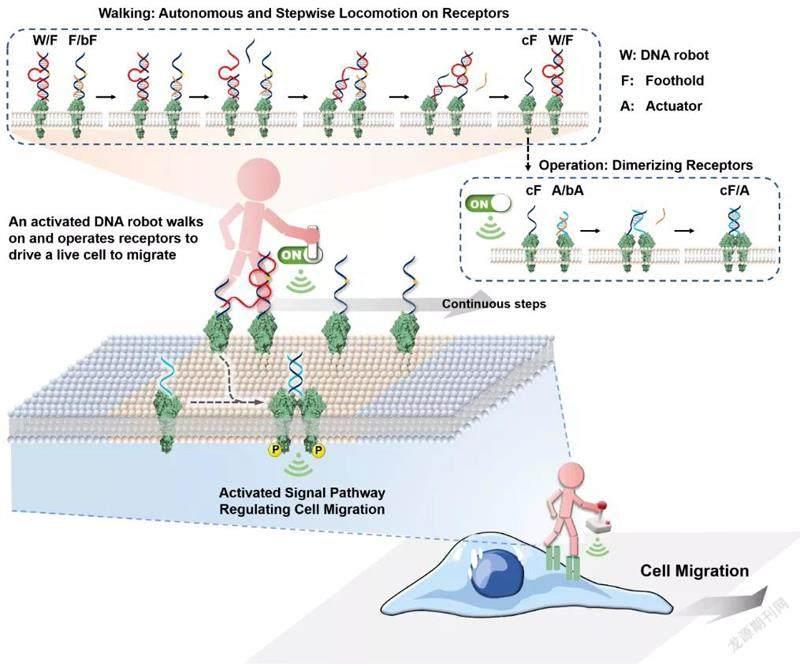
基于以上思路,该团队通过设计不同的DNA纳米装置,采用非遗传的方式特异性调节细胞膜表面的受体,从而改变细胞的基本行为和命运。最新的尝试是他们近期设计的“可自主漫步”的DNA分子机器人,这种机器人可通过持续激活细胞膜上的受体信号来控制细胞行为。
研究中的操作系统由一个能够单脚行走的DNA分子机器人、多个受体上行走位点以及多个受体激活执行器组成。机器人的主体是DNA酶,这是一种功能核酸,具有酶催化的功能。以DNA酶催化行为为动力,机器人能够不断从一个细胞膜表面受体上的行走位点移动到下一个受体行走位点上,同时机器人每走一步还将通过与受体激活执行器反应触发细胞膜表面受体的二聚化过程,从而激活受体。
据聂舟透露,整个DNA分子机器人行走的过程是一个连续催化的过程,在这个过程中机器人会不断激活细胞膜上的受体,从而实现对相关受体的超灵敏激活。
在研究中,团队通过合作采用了突破成像极限的超分辨率技术监测细胞膜上DNA分子机器人的行走数据。根据推算,DNA分子机器人每一步的运动范围大约2纳米~10纳米,能够驱动细胞每小时行走87微米。“无论对受体的激活,还是细胞行为的表征,每个分子机器人在1小时内可激活细胞膜表面约20对受体,产生近40倍的激活增强。”
精确调控细胞行为不仅可以通过受体精准调控来实现,聂舟团队也关注细胞受体识别的配体对象一一例如细胞因子。细胞因子是由多种细胞分泌的小分子多肽或糖蛋白,这是一类生物信息分子,通过与细胞表面的相应受体结合发挥其生物学作用。细胞因子作为药物的治疗的局限性在于其对靶细胞调节的选择性不高,可能脱靶激活其他细胞,引起毒副作用。如何发展智能化的细胞因子是细胞精准调控的一道“必答題”。
据聂舟介绍,DNA纳米装置可以实现“升级版”的细胞因子,即根据不同疾病情况,设计更智能的细胞因子,从而更精准激活受体、调控细胞行为。
具体来说,聂舟实验室提出的是一种类似智能手机“扫码—开锁”一样的策略,也就说通常情况下,通过DNA纳米装置给细胞因子上锁,使其失去活性,然后通过扫描细胞膜上的多种膜蛋白靶标构成的“细胞身份码”,准确鉴定细胞并开锁释放细胞因子,然后选择性激活受体并调控靶细胞功能。
目前,该团队正在尝试多种选择性调控细胞行为的方式,其中包括疾病靶标、生理分子、光控等。在研究中,团队为多种不同类型的细胞安装上了DNA分子机器人装置,并发现可以在活体层面选择性触发细胞行为。当研究人员把近红外光响应DNA装置放入试验动物体内,通过近红外光照后,他们观察到该纳米装置可以驱动内源肌肉干细胞定向迁移到肌肉的损伤部位,进一步分化成肌肉细胞修复受损肌肉组织。
据悉,聂舟团队调控的受体主要以受体酪氨酸激酶为主,这是一类感知细胞因子、生长因子等信号分子的跨膜蛋白受体分子,在蛋白酪氨酸激酶家族中占比较高。多项研究显示,受体酪氨酸激酶在多种细胞的生长、分化、血管生成以及癌变过程中发挥着重要的作用。
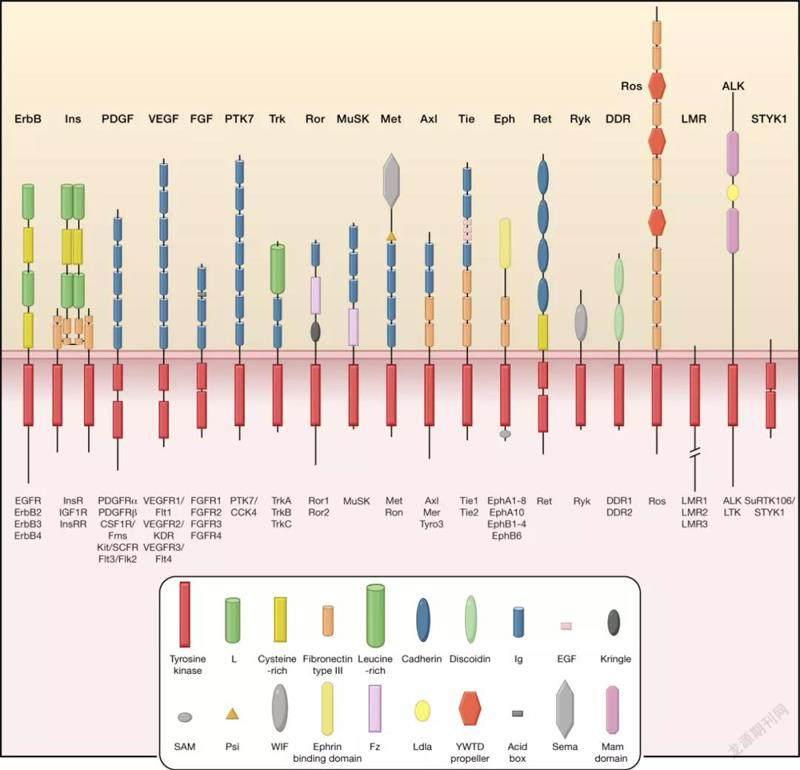
RTK家族
需要注意的一点是,聂舟团队设计的这种DNA分子机器人与传统载药机器人不同,载药机器人作为载体递送药物,需要通过携带的药物发挥杀伤肿瘤或者治疗疾病的作用,而这种分子机器人调控细胞受体功能本身就是药物形式,调控细胞行为的过程就是发挥治疗效果过程。
据聂舟介绍,团队正在通过调控受体酪氨酸激酶精准调控细胞行为,实现治疗效果。他认为,该机器人有潜力应用于肿瘤免疫治疗、糖尿病、创口、组织修复等多种疾病治疗中。
这种调控细胞行为的触发因子也可以扩展为不同的对象,包括离子、小分子以及核酸、蛋白质等生物大分子,从而实现对细胞的正交控制。
据悉,该装置还包括多个不同模块,比如DNA-抗体偶联模块,DNA-蛋白偶联模块,也就是说可以利用不同的元件满足不同的需求。细胞有其天然配体蛋白,这些蛋白配体可以通过与DNA-蛋白偶联模块结合,从而调控多种细胞类型。
不过,聂舟也指出当前DNA分子机器人真正落地也还面临两个难点,即如何在活体环境中稳定执行调控功能以及如何集成多种复杂功能。他告诉生辉,这两个角度也是团队开发出的DNA分子机器人的转化落地方向,短期来看可以开发受体激活剂或者抑制剂,更长远的目标是集成更复杂的功能实现对细胞行为的精准调控。
目前,该团队已经开展了受体激活剂的转化工作,且正在初步进行临床前相关试验。
聂舟是一名“八零后”博导,其父母也都是化学教授,耳濡目染之下,从小与化学结下不解之缘。他的教育背景涵盖了生物、生物化学、物理化学以及分子生物学等多学科,聂舟课题组同样是一支多学科交叉的研究小组,该实验室的科研工作正是建立在多学科交叉基础之上。
“我们的工作涵盖了多门学科,我希望这些工作能够真正对其他学科的研究有一定的帮助和意义。长远来看,希望我们实验室能够为解决其他学科特别是生物学、医学等相关问题提供更多真正有意义的研究。”聂舟说。
谈及自己的科研之路,聂舟告诉生辉,自己从事科研工作的初心想做一些自己真正感兴趣且不一样的工作。从兴趣出发,站在不同的角度,做出一些具有特色且有望解决临床需求的工作。
事实上,上文提及DNA分子机器人的灵感就来自于他在工作中的不走寻常路。他在泰国看到骑象人的时候,就在想能不能开发出一种分子机器人,让它带着细胞行走;看到人們喜欢用激光笔逗猫,猫也喜欢追着光点跑,他想是否也能让细胞像猫一样追着光跑……
他实验室的研究项目可以简单总结为三个方向,通过非遗传改造方式调控细胞功能、RNA成像、CRISPR/Cas检测工具。
在实验室开展基础研究的同时,他对研究项目的转化工作也有自己的见解。“转化的一个关键在于降低领域内知识壁垒和使用的门槛,可以方便非本领域的专家使用。”聂舟继续说。
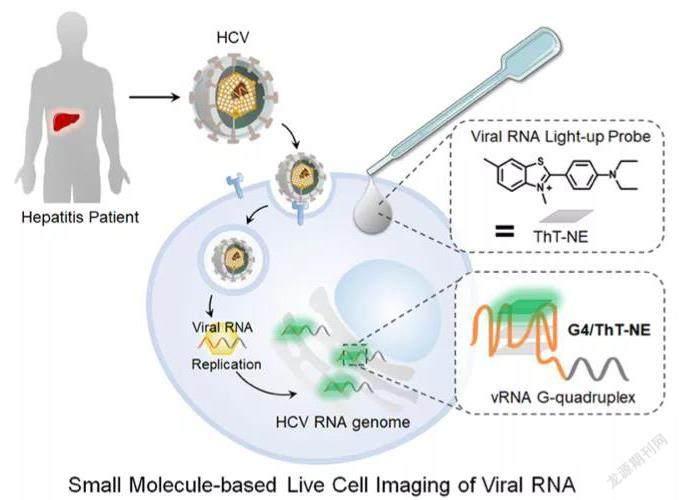
病毒RNA成像是其实验室的重要研究方向同时也是转化落地进展比较快的研究项目。病毒RNA成像是通过小分子探针直接在活细胞中观察病毒RNA的时空动态分布信息,这就像是给RNA贴上了一个“荧光标签”。这种方式以病毒基因组上特定二级结构(G-四联体)为靶点,开发小分子荧光探针,探针本身不会发光,不过一旦与病毒基因组特异性结合后能够成像和发光,成像方式更为简便。这样就可以帮助研究人员实时观察病毒在细胞里面的复制以及细胞间相互感染的过程。
据悉,2019年他们在RNA成像上的工作首次证明了利用病毒RNA本身固有的结构特征实现成像的可能性。这项研究中发展的新型G-四联体荧光探针ThT-NE已经由全球最大的化学试剂公司Sigma-Aldrich公司(现已被默克收购)实现了商业化,已经面向市场销售。
聂舟还提到转化工作的最终目的就在于相关研究能够真正解决一些生物学领域的问题。“我们不断向其它领域的底层思路进行学习,包括合成生物学、生物化学等,希望不断发展新的化学工具来尝试解决生物学问题,为生物学问题提供真正有用的方法。从这个角度出发,才能有条不紊地加快真正推向应用的步伐。”聂舟总结道。(综合整理报道) (编辑/诺伊克)
