天女木兰MsPHYA基因的表达及休眠解除功能研究
2022-03-26张晓林张若晰曾莞棋孙宏涛雷鸣雷陆秀君
张晓林,张若晰,曾莞棋,孙宏涛,郝 昕,雷鸣雷,陆秀君
(1.沈阳农业大学a.林学院,b.设施园艺教育部重点实验室,沈阳 110161;2.中国林业科学研究院林业研究所,北京 100091;3.朝阳市森林病虫害防治检疫站,辽宁 朝阳 122000)
天女木兰(Magnolia sieboldiiK.Koch)木材可制作家具,花可提取芳香油,亦可入药。花色美丽,具长花梗,随风招展,为著名的庭园观赏树种,然而天女木兰种子具有深度休眠的特性,为育苗工作带来了较大困难。光是影响种子休眠与萌发的重要环境因子。按吸收光谱成分的不同可以将植物光受体分为5类:光敏色素(phytochrome)、向光素(phototropin)、[ZTL(zeitlupe)、FK-F1(flavin binding kelch repeat fbox 1)和LKP2(lov kelch protein 2)]基因家族、隐花色素(cryptochrome)和UVR8(UV resistance locus 8)。在这些光受体中,光敏色素主要调控种子萌发、幼苗光形态建成、避荫性反应、开花诱导和某些抗逆性反应[1]。
光敏色素A(PHYA)是植物中唯一的远红光受体,在种子萌发中起主要作用[2],其蛋白具有两种构象,PHYA 经过红光照射后会由PHYA-Pr 形态(无生物活性)转变成PHYA-Pfr 形态(有生物活性),远红光照射后又会由PHYA-Pfr 形态变回PHYA-Pr 形态[3]。在细胞中,与PHYA 相互作用的蛋白有很多,属于bHLH 家族转录因子的光敏色素互作因子PIFs(phytochromeinteracting factors)是其中之一[4]。在拟南芥中已经鉴定出6 个bHLH 家族成员,分别编码蛋白PIF1 和PIF3 到PIF7[5],PHYA-Pfr 与PIF3 可以直接相互作用,促进PIF3 磷酸化和泛素化降解,解除对光形态建成的抑制作用,参与调控种子萌发[6-9]。
目前红光、远红光对种子萌发的影响结论不一。禾本科植物如水稻[10]、小麦[11]的种子经远红光LED辐照后发芽率增长。木本植物如杉木[12],其种子为光不敏感种子,黑暗处理下萌发率最高,远红光间断处理(R-FRR)能够相对促进其萌发;色木槭、水曲柳萌发率在R-FR-R照射下达到最高[13];红松种子萌发率随R/FR下降而明显下降;在一定范围内低R/FR 抑制叶榕和鸡嗉子榕的种子萌发[14]。本研究为探究红光、远红光对天女木兰种子萌发的影响,从天女木兰转录组中筛选到MsPHYA候选基因,分析其对光条件的响应模式,初步预测其功能,完成MsPHYA蛋白的原核表达、纯化及抗体制备,为天女木兰种子休眠解除的研究奠定基础。
1 材料与方法
1.1 材料
2018年10月在沈阳市植物园(123.61E,41.77N)收集自然成熟落下的天女木兰(Magnolia sieboldiiK.Koch)种子,选取饱满的天女木兰种子进行浸泡,去除假种皮,用5‰的高锰酸钾分别对种子和沙子消毒20min,边消毒边搅拌,用无菌水投洗至无色,并将浮在水面上劣质种子滤掉,消毒好的种子在0℃环境下进行沙藏,层积56d 后将沙藏后的种子分别平铺于3 个垫有6 层无菌水润湿纱布的培养皿中,放于22℃无菌组培室中,分别在持续黑暗(对照)、远红光(16h 光照/8h 黑暗)、红光(16h 光照/8h 黑暗)条件下进行萌发处理,并测定萌发率,在处理后7,11,16,32d 取样,剥离种皮,液氮速冻后置于-80℃冰箱中保存备用。将取样后剩余的萌发种子种植于基质中,待其长成小苗取其幼根、芽、第1真叶、幼茎、子叶、长枝(成年树枝,与种子同株)和第6真叶,用铝箔纸包好,液氮速冻后-80℃冰箱中保存备用。
1.2 方法
1.2.1 天女木兰MsPHYA基因全长cDNA的克隆 采用植物总RNA 提取试剂盒(天根)提取天女木兰的总RNA,经1%琼脂糖凝胶电泳检测其完整性,再用Nandrop 2000 进一步检测RNA 的浓度和纯度。利用GoS‐criptTMReverse Transcription System 反转录试剂盒(Promega)进行反转录,以提取到的总RNA 为模板,Oligo(dT)15 为引物,合成第一链cDNA。在NCBI 网站上查找拟南芥AtPHYA基因序列,结合天女木兰转录组信息数据(BioProjectNo.PRJNA545617 https://www.ncbi.nlm.nih.gov/biopr oject/PRJNA545617),用Primer Premier 5软件对MsPHYA基因ORF序列的特异性引物MsPHYA-F1、MsPHYA-R1(表1)进行设计。
以天女木兰种子cDNA 为模板,使用高保真酶Primer StarⓇHS(TaKaRa)对MsPHYA的ORF 序列进行PCR扩增。反应体系:Primer StarⓇHS 25μL,cDNA 1μL,正、反向引物各1μL,ddH2O 22μL。扩增程序:98℃预变性30s;98℃变性10s,52~62℃退火15s(52~62℃是为摸索退火温度而设计的温度梯度,每2℃为1 个梯度,梯度温度分别为52,54,56,58,60,62℃,72℃)延伸30s,30 个循环;72℃延伸10min。利用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0(TaKaRa)对目的基因条带进行回收与纯化。在加A尾反应后将回收纯化的目的片段与克隆载体pMD 18-T(TaKaRa)连接,再通过热激法将连接产物转入大肠杆菌DH5α 感受态细胞(TaKa-Ra)。将转化菌液均匀涂布在(含50mg·L-1Amp)的LB固体培养基上,37℃过夜培养,挑取单菌落,利用引物Ms-PHYA-F2、MsPHYA-R2(表1)进行PCR验证,将阳性克隆子送往Invitrogen公司测序进行进一步鉴定。

表1 试验所需引物序列Table 1 Primer sequences required for the experiment
1.2.2 天女木兰MsPHYA蛋白的氨基酸序列系统发育分析 通过NCBI 基因库下载MsPHYA 蛋白的同源氨基酸序列,DNAMAN进行同源序列比对,分析天女木兰MsPHYA蛋白保守区结构域。
1.2.3 天女木兰MsPHYA基因的表达分析 采用实时荧光定量PCR(qRT-PCR)进行表达量检测。用不同组织和不同时间点、不同光照处理下种子的cDNA 作为qRT-PCR 模板,60S rRNA 为内参基因,每个处理样品重复3次,使用仪器为德国耶拿QTOWER3G。反应体系(20μL):TB Green Premix Ex Taq II(Takara)10μL,MsPHYAF3、MsPHYA-R3(表1)各0.8μL,cDNA 2μL(使用前按1∶5 稀释),灭菌水6.4μL。两步法PCR 扩增程序为:95℃预变性30s,1 个循环;95℃变性5s,60℃退火20s,40 个循环,溶解曲线程序(95℃0s,65℃15s,95℃0s)。采用2-△△Ct法对基因进行相对定量分析。MsPHYA在不同组织中的差异表达分析以干种子的Ct值的平均数设为1,光照差异表达以未做光照处理的干种子的Ct值平均数设为1。
1.2.4 不同光照处理下天女木兰种子萌发率测定 以种子种皮裂开,胚根突破种皮作为判断萌发的标准。每个光照条件下各取100 粒天女木兰种子进行萌发试验,每天观察种子的萌发情况。当各光照处理下种子萌发率均超过50%时结束萌发观测,计算萌发率。萌发率(%)=(n/N)×100(n为观测结束时的最终萌发数,N为处理下的供萌发试验种子的总个数)。
1.2.5 天女木兰MsPHYA基因的原核表达载体pGS-21T-MsPHYA构建与诱导表达 依据前期pGS-21T-Ms-PHYA测序结果,设计带有酶切位点的引物:MsPHYA-21T-F 和MsPHYA-28a-R(表1)。用BamHI,Bam和XhoI,Xho分别对pMD18-T-MsPHYA质粒和pGS-21T 载体进行双酶切,切胶回收后的目的基因片段和载体片段经T4 DNA Ligase(ProbeGene)22℃连接1h,得到重组质粒,然后将其转化到大肠杆菌TOP10感受态细胞(TaKaRa)中,将转化菌液均匀涂布在LB 固体培养基(含有0.1g·L-1Amp)上,37℃恒温过夜培养,次日挑单菌落进行菌落PCR和双酶切验证,阳性克隆送往上海生工公司进行测序,测序正确的重组载体命名为pGS-21T-MsPHYA。
将重组质粒pGS-21T-MsPHYA转化大肠杆菌Rossetta(DE3)感受态细胞,过夜培养,接种LB液体培养基(含50mg·L-1Amp)中,37℃培养约4h,至OD600为0.6。取3个无菌离心管分别编号为0号、1号、2号。0号为对照,不加IPTG;1号、2号分别加入终浓度为5×10-3mmol·L-1的IPTG(Amersco),37℃诱导表达2h,将处理后的菌体蛋白样品进行12%SDS-PAGE电泳,检测蛋白表达情况。取1号菌800mL菌液培养,15℃诱导15h,用35mL冰浴的Buffer D(0.2mmol·L-1Tris-HCl,pH8.0;0.5mmol·L-1NaCl;0.1%Triton-100)重悬菌体细胞后超声裂解(600~800W,30min),最后1000r·min-1离心15min,分别取上清和沉淀进行12%SDS-PAGE电泳检测重组蛋白表达形式。
1.2.6 天女木兰MsPHYA重组蛋白的纯化、复性与定量 将上述裂解后的菌液取上清过GST柱,用200mL Buffer E(0.2mmol·L-1Tris-HCl,pH8.0;2nol·L-1NaCl;0.1%TritonX-100)和15mLBuffer D(0.2mmol·L-1Tris-HCl,pH8.0;0.5mmol·L-1NaCl;0.1%Triton-100)洗涤GST柱,取适量Buffer C(0.5mmol·L-1Tris-HCl,pH8.0;0.1mmol·L-1GSH)过GST柱洗脱,获得纯化后的重组蛋白。将上述裂解后的沉淀用Buffer B(0.5mmol·L-1Tris,pH8.0;5mmol·L-1NaCl;2%TritonX-100;0.05mmol·L-1DTT)重悬,超声洗涤3 遍,再用Buffer C(0.5mmol·L-1Tris,pH8.0;5mmol·L-1NaCl;0.05mmol·L-1DTT;0.02nol·L-1尿素)洗涤1遍,最后用Buffer D(0.5mmol·L-1Tris,pH8.0;5mmol·L-1NaCl;0.05mmol·L-1DTT;0.08nol·L-1尿素)溶解包涵体,离心取上清。将上清用稀释复性Buffer(0.5mmol·L-1Tris;0.5mmol·L-1Na-Cl;5mmol·L-1L-Arginine;0.03mmol·L-1GSSG;0.01mmol·L-1GSH;0.01mmol·L-1DTT,pH8.0)稀释复性48h。稀释复性结束后透析至0.2mmol·L-1Tris 和0.5mmol·L-1NaCl(pH=8.0)中,16h 透析结束,离心取上清,浓缩后上清用BCA蛋白浓度测定试剂盒测定蛋白浓度。
1.2.7 抗体制备和Western blot分析 以处理好的蛋白PHYA 进行BCA 蛋白浓度测定后,免疫2 只新西兰白兔(2.0~2.5kg),皮下免疫每次400μg,10d 免疫1 次,免疫4 次。采血检测,通过间接ELISA 方法确定抗血清针对PHYA 的效价,待效价大于1∶50000 进行最终采血制备抗血清。Western blot 分析参照ZHANG 等的方法采用bio-radMini-PROTEAN®Tetra 电泳系统行聚丙烯酰氨凝胶电泳,分离胶浓度12.5%。一抗Anti-PHYA 抗体(1∶500),二抗anti-rabbit IgG(1∶5000)[2]。
2 结果与分析
2.1 天女木兰MsPHYA基因克隆分析
以天女木兰种子的cDNA 为模板,选用MsPHYA全长引物,在退火温度分别为52,54,56,58,60,62℃下进行PCR 扩增基因全长,扩增产物经1%琼脂糖凝胶电泳检测结果表明,退火温度为52,54,56,58,60℃,在3000~5000bp 之间获得条带,转录组预测该基因全长3393bp,初步判断扩增出的条带为目的条带,其中最佳退火温度是56℃(图1)。扩增产物经胶回收与纯化、克隆后进行测序,结果与转录组数据一致。测序结果显示该基因包含一个完整的ORF,长度为3393bp,编码1130个氨基酸。
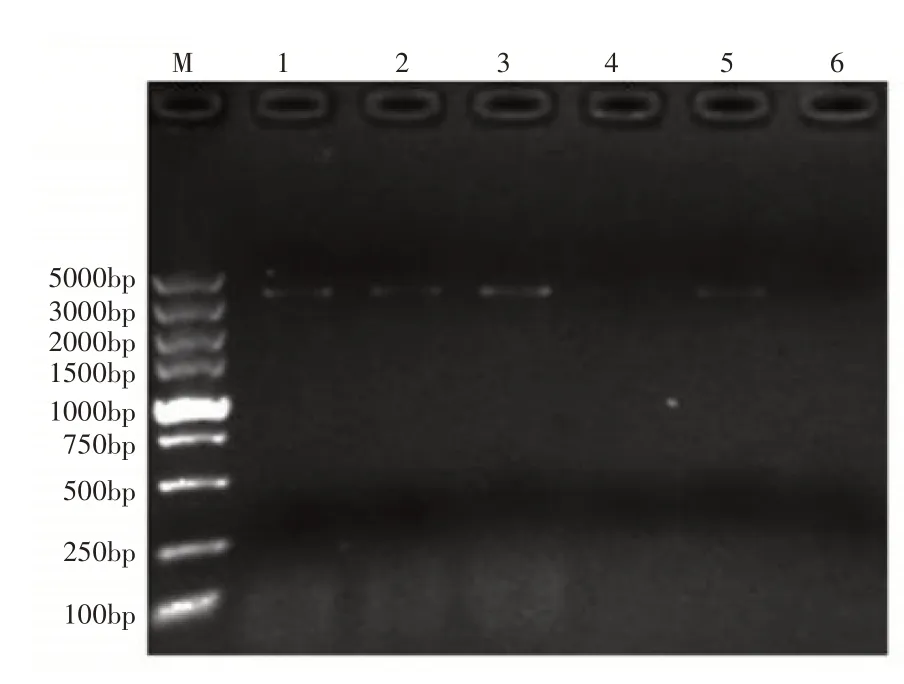
图1 MsPHYA基因全长扩增凝胶电泳检测Figure 1 Full-length amplification of MsPHYA gene was detected by gel electrophoresis
2.2 天女木兰MsPHYA蛋白的氨基酸序列系统发育分析
将天女木兰(Magnolia sieboldii)与沉水樟(Cinnamomum micranthum)、番茄(Solanum lycopersicum)、麻风树(Jatropha curcas)、拟南芥(Arabidopsis thaliana)、可可树(Theobroma cacao)、三叶通木(Akebia trifoliata)7 个物种氨基酸序列进行多序列比对,发现所有序列均具有PAS 结构域、GAF 结构域、Phytochrome Region 和His kinase结构域,说明植物光敏色素蛋白的氨基酸序列具有较高保守性(图2)。
2.3 天女木兰MsPHYA及MsPIF3的表达模式
利用荧光实时定量PCR(qRT-PCR)的方法对MsPHYA基因、MsPIF3基因在不同光质处理下的天女木兰种子以及各组织器官中的表达情况进行分析。结果显示,种子在响应不同光质的过程中MsPHYA基因的表达量均呈现先上升后下降的趋势,且在处理第7 天时,各光质条件下MsPHYA表达量就已显著增加,所有光质条件下该基因相对表达量均在第11 天达到最高(p<0.05)(图3A、B 和C)。在天女木兰幼根、芽、第1 真叶、幼茎中MsPHYA基因几乎不表达,在种子、子叶、第6 真叶中表达量显著高于其他组织,在长枝中表达量最高(p<0.05)(图3D)。对MsPIF3进行定量分析,结果发现种子在响应不同光质的过程中MsPIF3基因的表达量也均呈现先上升后下降的趋势,且第7天时,各光质条件下MsPIF3表达量显著增加,不论何种光质条件下该基因相对表达量均在第11天时达到最高(p<0.05)(图3A、B和C),MsPIF3与MsPHYA表达趋势一致。

图2 不同物种PHYA氨基酸序列比对及功能结构域分析Figure 2 Amino acid sequence alignment and functional domain analysis of PHYA in different species
2.4 不同光照处理对天女木兰种子萌发的影响
天女木兰种子光照处理6d后,种子迅速萌发,进入萌发高峰期。6d后D(黑暗)和R(红光)处理下的天女木兰种子萌发率高于FR(远红光)处理。在处理后第13天,R和FR处理下的天女木兰种子萌发率趋于平稳,D处理下的种子的萌发率明显上升,到达第17天,各处理下的天女木兰种子萌发率均到达50%。R和D处理下天女木兰种子的萌发率非常相近且高于FR处理下的天女木兰种子萌发率(图4)。
2.5 天女木兰MsPHYA重组质粒pGS-21T-MsPHYA的诱导表达
获得pGS-21T-MsPHYA重组载体后经1.0%凝胶电泳进行检测,发现目标条带(图5A),说明重组原核表达载体构建成功。加入终浓度为5×10-4mol·L-1的IPTG 诱导,37℃诱导2h后,经12%SDS-PAGE 电泳检测,其结果与未诱导的pGS-21T-MsPHYA重组菌相比,经IPTG 诱导的pGS-21T-MsPHYA重组菌蛋白分子量和理论分子量相当(约125kDa)(图5B)。
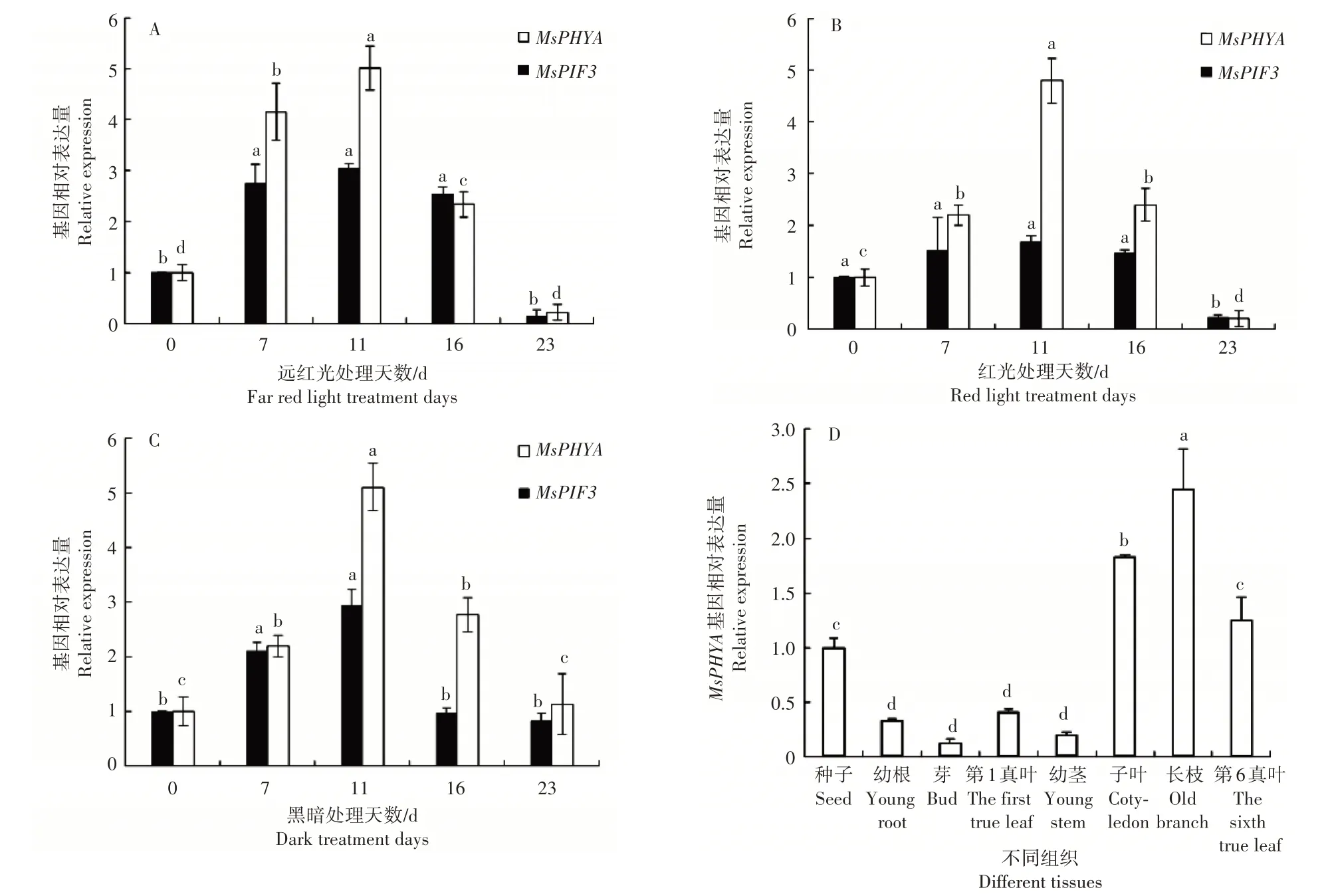
图3 MsPHYA、MsPIF3基因相对表达量Figure 3 Relative expression levels of MsPHYA and MsPIF3 genes

图4 不同光质处理下天女木兰种子的累计萌发率Figure 4 Cumulative germination rate of Magnolia sieboldii K. Koch seeds under different light quality treatments

图5 MsPHYA菌检阳性PCR检验(A)和pGS-21T-MsPHYA的SDS-PAGE电泳分析(B)Figure 5 PCR test for positive detection of amplified Ms-PHYA bacteria (A) and analysis of pGS-21T-MsPHYA fusion protein expression by SDS-PAGE (B)
2.6 天女木兰MsPHYA重组蛋白的纯化与抗体验证
将重组pGS-21T-MsPHYA放大培养15℃诱导15h,超声波破碎细胞,SDS-PAGE电泳检测发现,MsPHYA重组蛋白主要以包涵体形式存在于沉淀中(图6A),将沉淀溶解离心取上清,将上清用稀释复性Buffer 对其进行复性(图6B),复性后目的蛋白处条带清晰且无杂带。纯化后的蛋白可用于后续试验分析。
利用重组MsPHYA 免疫兔,获得MsPHYA 抗体。以天女木兰种子为材料,利用MsPHYA 特异性抗体进行Western blot分析,结果显示在90kDa存在目标条带(图7),Western blot检测目标条带分子量与预测的分子量存在偏差,可能是由于预染marker是由标准蛋白与有色染料偶联而成的,偶联后的蛋白由于表面结构的改变,影响其在SDS-PAGE中分离的线性,在ADAMS的研究中也有相似结果[15]。结果表明,抗体具有良好的特异性且制备成功,可用于天女木兰种子中PHYA蛋白丰度的检测,为揭示MsPHYA蛋白在种子休眠解除中的作用打下基础。
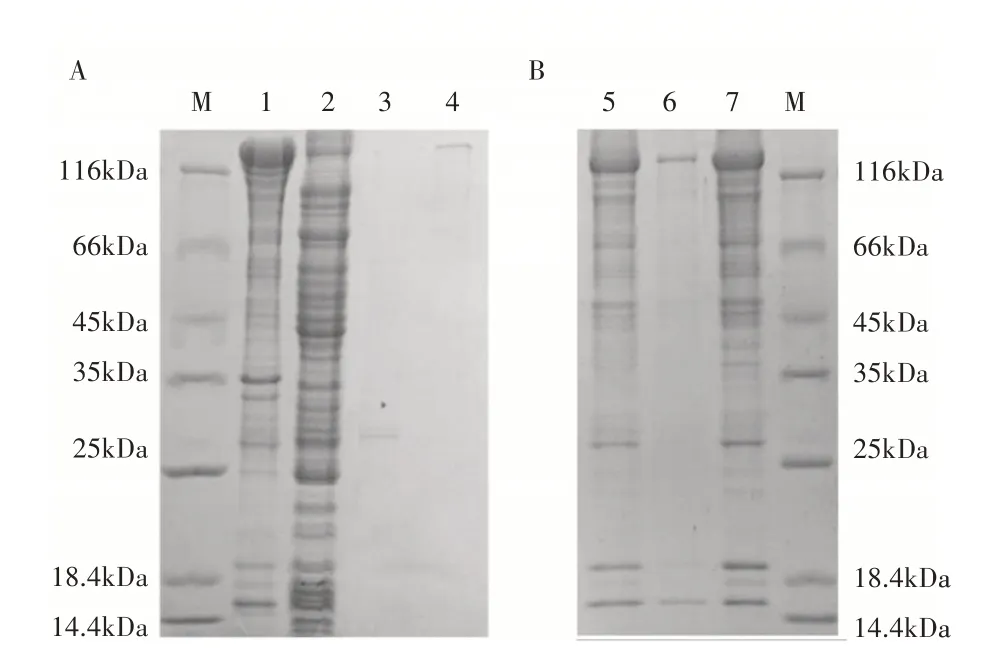
图6 SDS-PAGE电泳检测超声波破碎细胞(A)和MsPHYA重组蛋白的复性与定量(B)Figure 6 SDS-PAGE detection of ultrasonic-broken cells(A) and Renaturation and quantification of recombinant MsPHYA protein (B)
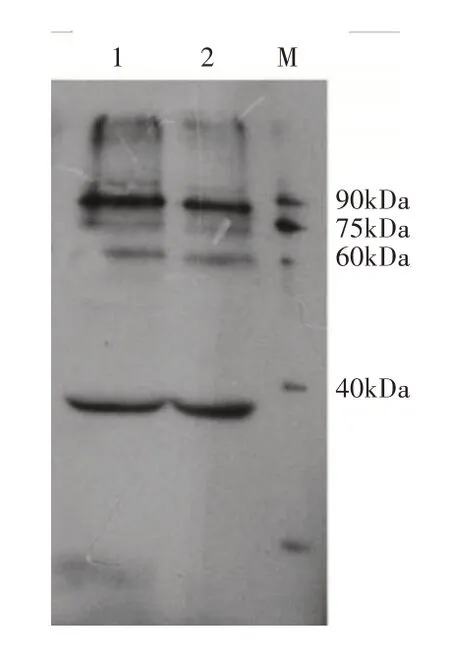
图7 内源MsPHYA蛋白抗体验证Figure 7 Verification of endogenous MsPHYA protein antibodies
3 讨论与结论
光受体蛋白PHYA 属于I 型光不稳定型光敏色素,其表达直接影响光信号转导效率,PHYA 在光信号介导种子休眠途径中起主要调控的作用[16]。氨基酸多序列比对结果显示MsPHYA 蛋白具有PAS结构域。PAS结构域包含在许多信号蛋白中,其作用是信号传导器,该结构域由3 个包含该结构域的蛋白命名:Per,周期昼夜蛋白;Arnt,芳基烃受体核运转蛋白;Sim,专一蛋白[17]。PAS结构域参与调控昼夜节律[18-19],可以推测MsPHYA受光调控而参与节律调节,并被运转到细胞核中发挥功能。
不同植物种子的萌发对光质的响应不同。研究表明香果树(Emmenopterys henryi)940nm 及850nm(远红光)下无种子萌发[20];波长较长的光对紫茎泽兰(Eupatorium adeuophorum)种子萌发有明显促进作用[21];红光能促进丽江山慈菇(Iphigenia indices)种子[22]和毛菍(Melastoma sanguineum)种子[23]萌发而被远红光抑制。本研究中萌发率测定结果表明远红光处理下天女木兰种子萌发率最低,与香果树、紫茎泽兰种子萌发规律相似。
为了探究MsPHYA在种子萌发时的作用,本研究对MsPHYA进行了qRT-PCR 检测,结果显示远红光处理7d 时MsPHYA表达量开始显著增高(p<0.05),说明远红光能够激活MsPHYA表达,但天女木兰种子在远红光下萌发率最低,说明休眠未被解除。推测MsPHYA下游应有其他调控因子发挥作用。证据表明MsPIF3 恰能与MsPHYA-Pfr直接互作,故本研究继续探讨了MsPIF3基因与MsPHYA基因在同一时空下的表达模式,结果显示MsPIF3表达量低于同时期MsPHYA表达量,MsPIF3表达量迟于MsPHYA表达量开始下降。红光、远红光和蓝光均能诱导PHYA 进入细胞核且过量PHYA 抑制FHY1/FHL 运转蛋白的转录,导致PHYA 无法继续进入细胞核[2]。本研究发现MsPHYA接收远红光后表达量先上升后下降,可以推测逐渐积累的MsPHYA-Pfr 抑制了FHY1/FHL运转蛋白的转录,MsPHYA-Pfr无法继续进入细胞核特异性结合MsPIF3,不能解除MsPIF3对种子萌发的抑制作用[6,24-25],导致远红光种子的萌发率低于黑暗和红光处理的种子萌发率的结果。综上推测远红光能够激发MsPHYA表达,但不足以解除天女木兰种子休眠,休眠解除至少部分受MsPIF3调控,且MsPIF3可能在MsPHYA下游对种子萌发起负调控作用。
综上可知,MsPHYA 是天女木兰种子萌发过程中重要的调控因子。本研究在克隆出MsPHYA基因并对其进行详细的生物信息学分析的基础上初步探索了该基因的功能,获得了纯度较高的MsPHYA 蛋白并制备抗体,抗体特异性较好,可用于后续MsPHYA 蛋白丰度分析,同时推测MsPIF3在MsPHYA下游参与调控天女木兰种子萌发。本研究有助于进一步探究天女木兰光受体蛋白MsPHYA 的功能,为揭示解除天女木兰种子休眠分子机制奠定基础。
