长期氮磷配施对褐土细菌多样性及土壤酶活性的影响
2022-03-26刘志平周怀平解文艳杨振兴马晓楠胡雪纯
刘志平,周怀平,解文艳,杨振兴,马晓楠,胡雪纯
(山西农业大学资源环境学院,省部共建有机旱作农业国家重点实验室(筹),山西 太原 030031)
土壤微生物和酶活性是表征土壤肥力的重要指标,二者在土壤物质转化和能量流动过程中起着极其重要的作用[1-2]。土壤微生物作为土壤生态系统的重要组成部分,包括细菌、真菌、古菌等。其中,细菌是土壤中最大的功能性类群之一,参与土壤呼吸、养分转化、有机物分解等过程[3-4],其多样性是评价土壤质量及生产力的重要指标[5]。土壤酶是由微生物、动植物活体分泌以及由动植物残体、遗骸分解,释放于土壤中的一类具有催化能力的生物活性物质,是土壤生态系统新陈代谢的重要动力,其活性可以反映出不同土壤生物化学反应的相对强度和土壤养分状况[6]。研究表明,土壤微生物及酶活性与土壤的理化性质、施肥方式、耕作措施等密切相关[7-8]。施肥是农业生产中的一项重要措施,可以提升土壤养分,增加粮食产量。近年来,为了保证粮食供给,大量的化肥输入农田,导致土壤出现板结、盐碱化、粮食减产等现象[9-10],同时也影响到了土壤细菌的生存环境及土壤酶活性。细菌的丰富度、均匀度、结构组成都会直接或者间接影响到土壤肥力、土壤酶活性,进而威胁到粮食安全。
大量研究表明,施肥影响土壤细菌的多样性,合理施肥能显著提高细菌OTU数量、功能多样性及活性[11],而长期不合理施肥却降低了细菌的α-多样性,很大程度上改变了细菌的物种组成[12],细菌群落的变化又会间接影响土壤酶活性,合理施肥可以提高土壤蔗糖酶、脲酶、碱性磷酸酶等的活性[13-15]。土壤酶参与不同物质的分解与转化,通常与土壤养分状况关系密切,也会随着作物生育期发生变化[16]。
随着人口增加及人为扰动加剧,我国耕地土壤出现不同程度的退化现象。山西是我国特色农业大省,也是重要的粮食种植区。褐土是山西主要类型之一,研究褐土不同施肥下土壤细菌的多样性及土壤酶活性,对我省土壤肥力培育及合理施肥具有重要意义。土壤细菌群落结构的形成与演替需要经历漫长的过程,长期定位试验有利于合理、全面地解释这一过程。目前用16S rRNA测序技术研究褐土区不同氮磷配施对细菌多样性的报道比较少。本试验基于山西寿阳长达28 a的定位试验,以5个不同氮磷配施处理的耕层土壤(0~20 cm)为研究对象,采用Illumina Hiseq高通量测序技术,对土壤细菌16S rRNA的V3-V4区进行测序,探讨氮磷化肥配施对细菌多样性及群落结构的影响,通过测定蔗糖酶、脲酶和碱性磷酸酶的活性,分析细菌群落与酶活性及环境因子之间的相关性,为山西褐土的肥力培育及氮磷化肥的合理减施提供理论依据。
1 材料与方法
1.1 研究区概况
长期定位试验地点位于山西省晋中市寿阳县宗艾镇宗艾村“国家农业环境寿阳观测试验站(113°06′38″E、37°58′23.0″N)”。试验站海拔为1130 m,土壤发生分类为褐土,成土母质为马兰黄土,系统分类属于简育干润雏形土(Hapli-Ustic Cambosols)[17]。该区属中纬度暖温带半湿润偏旱区大陆性季风气候区,年均气温为7.4℃,年均降水量500 mm。试验地初始pH值为8.4,有机质为23.8 g·kg-1、碱解氮为117.69 mg·kg-1、有效磷为4.84 mg·kg-1、有效钾为100 mg·kg-1。
本长期定位试验从1992年春开始种植春玉米,采用大田裂区方式分布。按照氮肥和磷肥的用量梯度,共设置5个处理:N1P1, N2P2, N3P3, N4P4和CK,每个处理3个生物学重复,共15个小区,每个小区长8.3 m,宽8 m,面积约为66 m2,各小区间起垄隔离。玉米品种为大丰30,播种密度为66 000株·hm-2,玉米播种前进行旋地和施肥,氮肥为尿素(46% N),磷肥为过磷酸钙(46% P2O5),施肥量见表1,方式为全部播前基施。

表1 试验处理及施肥
1.2 样品采集
2018年10月玉米收获后,各小区采用“S”形取样法,取5点制成一个混合土样。用土钻采集0~20 cm的土壤样品去掉明显的石砾、残枝败叶等杂物,用无菌袋装好,将其置于冰盒带回实验室后分为两部分,一部分用于土壤DNA的提取和微生物多样性分析,可暂时保存于-80℃;另一部分自然风干后过筛,进行土壤酶活性及理化性质的测定分析。
1.3 测定方法
1.3.1 土壤理化性质测定 土壤理化性质的测定方法均参照鲍士旦编著的《土壤农业化学分析方法》[18]。
1.3.2 土壤细菌多样性分析 准确称取0.5 g土样,采用Fast DNA SPIN DNA提取试剂盒(MP Biomedicals, Santa Ana, CA, United States),按照说明书的方法进行土壤DNA的提取,用0.7%的琼脂糖凝胶进行电泳,观察条带是否清晰、完整;用紫外分光光度计NanoDrop ND-1000(Thermo Fisher Scientific, Waltham, MA, USA)测定DNA的浓度。
通过PCR扩增细菌的高变区V3-V4区,引物为338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)[19],在上游引物中加入7个碱基的寡核苷酸标签序列barcode,用来区分不同样品。PCR扩增采用 NEB Q5 DNA 高保真聚合酶,反应体积为25 μL,体系组成为:模板DNA 2 μL,上下游引物各1 μL,Q5 DNA聚合酶0.25 μL,反应缓冲液5 μL,dNTP 2 μL,补无菌水到25 μL。PCR程序为:98℃预变性2 min;98℃变性15″,55℃退火30″,72℃延伸30″,反复25个循环;72℃充分延伸5 min。扩增结果进行2%琼脂糖凝胶电泳,切取目的片段,然后用 AxyPrep DNA 凝胶回收试剂盒(Axygen Biosciences, Union City, U.S.)回收目的片段,通过PicoGreen dsDNA Assay Kit(Invitrogen, Carlsbad, CA, U.S.)进行定量。将扩增产物送至上海派森诺生物科技股份有限公司,进行高通量测序。
1.3.3 土壤酶活性的测定 脲酶活性采用苯酚钠-次氯酸钠比色法,以24 h后1 g土壤中NH3-N的质量(mg)表示脲酶活性;碱性磷酸酶活性采用磷酸苯二钠法,以24 h后1 g土壤中酚的质量(mg)表示脲酶活性;蔗糖酶采用3,5-二硝基水杨酸比色法,以24 h后1 g土壤中葡萄糖的质量(mg)表示蔗糖酶活性,详见参考文献[20]。
1.4 数据统计
采用QIIME对测序数据进行处理[21]。首先,将与Barcode精确匹配的原始测序Reads分配给各样本,去除低质量序列,使用FLASH(v1.2.7)进行组装和拼接[22],UCHIME(v4.2)进行嵌合体剔除,剩余的优质序列通过UCLUST以97%的相似度阈值划分OTU(Operational taxonomic units)[23]。从每个OTU中选择一个具有代表性的序列,与Silva 132数据库进行比对和OTU分类[24]。序列数据分析主要采用QIIME和R(v 3.6.3, Vegan package)进行[25-26]。利用QIIME计算Chao1和Shannon指数。采用主成分分析(Principal component analysis,PCA)研究不同样品间细菌群落结构的变化。采用置换多元方差分析(PERMANOVA)[27]评估各组间细菌群落组成差异的显著性。利用MEGAN[28]进行细菌群落分类组成和丰度可视化。采用无加权组算术平均法(UPGMA),利用R软件进行物种组成相似性分析,并通过CANOCO软件进行细菌群落与环境因子的冗余分析(Redundancy analysis,RDA)。15个土壤样本共得到376833条高质量序列,原始数据已提交至NCBI数据库中,编号为PRJNA706469。
采用SPSS软件(version 22)进行单因素方差分析(ANOVA),检验土壤理化性质、土壤酶活性、细菌α-多样性指数等的正态分布和方差同质性。在P=0.05水平下,采用LSD(Least significant difference)检验分析数据间的显著性差异。
2 结果与分析
2.1 不同氮磷配施对土壤理化性质及玉米产量的影响
2.1.1 不同氮磷配施对土壤理化性质的影响 不同氮磷施肥对土壤理化性质的影响如表2所示,与CK相比,氮磷化肥配施降低了土壤pH,并且提高了土壤AN、AP、AK、OM、TN、TP和TK的含量。其中,AN、AP、AK、OM和TP在各处理之间均存在显著差异(P<0.05)。与CK相比,N1P1、N2P2、N3P3、N4P4处理的AN增幅分别为:97.8%,116.6%,159.0%和208.2%;AP的增加率分别为120.1%,387.7%,635.2%和862.6%。与CK相比,各氮磷配施处理土壤有机质的增加率范围为84.8%~102.9%,在N2P2处理中土壤有机质达到最高,之后出现下降的趋势。
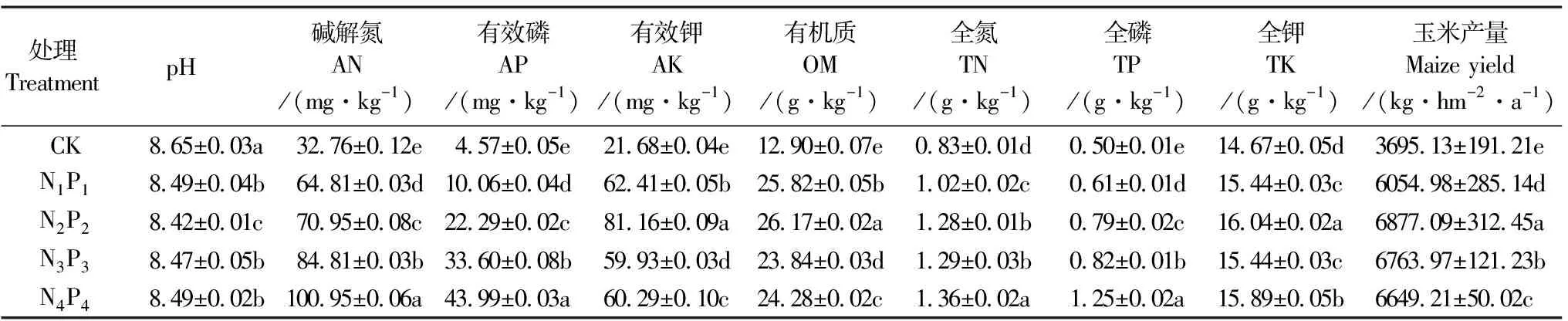
表2 不同氮磷配施处理下土壤的理化性质及玉米产量
2.1.2 不同氮磷配施对玉米产量的影响 氮磷配施显著提高了玉米产量,且各处理间的差异显著(P<0.05)。与CK相比,N1P1、N2P2、N3P3、N4P4处理的玉米产量增加率分别为63.9%,86.1%,83.1%和79.9%。玉米产量在N2P2处理中达到最高,之后呈现下降趋势,说明超过一定界限后继续增加施肥量并不能增加玉米的产量。
2.2 不同氮磷配施处理下土壤细菌的多样性
2.2.1 土壤细菌的α-多样性 细菌的α-多样性指数如表3所示,Chao1指数在不同处理间未见差异,Shannon指数只有在N1P1和N4P4两处理间差异显著(P<0.05),其他处理之间差异不显著。随着氮磷化肥用量的增加,Chao1指数和Shannon指数均出现波动,在N1P1处理下,两种指数均达到最高,之后开始下降,虽然在N3P3处理下Chao1指数重新出现上升,但是整体上呈现下降的趋势,在N4P4处理中,两种指数低于CK处理。

表3 不同氮磷配施处理下细菌的α-多样性
2.2.2 门水平土壤细菌相对丰度 通过对各处理细菌16S rDNA的高通量测序结果进行分析和比对得知,所有细菌共注释到33个门,111个纲,315个目,522个科和956个属。相对丰度值排序位于前10位的细菌门如图1所示。排名在前5位的门依次为:变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes),共占所有菌门的85%以上,在各个处理中平均相对含量为:23.3%~26.8%,20.5%~23.3%,15.0%~17.8%,12.9%~15.7%,7.1%~10.2%。与CK相比,N1P1、N2P2、N3P3、N4P4处理芽单胞菌门的相对含量提高,并且随着氮磷化肥用量的增加,芽单胞菌门的相对含量逐渐升高,增加率依次为0.05%,2.47%,3.07%,3.09%。与此相反,酸杆菌门的相对含量随着氮磷化肥用量的增加而呈现降低规律,与CK相比,N1P1、N2P2、N3P3、N4P4处理中酸杆菌门依次显著降低了0.98%,1.52%,2.29%,2.79%。此外,放线菌门相对丰度依次降低了0.38%,2.22%,3.22%,2.52%。
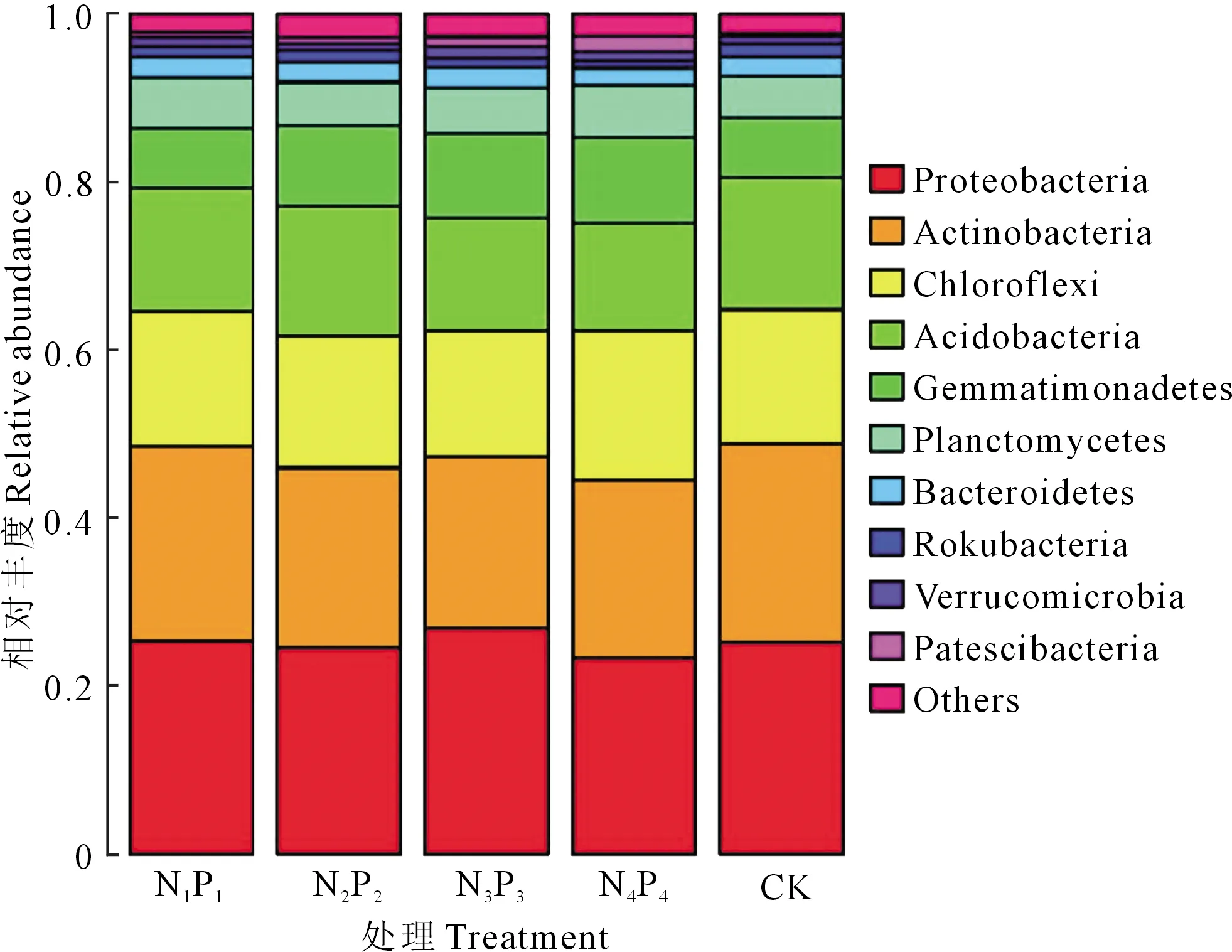
图1 不同处理下土壤细菌在门水平上的相对丰度
2.2.3 土壤细菌的β-多样性 采用主成分分析进行土壤细菌β-多样性检验,结果如图2所示,PC1和PC2两个轴分别解释了64.1%和22.0%的细菌群落变化。整体来看,同一处理的3个重复距离较近,说明平行性较好,而不同处理的样本彼此分离,说明不同施肥下土壤细菌群落结构有差异。置换多元方差分析(图3)表明,组间差异显著高于组内差异(P<0.001),R值为0.898,接近于1,因此,不同处理之间细菌群落差异显著。
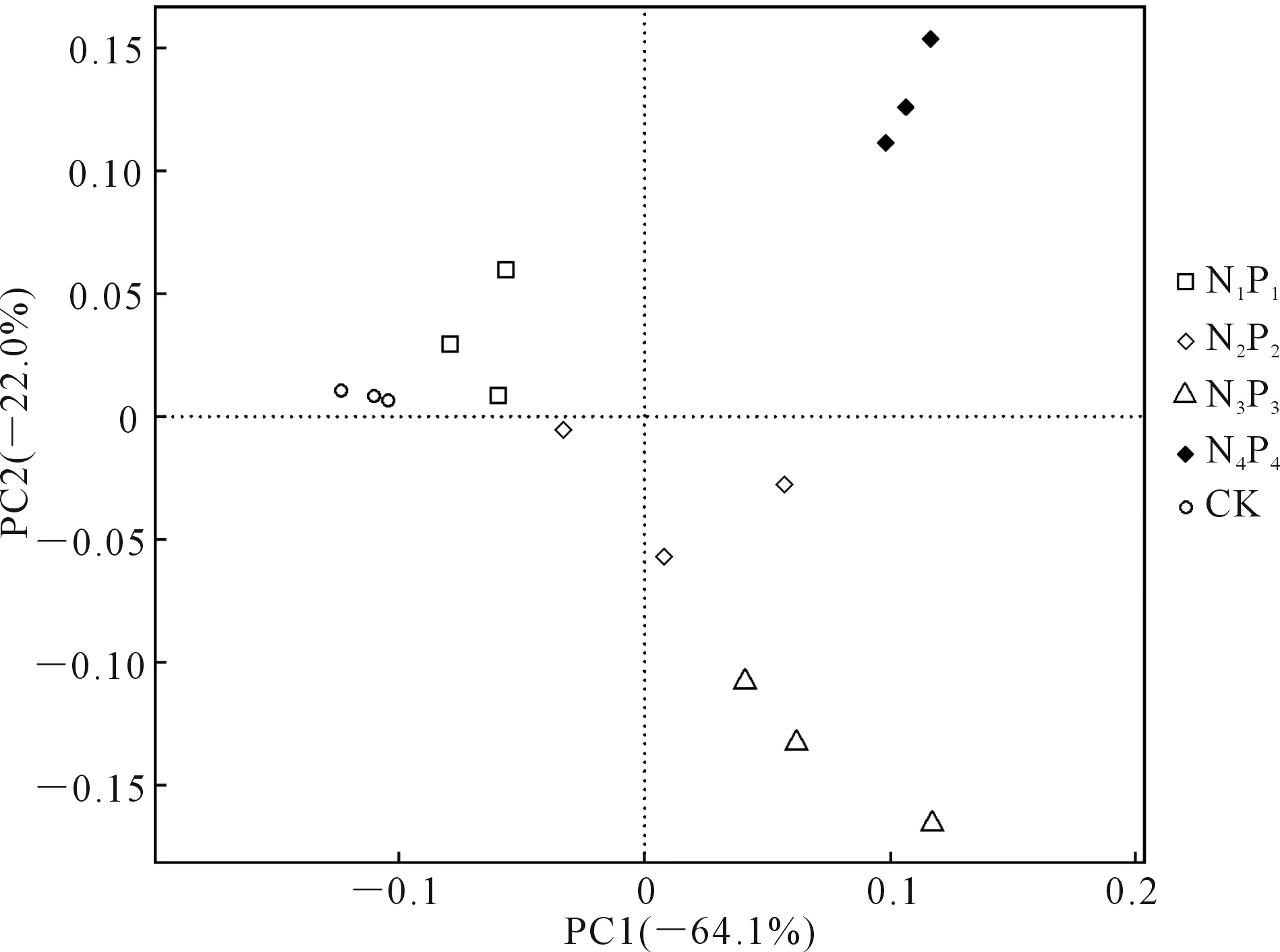
图2 不同处理土壤细菌β-多样性检验的主成分分析
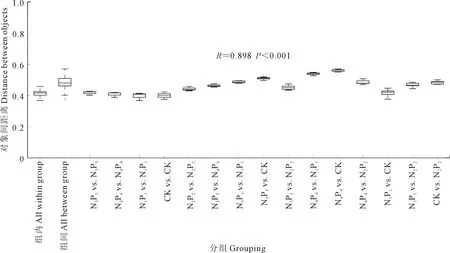
图3 置换多元方差分析
2.3 不同氮磷配施对土壤酶活性的影响
如表4所示,不同氮磷配施对蔗糖酶、脲酶及碱性磷酸酶的影响规律不同。氮磷配施增加了土壤脲酶活性,N3P3和N4P4处理中,脲酶活性显著高于CK处理,并且随着氮磷用量的增加,脲酶活性呈现逐渐增长的趋势,N1P1、N2P2、N3P3、N4P4处理中脲酶活性较CK分别增加3.2%、4.7%、8.4%和14.9%;相反,与CK相比,氮磷配施显著降低了土壤碱性磷酸酶的活性,随着氮磷用量的增加,碱性磷酸酶活性逐步降低,N1P1、N2P2、N3P3、N4P4处理中碱性磷酸酶活性较CK分别降低16.9%、18.5%、28.4%和29.0%。与CK相比,氮磷配施降低了土壤蔗糖酶活性,降低范围为15.0%~28.5%,除N2P2处理外,差异均达到显著水平;4个氮磷配施的处理中,N2P2处理蔗糖酶活性最高。
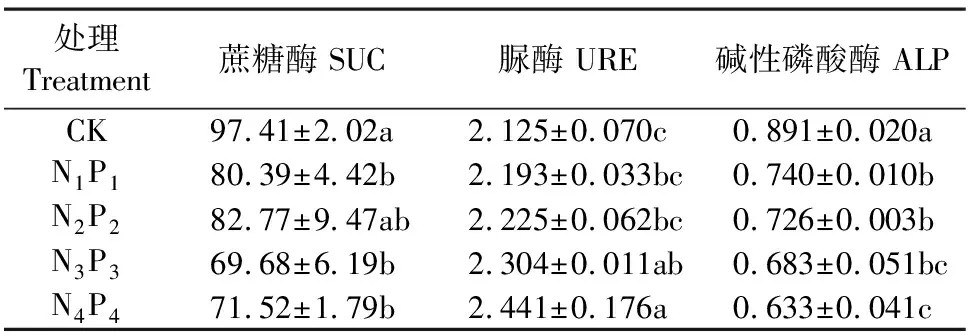
表4 不同处理对土壤酶活性的影响/(mg·g-1·24h-1)
2.4 影响细菌群落结构的土壤理化因子及酶活性的RDA分析
通过CANOCO软件对各处理下细菌群落和土壤理化因子及酶活性进行RDA分析,结果如图4所示。前两个轴总共解释了76%的细菌群落变化,第一轴为53.2%,第二轴为22.8%。其中,土壤AP(F=13.705,P=0.002)对细菌群落结构的贡献率最大;其次为TN(F=11.507,P=0.002),8个土壤理化因子及3个酶活性贡献率顺序为:AP>TN>TP>AN>SUC>ALP>URE>TK>pH>OM>AK。
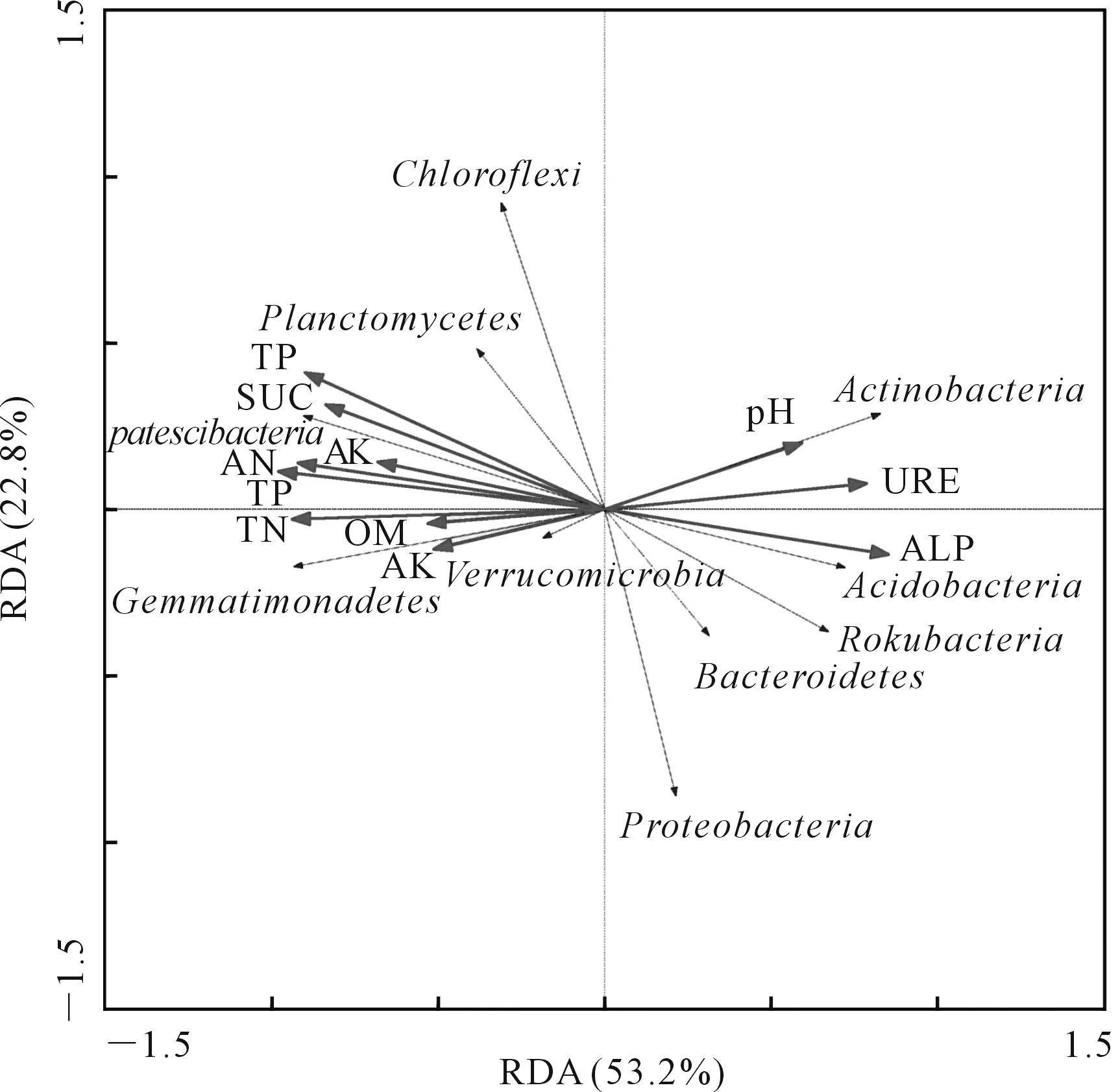
图4 不同处理下土壤细菌群落与土壤理化因子及酶活性的冗余分析
2.5 玉米产量与土壤理化因子及酶活性的相关性
玉米产量与土壤理化因子及酶活性间均存在不同程度的相关性(表5)。玉米产量与土壤AK、OM、TN、TK呈显著正相关,与pH呈极显著负相关,与ALP呈显著负相关;pH与AK、OM和TK均呈显著或极显著负相关;AN与TN和URE均呈显著正相关;ALP活性与SUC活性呈显著正相关,与URE活性呈显著负相关。

表5 玉米产量与土壤理化性质及酶活性的Pearson相关性分析
3 讨 论
3.1 氮磷配施对土壤理化性质及玉米产量的影响
大量研究表明,长期施用化肥会造成土壤的酸化[29-30]。本研究中试验地虽然偏碱性,但是与CK处理相比,施肥降低了土壤的pH值,可能是酰胺态氮肥尿素施入土壤中水解硝化逐年释放H+所致[31-32]。施肥可以提高各类型土壤中养分的含量及作物产量[33-34],本研究CK处理中,土壤有机质主要来源为作物根茬,每年玉米残留根茬积累在土壤中的有机质远不能满足土壤每年分解的有机质,因此不能维持试验前的有机质水平。研究表明,适量施用化肥能够提高土壤有机质的含量或者极大程度地维持土壤有机质的平衡[8-9],在本结果中,随着氮磷化肥量的增加,有机质出现先增加后降低的趋势,并在N2P2处理中达到最高,可能是因为N2P2处理的生物量最高,残留根茬中有机碳含量也最高,有利于土壤中有机质的维持与提升,而过量施用化肥导致土壤有机质含量下降,可能是因为氮肥用量过高会改变土壤pH值,降低土壤中的C/N,从而影响土壤有机质的分解与转化。
玉米产量在N2P2处理中达到最高,且显著高于其他处理,说明在一定范围内增施化肥可以提高作物产量,超过这个范围便不再有增产作用。本研究中,N2P2的施肥量(N 120 kg·hm-2,P2O575 kg·hm-2)更适合山西褐土玉米的生长。
3.2 氮磷配施对土壤细菌α-多样性及群落组成的影响
α-多样性指数是评价细菌群落多样性的重要指标,多样性指数越高表明细菌群落的丰富度和均匀度越高。本研究中的Chao1指数侧重体现细菌群落的丰富度,Shannon指数兼顾群落的均匀度。陈哲等[35]研究发现,在稻田中长期氮磷钾配施可以增加土壤细菌的多样性,但是单施氮肥细菌多样性反而会降低;ZHOU等[36]研究发现在黑土上长期施化肥会降低土壤细菌的多样性。本结果的5个处理间两项指数差异均不明显,总体表现为下降趋势。
通过对各处理细菌16S rDNA的高通量测序结果进行分析和比对得知,所有细菌共注释到33个门。其中五大优势菌门依次为:变形菌门、放线菌门、绿弯菌门、酸杆菌门和芽单胞菌门,这些菌门普遍存在于森林、湖泊、温室等土壤中,具有较强的生成能力,但是细菌群落结构会随生态位点及作用底物的差异而发生变化[37-38]。研究表明,酸杆菌门中的大部分细菌生长缓慢,适合在营养匮乏的环境中生长[39],因此,随着氮磷化肥施用量的增加,酸杆菌门丰度呈现下降趋势。研究发现,芽单胞菌门适合在水分含量低的土壤中生存[40],本研究N4P4处理氮磷化肥的施用量远超出作物需求,可能会导致土壤出现板结,进而影响水分的入渗,因此,更适合芽单胞菌门的生长。此外,不同土壤类型、不同试验环境及不同作物也会导致细菌各类群的相对丰度有一定差异[41],这也造成了本研究中某些菌门的相对丰度与其他研究的差别。
3.3 氮磷配施对土壤酶活性的影响
蔗糖酶参与土壤中碳水化合物的转化,能促进蔗糖分解成葡萄糖和果糖,是参与土壤碳循环的重要酶类之一,也可用来评价土壤熟化程度;脲酶是一种作用于线型酰胺键的酶,能将尿素催化水解成氨、CO2等小分子无机化合物,是参与土壤氮素循环的重要酶类之一,脲酶活性反映土壤有机态氮的转化能力和土壤无机氮的供应能力;磷酸酶能够催化土壤有机磷化合物矿化,其活性高低直接影响土壤中有机磷的分解、转化及生物有效性,分为酸性磷酸酶、中性磷酸酶和碱性磷酸酶,本试验地的土壤pH值在8.42~8.65之间,以碱性磷酸酶为主。本研究选择这3种酶,研究不同氮磷配施对它们的影响。结果显示,脲酶活性随着施肥量的增加而不断提高,这与前人的研究结果类似[42]。与CK相比,施肥整体降低了蔗糖酶的活性,但在4个氮磷梯度处理中,随着氮磷化肥用量的增加,蔗糖酶活性出现先增加后降低的现象,在N2P2处理中达到最高,这一现象与土壤有机质的变化趋势吻合。陈文博等[43]在研究化肥对稻田土壤酶活性的影响时发现,在水稻分蘖盛期,随着化肥量的增加,蔗糖酶活性下降,但在其他生育期蔗糖酶活性是增加的,说明蔗糖酶活性与作物生育期也有一定关系。碱性磷酸酶主要来源于植物根系和微生物的分泌物,在pH值为9~10之间活性达到最高。有研究表明,磷肥的施入可以提高土壤磷酸酶的活性,但在本研究的结果中,4个氮磷配施的处理均降低了土壤碱性磷酸酶的活性,并且随着施磷量的增加,呈现降低趋势,可能是因为施肥后土壤pH值降低,碱性磷酸酶的活性受到一定程度的抑制。
3.4 不同因子间相关性分析
土壤中养分、酶、细菌都是作物生长不可或缺的因素。土壤酶很大一部分来自微生物的分泌物,因此细菌与土壤酶活性存在不同程度的相关关系。RDA前两轴可以解释76%的细菌群落变化,细菌优势门与土壤理化因子及酶活性存在一定的相关性。玉米产量与土壤AK、OM、TN、TK呈显著正相关,与pH呈极显著负相关,与ALP呈显著负相关,这与前人研究结果类似[44-46]。土壤各理化因子与酶活性之间相互影响,共同促进养分循环及能量流动,为作物生产提供良好环境。
4 结 论
1)细菌β-多样性在不同氮磷配施处理中差异显著;随着氮磷化肥用量的增加,细菌α-多样性在N1P1处理中达到最高,之后呈现下降趋势。
2)随着氮磷施用量的增加,土壤脲酶活性逐渐增加,蔗糖酶和碱性磷酸酶活性均呈现下降趋势。
3)RDA分析表明,土壤有效磷和全氮对细菌群落结构差异的贡献率最大。
4)土壤有机质和玉米产量在N2P2处理中达到最高,施肥量N 120 kg·hm-2,P2O575 kg·hm-2更适合山西褐土玉米的生长。
综上所述,化肥施用过量不利于土壤中细菌多样性及土壤酶活性的维持,农业生产中,需适当减少化肥用量,以保证作物产量、维持土壤健康。
致谢:诚挚感谢上海派森诺生物科技股份有限公司提供的测序平台。
