聚乙烯塑料的微生物降解
2022-03-25卢亚红马瑜浩张宇鹏孙文潇
刘 强 ,卢亚红,吴 慧,马瑜浩 ,张宇鹏,孙文潇,张 宏*
(1.西北民族大学化工学院,兰州 730030;2.环境友好复合材料国家民委重点实验室,兰州 730030)
0 前言
PE塑料发展至今因其具有生产成本低、防水和坚固耐用等特点,已被广泛应用于农业(如塑料地膜、浇灌水带)、生活用品(如塑料吸管、包装袋)、建筑领域(如管材)的生产制造中,成为我们日常生活中无法代替的材料[1]。据统计每年全球塑料的生产量都在不断增长,截止2018年总产量达到7.8×109t,中国塑料的生产量在全球塑料产量中占比最大,年产量约占全球总产量的25%[2],但是据生态环境部统计,2019年我国废弃塑料的回收率不到10%。这些被人们随意丢弃在自然环境中的塑料因其高疏水性和化学惰性很难在环境中自然降解,所以导致产生世界性的“白色污染”问题,对生态环境造成了巨大的影响。目前全球对于这些极难被自然降解的PE塑料主要采用比较原始的处理方式,如填埋、焚烧[3]、堆肥等。但这些方式会造成生态环境的二次污染,填埋的塑料随着时间的推移会使其变成危害性更大的微塑料[4],可能会通过食物被人体吸收,其对于人体的具体危害情况还未见报道。目前的研究认为,生物降解可将废旧PE同化最后产物只有CO2和H2O,所以生物降解作为环境友好的处理方法可很好地解决废旧PE的污染治理难题。
目前,广泛应用于人们日常生活中的塑料品种主要包括聚对苯二甲酸乙二醇酯(PET)、PE、聚氯乙烯(PVC)、聚丙烯(PP)、聚苯乙烯(PS)和聚氨酯(PU)等。近年来对这些塑料的微生物降解研究已经初见成果,其中PET、PS和PU的微生物代谢途径已经被研究者发现[5-6]。PVC和PP由于官能团和双键的存在增加了降解酶的作用位点,所以与PE相比有利于微生物的降解;PE由于具有高疏水性、高分子量和结晶度导致在微生物降解中难于其他各种塑料,所以PE的微生物降解成为本文的关注点。
自20世纪70年代以来,大量报道证实,在自然环境中存在以PE为唯一碳源生长的菌株,这为PE废物处理提供了新的思路[7]。现在全球的生物学家意在寻找一种高效的PE降解菌。在报道中,大多数研究人员采用比较传统的微生物学方法对PE降解菌进行分离,最后通过对降解前后聚合物物理化学性质的变化来评价各降解菌的降解效率,这些物理化学性质的变化包括7个方面:表面官能团、亲水性/疏水性、结晶度、分子量、表面形貌、力学性能和质量损失[8]。各研究人员虽然在研究流程上大体相同,但是在降解能力测试中由于所用PE类型的不同和表征方法的误用等因素,造成无法对各类型降解菌的降解效率进行对比,让PE降解研究中的工作者不能很好地理解“高效”这一概念;甚至会导致筛选出假阳性降解表型的菌株,阻碍了PE生物降解研究的发展。所以Montazer等[9]在2019年提出了一种“生物降解实验的建议流程”,以阐明实现PE生物降解所需的参数并简化PE微生物降解实验结果的比较。本文将从参与降解的微生物和表征方法对近期的研究进展进行总结,对上述的“生物降解实验的建议流程”进行改进和补充,为进一步研究PE的微生物降解特别是降解菌的高效性定义上提供理论参考。
1 参与PE降解的微生物
大量文献已经证实许多研究者从自然环境(土壤、海洋、垃圾处理站等)和特定培养基中筛选出了能够降解PE的微生物,还有一些菌株在印度粉蛾和蜡虫的肠道中被发现[7]。研究者们利用不同的技术手段对降解前后的聚合物进行表征,证实了自己实验中筛选的菌株对聚合物进行了不同程度的降解。据统计目前筛选出的微生物中细菌种类最多;放线菌最少。众所周知,土壤中的菌落组成中放线菌的数量仅次于细菌,但是报道中少见放线菌菌株从土壤中被筛选出来,这与统计结果产生了矛盾,作者认为造成这种矛盾的原因是由于实验条件和培养基选择上的限制,所以放线菌的筛选应该引起研究者的注意。相信在以后的研究中,随着筛选方案的优化和新技术的应用,越来越多且降解能力极强的菌株会被报道出来。
1.1 参与PE塑料微生物降解的细菌菌株
超过20个细菌属已被证明能降解不同类型的PE。这些菌包括各种革兰氏阴性和革兰氏阳性细菌,属于假单胞菌属、芽孢杆菌菌属、克雷伯氏菌属、不动杆菌属等,以及红球菌、葡萄球菌、芽孢杆菌等[10-13]。这些细菌菌株中的大多数都具有破坏PE表面和(或)在PE上形成生物膜的能力。表1总结了近年来被发现的与PE生物降解相关的细菌菌株。报道中,大多数研究者使用低密度聚乙烯(PE-LD)和高密度聚乙烯(PE-HD)作为降解菌的唯一碳源。2016年,Kowalczyk等[14]从土壤中分离到一株新的木糖氧化芽孢杆菌PE-1,用傅里叶变换红外光谱(FTIR)和扫描电子显微镜(SEM)对降解前后的样品进行了分析,结果表明PE-HD的化学结构发生了变化。由于木糖氧化杆菌PE-1对PE-HD薄膜的降解作用,最后还检测到约9%的质量损失。2018年,Ndahebwa Muhonja等[15]从丹多拉垃圾场筛选出一些PE降解细菌,对细菌的16S rDNA和18S rDNA序列分析表明,属于真假单胞菌属、芽孢杆菌属、短杆菌属、纤维素微生物属、赖氨酸杆菌属,在以PE-LD为唯一碳源生长16周后通过FTIR分析显示,由于碳氢化合物降解,出现了新的官能团。还通过调节培养温度以寻找降解实验的最佳条件。2020年,Maroof等[16]从巴基斯坦的一处垃圾处理厂筛选出6株具有潜在生物降解活性的菌株,用无添加剂PE-LD薄膜作为唯一碳源培养90 d后,利用SEM观察到PE-LD薄膜有轻微的表面破裂,傅里叶变换红外光谱显示形成典型的羰基峰,通过羰基指数测定,孵育后羰基峰明显减少。X射线衍射分析显示结晶度百分比增加,还在细菌分离物中鉴定出不同的负责降解PE-LD的基因。
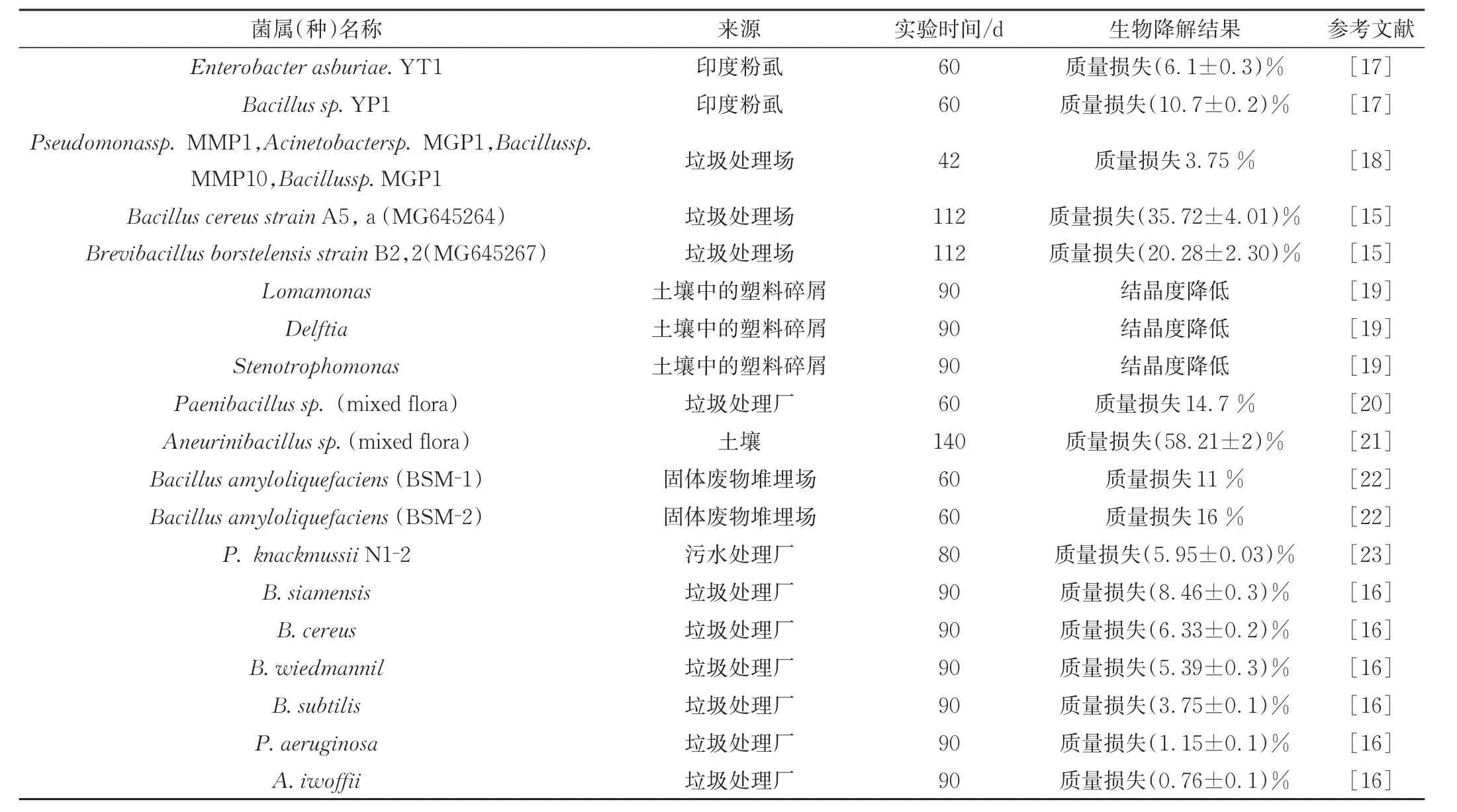
表1 参与PE塑料生物降解的细菌菌株Tab.1 Bacterial strains involved in biodegradation of polyethylene plastics
1.2 参与PE塑料微生物降解的真菌菌株
除了细菌,一些真菌属,包括曲霉属、枝孢霉属、镰孢属、青霉属、黄孢原毛平革菌属也被报道可降解PE[24-25]。一般来说,真菌被认为比细菌更能有效地降解PE,因为真菌在生物原位修复过程中会产生疏水蛋白,其双层结构能在疏水/亲水界面形成两亲性膜(Amphipathicfilm),作为生物表面活性剂提高了底物的接触面积,从而大大提高降解效率[26]。表2总结了近年来能够降解PE的真菌菌株。2014年,Merina等[27]从城市垃圾处理厂的土壤中以PE-LD粉末为唯一碳源筛选出5种真菌,其中4种被鉴定为曲霉菌属,剩下的为镰孢菌属;在33.3℃下培养60 d后进行测试样品的失重情况,其中FSM-10和FSM-3表现出最大的降解效率,分别为9%和8%;FSM-6和FSM-8次之为7%;FSM-5的最小为5%。2016年,Gajendiran等[28]从填埋场的土壤中筛选出一株具有降解PE潜力的真菌,基于18S rRNA分析分离的菌株被鉴定为棒状曲霉并命名为Aspergillus clavatus JASK1。在培养90 d后观察到PE-LD膜的失重率为35%。2018年,Ndahebwa等[15]从丹多拉垃圾场筛选出一些PE降解真菌,在以PE-LD为唯一碳源生长16周后通过FTIR分析显示,由于碳氢化合物降解,出现了新的官能团。总体分析证实,真菌比细菌能更好地降解PE,真菌使PE-LD平均质量损失了(36.4±5.53)%。实验还通过调节培养温度以寻找降解实验的最佳条件。2020年,Zhang等[29]从蜡螟Galleria mellonella的肠道中分离到一株具有降解PE潜力的真菌,经基因鉴定为黄曲霉并命名为黄曲霉PEDX3。在以PE-HD为唯一碳源培养28 d后的结果表明,PE-HD的分子量降低;FTIR分析证实了羰基和醚基的出现;最后通过逆转录聚合酶链反应(RT-PCR)对潜在降解酶进行研究发现:2个漆酶样多铜氧化酶(LMCOs)基因AFLA-006190和AFLA-053930在降解过程中表达上调,推测其可能作为关键酶参与到PE的降解过程中。
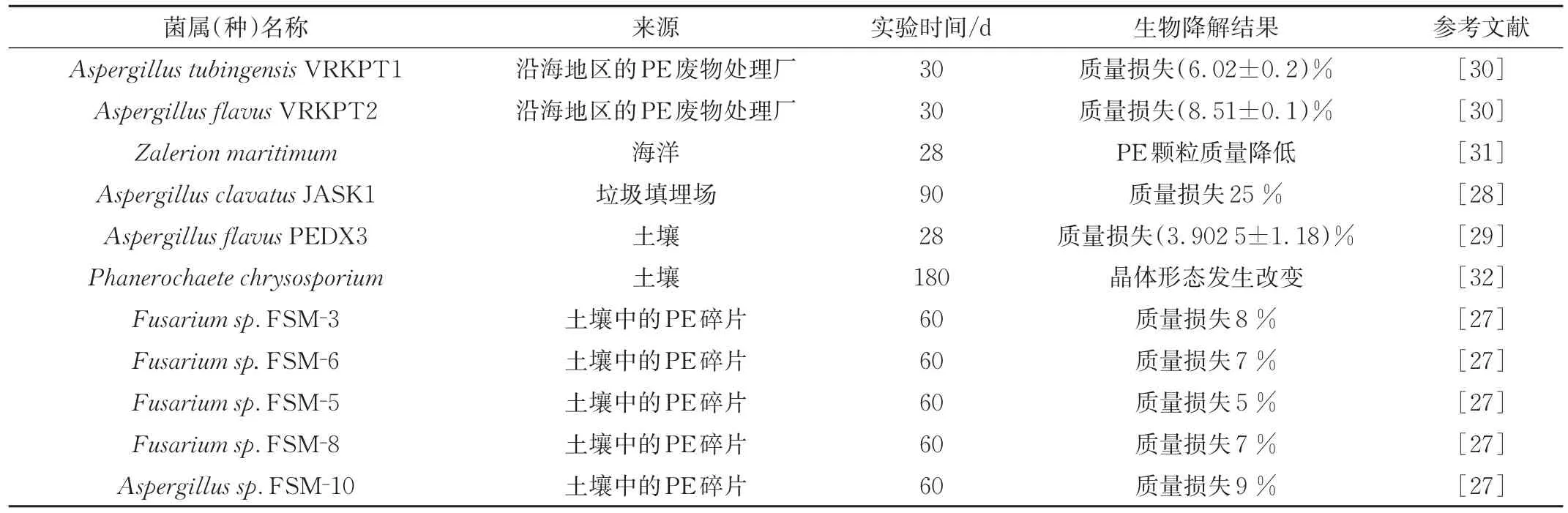
表2 参与PE塑料生物降解的真菌菌株Tab.2 Fungal strains involved in the biodegradation of polyethylene plastics
1.3 参与PE塑料微生物降解的放线菌菌株
据报道,现在筛选出的能够降解PE的放线菌包括链霉菌属、诺卡氏菌属和红球菌属3个菌属[33-34]。Esperanza等[34]从蚯蚓肠道中分离出能够降解PE的放线菌,实验结果显示,从蚯蚓肠道分离的放线菌群能够在4周内显著减小低密度聚乙烯微塑料(PE-LD-MP)的大小,而且在放线菌以PE-LD-MP为唯一碳源的土壤中检测出一些长链烷烃聚合物,其中包括十八烷、二十烷等,因为它们在含有PE-LD-MP的无菌土壤中未被检测到,所以烷烃的形成可视为PE-LD-MP长碳链断裂的产物。土壤中的放线菌资源丰富且放线菌与人类的关系极其密切,绝大数属有益菌,其次级代谢产物作为药物来源对人类的健康做出巨大贡献。然而目前关于放线菌降解PE的文献报道较少,笔者认为放线菌的筛选应该引起研究人员的关注,特别是关于放线菌降解PE过程中次级代谢产物的研究,推动废旧PE资源化利用的发展。
综上所述,目前的生物降解研究中大部分以纯菌种为研究对象,但是微生物作为一个完整的生态系统是不会单独作用于PE材料的。微生物之间是存在着各种关系的,包括互生、共生、寄生等,在土壤微生物中,互生关系就十分普遍[35]。虽然在Han等[36]的研究中发现,与单一菌种相比使用Arthrobacter sp.和Streptomyces sp.的混合菌群共同形成了更厚更复杂的生物膜,这也促进了更高的PE矿化率,但是对混合菌群提高降解率的协同机制没有进行深入研究。笔者认为多菌种联合降解中协同机制的研究有助于人们了解自然环境下各个菌种在PE生物降解过程中扮演的角色,以此建立“人工生态系统”对废旧PE进行高效降解,为以后废旧塑料生物降解的工厂化提供理论依据。而且在以后的研究中进行多菌种联合降解及其协同机制的探究可以作为提高PE生物降解率的突破口之一。
随着科学技术的发展,PE生物降解的研究重心从宏观上物理化学的变化逐渐偏移到微观上降解酶和降解机理的研究,尤其是高通量测序和代谢组学分析的利用在生物降解机理的研究中发挥了重要作用,在这段发展过程中研究者也发现PE生物降解的本质是酶的降解,所以寻找PE生物降解过程中的关键酶及其基因调控机制的研究在未来的生物降解研究中是极为重要的。
2 PE降解的表征方法
根据文献报道,目前研究者们通过对降解前后聚合物物理和化学性质的变化来评价各降解菌的降解效率,这些物理和化学性质的变化主要体现在7个方面:表面官能团、亲水性/疏水性、结晶度、分子量、表面形貌、力学性能和质量损失[8]。以下将对目前使用各种表征仪器所出现的问题进行分析。
2.1 FTIR
FTIR用于研究微生物降解导致的非生物和生物氧化后PE表面各种官能团的形成。PE表面的这些官能团被认为是重要的,因为氧化基团导致亲水性增加,进而导致微生物有效附着在PE表面,从而促进生物降解[29]。
2.2 测量表面与水的接触角
细菌产生的生物表面活性剂是生物降解实验和PE降解的关键因素。生物表面活性剂分子的分泌降低了表面张力,使微生物易于附着在PE表面[9],这是微生物降解PE的前提条件。PE表面张力的变化通常通过测量表面与水的接触角来估算,与水的小接触角表明降解后PE表面的高亲水性。
2.3 SEM
SEM可以很直观地向研究者展示降解菌对PE膜/颗粒表面的侵蚀情或者降解菌是否定殖在PE表面,但是要保证样品在处理中保持无损状态,处理后要保持清洁状态,避免外界因素对样品造成损伤影响实验的真实性。
2.4 质量损失
检测生物降解能力最简单的方法就是使用足够灵敏的天平测量质量损失。但是处理样品的过程中会导致PE材料质量的损失,尤其是PE颗粒在回收的过程中极其容易丢失,所以会造成较大的偏差。近年来,大部分研究者还以CO2生成量来计算生物降解所产生的失重,这也可以作为以后PE生物降解中不可或缺的表征手段之一。
还有一些研究者利用同位素示踪法来跟踪生物降解从开始到最终产物的生成即:CO2和微生物中的碳,以此更好地研究降解菌的降解机理和计算降解速率。还有通过测定降解过程中降解菌的浓度从而制作降解菌生长曲线,用来表示降解菌以PE材料为唯一碳源的生长情况,也可作为是否降解PE的依据。利用气相和液相色谱与质谱联用的方法对PE生物降解后的代谢产物进行分析也可以作为一种表征手段。作者认为上述的表征技术对于PE的生物降解都是相互佐证的,研究中不能单独以某一技术作为生物降解的证据,如CO2生成量的测定,在PE的生物降解过程中,首先降解菌分泌胞外酶将长链PE切割成各种不同的中间产物,而降解菌只能吸收一些能穿过细胞壁的小分子中间产物,所以单独测定CO2的生成量是不严谨的。
3 PE微生物降解实验流程的改进与补充
对PE微生物降解实验流程进行如图1所示改进与补充。
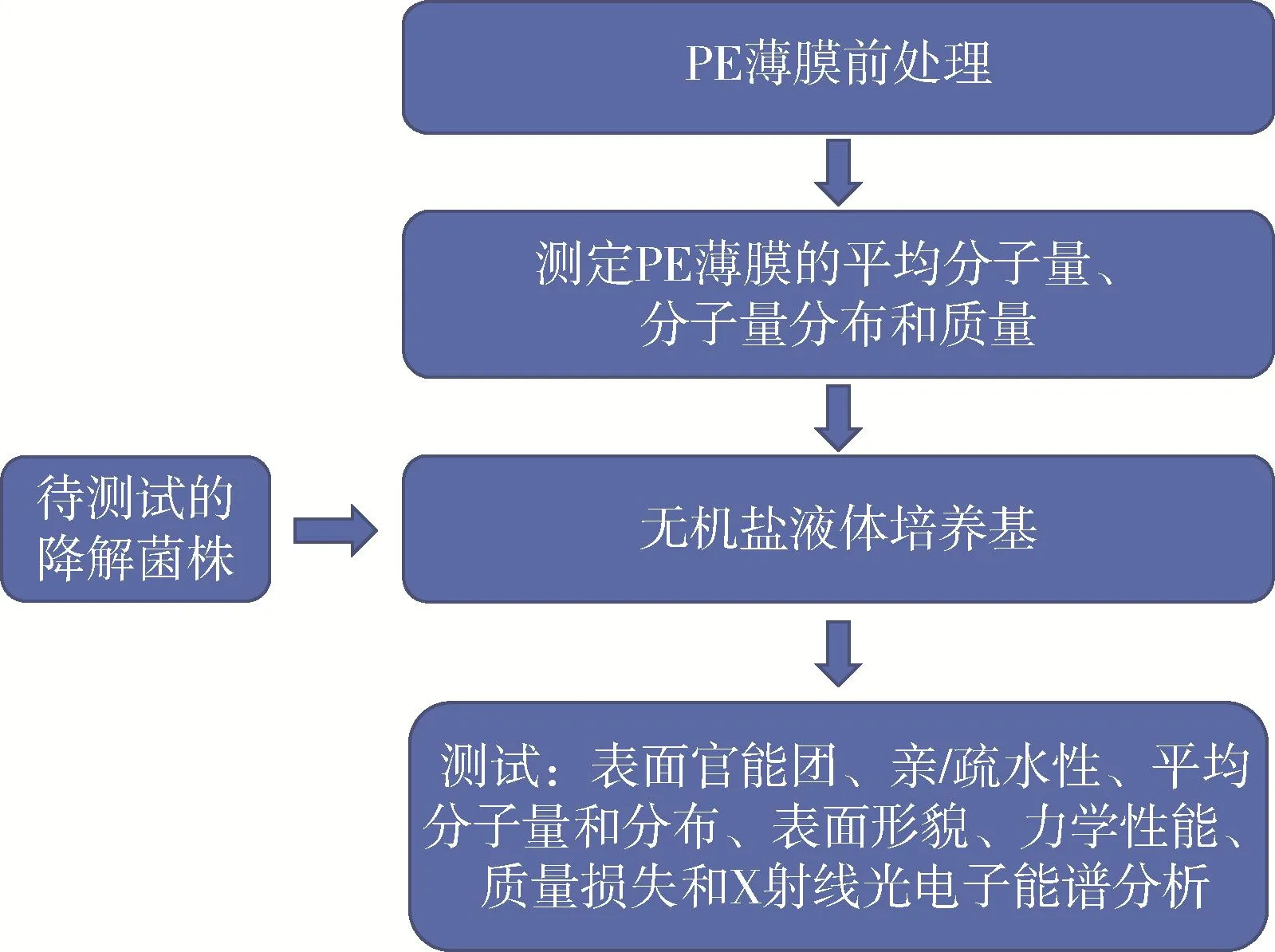
图1 PE微生物降解实验流程的改进与补充Fig.1 Improvement and supplement of polyethylene microbial degradation experimental process
(1)PE膜处理:现在工业生产的PE塑料大部分有各种添加剂以便于达到各种用途,包括抗菌剂、抗氧化剂、增塑剂等[37]。这些添加剂都会干扰研究者对降解菌降解效果的判断,这就是造成降解效率无法进行比较的首要问题。为避免这些问题出现,实验中使用的PE膜应购买纯PE膜或利用湿膜涂布器在实验室制得的纯PE膜。
(2)测定PE膜平均分子量、分子量分布和质量:利用凝胶渗透色谱测定PE膜在被微生物降解前后的分子量分布和平均分子量的变化,可以判断PE被微生物降解后,是否发生了长链的解聚[7]。这应该作为不可或缺的佐证来证明PE塑料降解之后的质量损失或者产生的CO2是否是来自PE塑料高分子长链的解聚和降解[38]。这些工作必须在降解前后立即进行。
(3)培养基选择:作为降解测试的培养基应提供菌种所需除碳源外的所有营养物质,以确保PE膜提供唯一碳源,所以选择无机盐培养基便于以后的表征测试。
(4)降解后的表征测定:这些测定可以参照第二章内容进行;此外还应采用X射线光电子能谱(XPS)检测降解前后是否被引入了氧元素,氧元素的进入是降解开始的重要标志;由于在无机盐培养基中测试菌种都是附着于PE膜片上的,所以采用紫外分光光度计测定菌种浓度以绘制降解菌的生长曲线是不准确的,可以在试验一段时间后采用扫描电子显微镜(SEM)观察没经过清洗的PE膜表面菌种定殖和生长情况。
4 结语
从微生物角度出发,目前研究者已经从各种生态环境中筛选出大量的降解菌,但是大多数研究中菌株被单独作用于PE材料,研究者们忽略了整个生态系统中的每个个体是相互关联的,微生物间的生态相互作用在PE降解过程中也是非常重要的。在自然环境中,对于PE的生物降解菌群之间必然存在协同过程,未来研究中应该多留意降解菌之间的互生和共生关系,采用多菌种联合降解的方式,以提高目前整体的降解水平。
从降解实验过程出发,大量的降解菌被发现,但是由于研究者们对影响降解菌生物降解因素的忽略,如,在文献报道中各种用于测试降解菌生物降解能力的PE材料被研究者使用,有时会导致筛选出只是利用PE材料中添加剂的假阳性降解表型的菌株。所以建议在做降解菌能力测试的时候采用一种简单可靠的实验流程,以便于各研究者对筛选出的降解菌在降解能力上进行比较。未来的研究中也可以真正了解到目前发现或者改性的降解菌整体的降解水平,为降解菌的高效性定义上提供了数据支持,对进一步推动降解能力水平的提高来说意义重大。
还有一点容易忽视的是,PE降解菌在降解之后的代谢产物是否对环境具有危害性,研究者从毒理学的角度分析生物降解后的代谢产物是极其重要的,目前的研究中这一问题还未得到研究者的重视,在以后的研究中还应将筛选出来的PE降解菌返还到土壤、水池等自然环境中,测试各种指标以检测其对农作物、鱼类等有无危害。
在未来的研究中,还可以通过对已知降解菌的改性或者对实验条件的优化两个方面来提高降解水平。一是改性,可以从分子水平研究降解机理,确定关键功能基因或者蛋白质,再利用基因工程的相关技术构建高效的降解微生物;二是通过将实验条件(pH、温度、培养时间、多菌种联合等)作为变量做正交实验,探究微生物生物降解的最佳条件,以达到提高生物降解水平的目的。
