亚甲蓝对体外不同细菌培养结果的影响△
2022-03-25陈继营郝立波
刘 侃,陈继营*,郝立波
(1.北京中医药大学第三附属医院骨科,北京 100029;2.中国人民解放军总医院骨科,北京 100853)
关节假体周围感染(periprosthetic joint infection,PJI)是人工关节置换术后灾难性的并发症[1],在全膝和全髋关节置换术后的发生率约为1%~2%[2,3]。在PJI领域,假体表面细菌生物膜的形成是一个特别值得关注的问题。一旦生物膜在假体表面形成,感染的诊治相对来说就会比较棘手。迄今为止,在骨科手术中仍无简单可靠的术中生物膜识别方法[4]。菌斑染色剂是应用于口腔科的染料,用以鉴别生物膜,以便显示牙齿或假牙的卫生情况[5,6]。近些年,也有文献报道菌斑染色剂可能会在骨科手术中迅速地识别生物膜[7~9]。为了有效地在术中使用,染色剂不仅需要对植入物上的生物膜进行染色,而且不能影响细菌的培养结果。
亚甲蓝(methylene blue,MB)是一种阳离子染料,已被证实有结合和染色灭活的真核细胞以及细菌生物膜的能力[10]。这种染料的渗透可以使伤口深层的组织染色,而大多数感染的和无活力的组织往往都存在于此[11]。一项体外实验中MB被证实可以在骨科植入物上结合和染色表皮葡萄球菌的生物膜,而且稀释后的MB不会对微生物的活性产生实质性的影响[8]。因此,有学者认为采用这种方法进行关节清创术可以成功地清除所有失活的组织和存在生物膜的区域,并且通过染色组织的培养可以提高病原的检出率[7]。然而,MB的使用是否会和其他生物膜染色剂一样有抑菌作用,目前文献报道尚少且未有定论。因此,作者设计了一项体外研究来模拟临床上假体周围组织暴露于不同浓度MB注射液时的细菌培养情况,为PJI翻修清创过程中使用MB是否会影响培养结果提供理论依据。
1 材料与方法
1.1 实验菌株
8种美国标准菌库(American Type Culture Collection,Manassas,VA,ATCC)标准菌株种,与本团队前期发表论文所用相同[12,13],包括金黄色葡萄球菌(staphylococcus aureus,SAU)(ATCC 25923)、表皮葡萄 球 菌 (staphylococcus epidermidis,SEP)(ATCC 14990)、人葡萄球菌(staphylococcus hominis,SHO)(ATCC 27844)、大肠杆菌 (escherichia coli,ECO)(ATCC 11775)、肺炎克雷伯菌(klebsiella pneumoniae,KPN)(ATCC 13883)、鲍曼不动杆菌(acinetobacter baumannii,ABA)(ATCC 19606)、化脓链球菌(streptococcus pyogenes,SPY)(ATCC 12344)及白色念珠菌(candida albicans,CAL)(ATCC 90028)。由解放军总医院微生物科提供。
1.2 细菌培养和干预分组
将上述8种ATCC标准菌株分别配置成菌悬液后分为0.1%MB组、0.05%MB组和生理盐水组,分别添加0.1%MB、0.05%MB和0.45%无菌盐水,每组分别接种于M-H培养基(SPY接种于羊血培养基)中进行培养,24 h后以菌落形成单位(colony-forming unit,CFU)来计算细菌数量(CFU/ml)。1%亚甲蓝注射液由解放总医院骨科提供;0.45%无菌生理盐水、M-H琼脂平板培养基、5%羊血琼脂平板培养基、血琼脂平板培养基、中国蓝琼脂平板培养基、沙氏琼脂平板培养基由解放军总医院微生物科提供。
1.2.1 标准菌株的传代培养
方法同本团队前期发表论文[12,13],将标准菌株SAU、SEP、SHO、SPY接种于血琼脂平板培养基,ECO、KPN、ABA接种于中国蓝琼脂平板培养基,CAL接种于沙氏培养基,均进行隔夜传代培养。
1.2.2 菌悬液的配置
在添加0.1%MB或0.05%MB注射液之前需要配置合适的菌悬液浓度。菌悬液配置方法同本团队前期发表论文[12,13],应用一次性采样拭子采集完成传代培养的标准菌株菌落,通过比浊仪配置成标准菌悬液浓度[0.5麦氏标准(1.5×108CFU/ml)],分别稀释10、25、50倍和100倍,用一次性无菌定量接种环(10 μl)将稀释完成的4种浓度的菌悬液分别接种于M-H琼脂平板培养基,均匀涂布,在35℃培养箱进行24 h培养(SPY接种于5%羊血琼脂平板培养基并置于CO2环境中培养)。通过菌落计数,评估确定最适合该实验的菌悬液浓度,最终结果为稀释50倍的浓度(3Í106CFU/ml)。
1.2.3 细菌的分组与接种培养
将8种标准菌株菌悬液均配置成3×106CFU/ml的浓度,分为0.1%MB组、0.05%MB组和生理盐水组,分别为 0.1%MB 注射液 100 μl+菌悬液 600 μl,为 0.05%MB 注射液 100 μl+菌悬液 600 μl,以及0.45%无菌盐水 100 μl+菌悬液600 μl。各自在一次性悬浮液管中混匀1 min,后用一次性无菌定量接种环(10 μl)将混悬液接种于M-H琼脂平板培养基,均匀涂布,在35℃培养箱进行24 h培养(SPY接种于5%羊血琼脂平板培养基并置于CO2环境中培养)[12,13]。每种混悬液均在5个平板培养基上培养。
1.3 细菌培养结果评估
24 h培养结束后,2名研究人员分别计数两组平板培养基上生长的菌落数,乘以100,算出每毫升的菌落数,结果取平均值[12,13]。
1.4 统计学方法
采用SPSS 26.0软件对数据进行统计分析。计量数据以±s表示,组间比较采用单因素方差分析,两两比较采用SNK检验。MB浓度与菌落计数结果行Spearman相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 平板培养基上的菌落计数结果
三组平板培养基上的菌落计数结果见表1。人葡萄球菌(SHO)的菌落计数由低至高依次为0.1%MB组<0.05%MB组<盐水组,差异有统计学意义(P<0.05);鲍曼不动杆菌(ABA)的菌落计数由低至高依次为0.1%MB组<0.05%MB组<盐水组,差异有统计学意义(P<0.05)。而金黄色葡萄球菌(SAU)、表皮葡萄球菌(SEP)、大肠杆菌(ECO)、肺炎克雷伯菌(KPN)、化脓链球菌(SPY)和白色念珠菌(CAL)的菌落计数三组间差异均无统计学意义(P>0.05)。
表1 三组平板培养基上不同菌株培养菌落计数(n=5,±s,×104CFU/ml)与比较
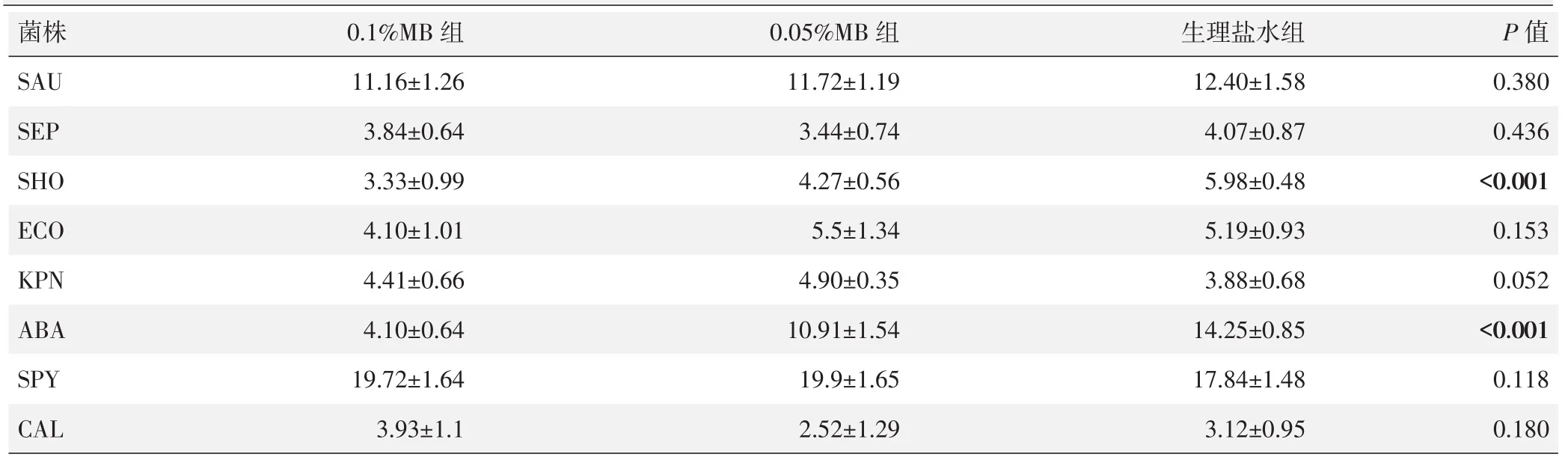
表1 三组平板培养基上不同菌株培养菌落计数(n=5,±s,×104CFU/ml)与比较
菌株S A U S E P S H O E C O K P N A B A S P Y C A L 0.1%M B组1 1.1 6±1.2 6 3.8 4±0.6 4 3.3 3±0.9 9 4.1 0±1.0 1 4.4 1±0.6 6 4.1 0±0.6 4 1 9.7 2±1.6 4 3.9 3±1.1 0.0 5%M B组1 1.7 2±1.1 9 3.4 4±0.7 4 4.2 7±0.5 6 5.5±1.3 4 4.9 0±0.3 5 1 0.9 1±1.5 4 1 9.9±1.6 5 2.5 2±1.2 9生理盐水组1 2.4 0±1.5 8 4.0 7±0.8 7 5.9 8±0.4 8 5.1 9±0.9 3 3.8 8±0.6 8 1 4.2 5±0.8 5 1 7.8 4±1.4 8 3.1 2±0.9 5 P值0.3 8 0 0.4 3 6<0.0 0 1 0.1 5 3 0.0 5 2<0.0 0 1 0.1 1 8 0.1 8 0
2.2 MB浓度与菌落计数结果的Spearman相关分析
MB浓度与菌落计数结果的Spearman相关分析结果见表2,MB浓度与人葡萄球菌(SHO)菌株菌落计数呈显著负相关(P<0.05);MB浓度与鲍曼不动杆菌(ABA)菌株菌落计数呈显著负相关(P<0.05)。MB浓度与金黄色葡萄球菌(SAU)、表皮葡萄球菌(SEP)、大肠杆菌(ECO)、肺炎克雷伯菌(KPN)、化脓链球菌(SPY)和白色念珠菌(CAL)的菌落计数无相关性(P>0.05)。
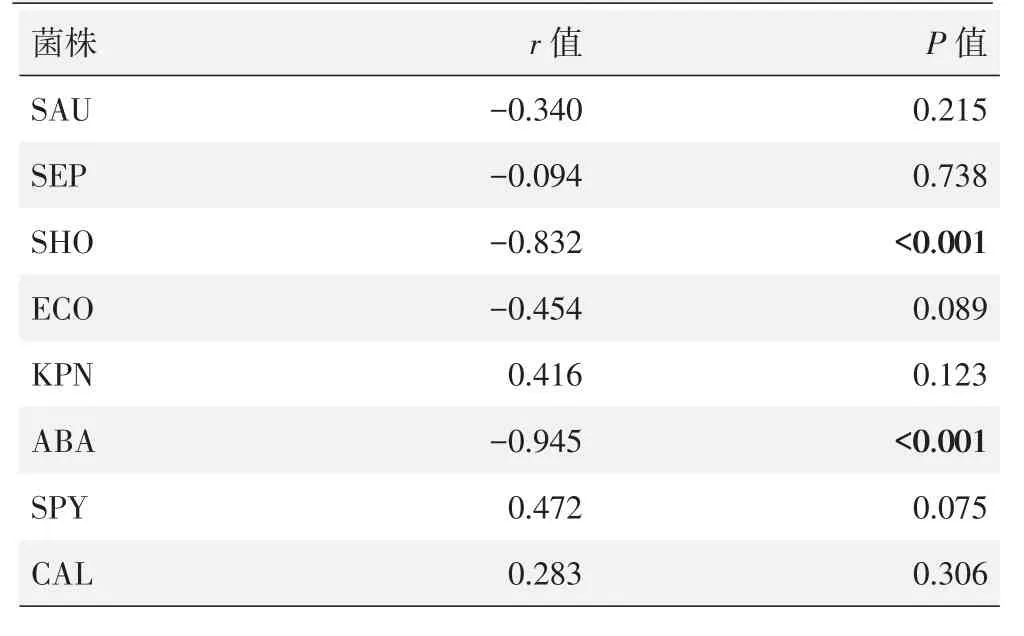
表2 MB浓度与不同菌株菌落计数的Spearman相关分析结果
3 讨论
准确的病原学诊断、彻底清除感染坏死的组织及有效的抗感染方案是治疗PJI的关键[14~17]。然而,清创术中假体周围感染组织是否彻底清除,很大程度上依赖于外科医生的经验[11,18,19],这主要归因于目前在骨科应用中没有可视化细菌生物膜的验证技术[4]。传统的生物膜染色剂,诸如番红、结晶紫、伊红和赤藓红等都因有大量的抑菌活性而使用受限。在骨科手术领域,MB可用于标记深筋膜层切口以便术毕的缝合、添加于骨水泥中以便翻修过程中的识别以及应用于创伤性的关节切开术[20~22]。同时MB作为一种单胺氧化酶抑制剂还可半选择性地染色细菌生物膜[23]。最新的一项体外研究表明,MB是金黄色葡萄球菌和绿脓杆菌生物膜的有效染色剂,其对大多数健康的组织无染色作用。因此,MB可协助外科医生识别生物膜以提高清创术的疗效[24]。然而,本研究最重要的发现是,在体外培养条件下SHO和ABA的菌落计数由低至高依次为0.1%MB组<0.05%MB组<盐水组,差异有统计学意义。MB的浓度与SHO和ABA的菌落计数呈显著负相关。说明MB对SHO和ABA具有剂量依赖性抑菌作用,而MB对其他6个菌株无明显作用。虽然本研究采用的是标准菌株,且只有8种,但同样也证实了MB的某些抑菌特性,因此,作者有理由相信MB可能会对细菌培养阳性结果产生一定的影响。
对于MB是否有抑菌作用,一些学者也做了相关的研究,Silva等[6]对比了各种染色剂的可着色性和抑菌性能,包括0.05%亚甲蓝、4%赤藓红和1%中性红,最后发现0.05%的亚甲蓝有最好的染色性能和最小的抑菌效应。Parry等[8]发现24 h培养之后,聚甲基丙烯酸甲酯盘上细菌的密度并不受0.05%MB的影响。因此作者认为稀释的MB溶液仅有有限的抑菌特性。另一项研究证明,0.1%亚甲蓝溶液可以染色慢性感染的组织,并且通过定量培养和定量PCR分析发现染色组织中细菌的菌落数量较未染色组织更多[7]。作者认为MB对某些PJI重要致病菌可能具有抑菌作用[7,8],作者将8种ATCC标准菌株配置成菌液来进行定量细菌培养,并且分别采用了两种浓度的MB来进行实验,避免了不同浓度可能带来的差异。
本研究的局限性在于实验过程中并没有保护标本免受光照,这可能会增加MB的抑菌作用,导致培养阴性的结果。但是8种ATCC菌悬液的浓度远远超过正常感染情况下菌株的浓度,并且所有的培养孵化过程均在密闭不透光的恒温培养箱中进行,另外术中实际应用MB注射液时也无法完全避光进行操作,因此作者相信这个局限性不会对实验的结果产生实质的影响。综上所述,MB对体外鲍曼不动杆菌和人葡萄球菌的培养会产生抑制作用。鉴于此,MB能否作为清创术中简单和安全的辅助技术仍需进一步的验证和研究。
