低共熔溶剂提取灵芝多糖的工艺优化及抗氧化活性研究
2022-03-24谢苗亓小妮张鑫刘养山张景杜秀菊
谢苗,亓小妮,张鑫,刘养山,张景,杜秀菊
(聊城大学生命科学学院,山东 聊城 252059)
灵芝(Ganoderma lucidum)即灵芝子实体,是药食两用真菌,在中国药典中历史悠久,被历代医药世家视为滋补强身、扶正固本的草本植物[1]。灵芝富含灵芝多糖、灵芝酸(主要为三萜类)、腺苷、甾醇、生物碱等多种有效成分[2],具有提高机体免疫力、抗衰老、抗肿瘤、助眠等功效。
以水煎服中草药即主要摄取其中的多糖成分,传统的灵芝多糖的提取方法为热水浸提法,但是其耗能耗时且得率不高,而酸碱提取有可能会破坏多糖结构,超声、微波辅助提取等则需要借助专业的仪器且不利于大规模提取[3]。在天然产物提取的过程中,绿色化学概念盛行,然而一些离子试剂虽应用效果好,但是价格昂贵,不利于普遍应用。因此,寻求价廉、高效、环保且实用性强的方法对提取天然活性成分具有重大意义,发展前景广阔。
低共熔溶剂(deeep eutectic solvents,DESs),是一种由氢键受体和氢键供体形成的离子复合物溶液,具有价格低廉、易获取、易合成、绿色环保可降解、无毒害、挥发性低等优点[4]。本文选用5种DESs提取灵芝多糖(Ganoderma lucidum polysaccharide,GLP)以筛选出最适合的溶剂并结合Box-Behnken中心组合试验优化提取方式,对最优DESs-5即氯化胆碱-尿素(choline chloride-Urea,ChCl-Urea)试剂提取的灵芝多糖(Ganoderma lucidum polysaccharide choline chloride-Urea,GLP-5)和常规水提灵芝多糖(Ganoderma lucidum polysaccharide-W,GLP-W)进行得率及抗氧化活性比较。本试验为灵芝多糖的提取探索一条绿色且高效的道路,为灵芝多糖的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
灵芝子实体粉:山东省聊城市冠县博益德灵芝有限公司;甜菜碱、1,3-丁二醇、1,4-丁二醇、甘油、氯化胆碱、尿素(均为分析纯):天津市光复精细化工研究所;无水乙醇、浓硫酸、苯酚、磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯化铁、三氯乙酸、硫酸亚铁、30%过氧化氢、水杨酸(均为分析纯):天津市风船化学试剂科技有限公司;DPPH、抗坏血酸(VC)(均为分析纯):北京索莱宝科技有限公司。
1.2 仪器与设备
磁力加热搅拌器(78-1):江苏省金坛市荣华仪器制造有限公司;电热恒温水浴锅(HHS)、电热恒温培养箱(HPX-9052MBE):上海博迅实业有限公司医疗设备厂;离心机(Sorvall Stratos):德国 Thermo Fisher公司;旋转蒸发仪(RE-2000B):上海亚荣生化仪器厂;可见分光光度计(WF-J2100):上海佑科仪器仪表有限公司;冷冻干燥机(DC801):重庆雅马拓科技有限公司。
1.3 方法
1.3.1 材料预处理
灵芝子实体粉烘干至恒重,按照液料比为20∶1(mL/g)的比例加入95%乙醇浸泡24 h,以除去脂类及小分子杂质,重复两次,离心得滤渣烘干备用。
1.3.2 DESs试剂的制备
将所需试剂提前干燥后按照氢键供体与氢键受体以合适的摩尔比称量,然后混合置于80℃电热恒温水浴锅内加热至大部分试剂熔化[5],再转移至磁力加热搅拌器上不断搅拌获得均一液体,即为低共熔溶剂。不同DESs溶剂的合成及摩尔比见表1。

表1 不同DESs溶剂的合成及摩尔比Table 1 Synthesis and molar ratios of different DESs solvents
1.3.3 灵芝多糖的提取
根据熊苏慧等[7]的方法提取多糖,略有改动。称取1 g预处理后的灵芝子实体粉,按照一定的料液比与DESs溶剂搅拌均匀,置于合适的条件下进行提取,离心(7 656×g,20 min)、抽滤、定容、醇沉得沉淀物加蒸馏水溶解,依照苯酚-硫酸法[11]测定多糖得率。DESs-1、DESs-2、DESs-3、DESs-4 和 DESs-5 试剂所对应的多糖分别命名为GLP-1、GLP-2、GLP-3、GLP-4和GLP-5。
1.3.4 单因素试验
按照1.3.3中低共熔溶剂法提取灵芝多糖的方法,以多糖得率为指标,固定其它条件,分别考察提取时间(0.5、1.0、1.5、2.0、2.5 h),醇沉时间(2.0、6.0、12.0、18.0、24.0 h),DESs-5 含量 (10.0%、30.0%、50.0%、70.0%、90.0%)3个单因素对灵芝多糖得率的影响。
1.3.5 响应面试验
依据单因素试验结果,运用Design-Expert 8.0.6软件进行Box-Behnken中心组合试验,采用三因素三水平(A DESs-5含量、B提取时间、C醇沉时间)进行响应面试验设计,考察多糖得率变化,因素水平设计见表2。
1.3.6 抗氧化试验
DPPH自由基清除能力的测定根据Du等[12]和吴杨洋等[13]的方法进行测定;羟基自由基清除试验根据田淑雨等[14]的方法进行测定;还原力测定根据鹿士峰等[15]的方法进行测定。略有改动。

表2 响应面设计因素与水平Table 2 Factors and levels in response surface design
1.3.7 统计分析
所有的试验均重复3次取平均值,使用IBM SPSS Statistics 21和Design Expert 8.0.6软件对数据进行统计分析。
2 结果与分析
2.1 DESs试剂筛选结果
不同DESs溶剂对灵芝多糖得率的影响见图1,不同多糖的羟基自由基清除率见图2。

图1 不同DESs溶剂对灵芝多糖得率的影响Fig.1 The effects of different DESs solvents on yield of GLP

图2 不同多糖的羟基自由基清除率Fig.2 The hydroxyl radical scavenging rate of polysaccharides of different polysaccharides
由图1和图2可知,在5种DESs试剂中GLP-5得率最高且清除羟基自由基能力尤为显著,因此选定DESs-5作为最适合的低共熔溶剂提取灵芝多糖并进行工艺优化。
2.2 单因素试验
不同因素对GLP-5得率的影响见图3。
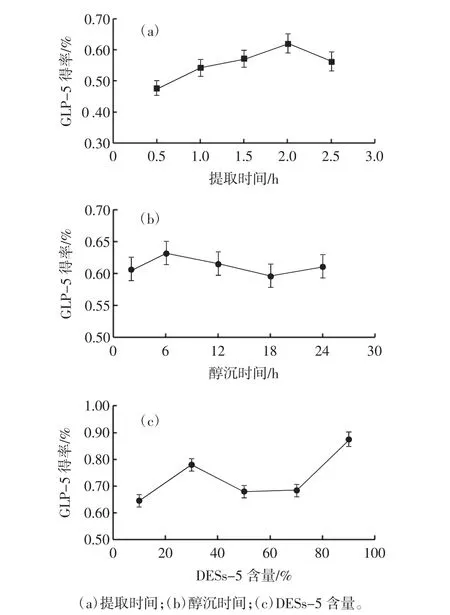
由图3(a)可知,在1.5 h~2.0 hGLP-5得率随着提取时间的延长先升高后降低,在2 h时GLP-5得率最高。这可能是由于前期随着时间的延长,多糖不断渗入提取液,致使得率增加[16],而到达一定时间多糖的得率最高,时间再加长反而会破坏多糖成分。因此,本试验选定提取时间1.5、2 h和2.5 h进行响应面试验。
如图3(b)所示,在2 h~6 hGLP-5得率随着醇沉时间的延长而增加,但在6 h~18 h,GLP-5得率不断下降,这可能是醇沉时间过长致使部分多糖失活[17]。本试验选择2.0、6.0 h和12.0 h进行响应面试验。
由于DESs试剂是由两种及两种以上的有机物混匀熔化而得,通常试剂的内部离子力较强且黏度较大[18],所以在使用过程中一般会加入一定比例的蒸馏水来降低溶液的剪切力。如图3(c)所示,30%的DESs-5更利于GLP-5提取,90%的DESs-5提取并抽滤之后静置会出现沉淀现象,会对后续醇沉造成影响,所以选择10.0%、30.0%、50.0%进行响应面试验。
2.3 响应面试验
2.3.1 响应面试验设计与结果
在DESs-5提取灵芝多糖(GLP-5)的过程中,以A DESs-5含量、B提取时间、C醇沉时间为影响因素,多糖得率作为响应值。试验设计与结果见表3。

表3 响应面试验设计与结果Table 3 The designs and results of Box-Behnken test
2.3.2 模型建立与方差分析
采用响应面分析软件,对表3数据进行回归拟合和显著性分析,结果见表4。

表4 方差分析结果Table 4 The regression model of variance analysis results
根据表4可得拟合回归方程为Y=0.99+0.083A-0.005 515B+0.034C+0.046AB+0.023AC+0.008 603BC-0.17A2-0.13B2-0.099C2。模型差异极显著(P=0.000 1<0.001),失拟项不显著(P=0.199 2>0.05),这表明模型的拟合度极好;模型R2=0.972 3,表明模型与实际试验拟合度较好;模型校正系数R2Adj=0.936 7,表明该模型可以解释93.67%响应值的变化,能够用该模型对灵芝子实体多糖得率进行分析和预测。C.V.%=4.54%<10%,表明试验可信度和精确度高。
模型一次项A(P=0.000 4)、二次项A2(P<0.000 1)、B2(P=0.000 1)达到极显著(P<0.01)的水平,一次项C(P=0.031 8)、二次项AB(P=0.0374)、C2(P=0.001 1)达到显著水平。
2.3.3 响应面分析
不同因素对GLP-5得率的响应面图见图4。

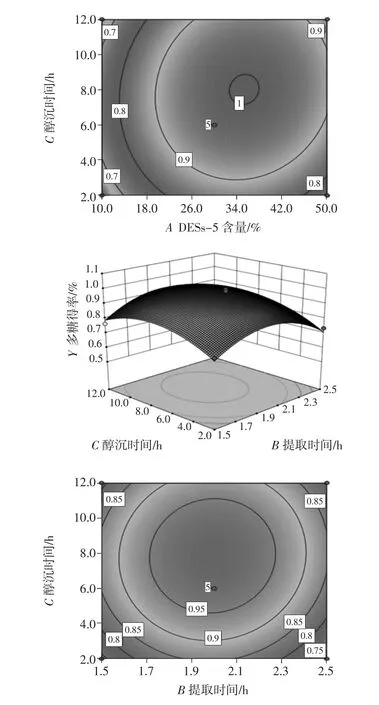
图4 不同因素交互作用对GLP提取得率的影响Fig.4 The effects of different factors interaction on the extraction yield of GLP
由图 4可知,DESs-5含量(A)和提取时间(B)的交互作用的响应面曲线最陡,说明DESs-5含量和提取时间之间二次交互对灵芝多糖得率的影响最为显著[19];DESs-5含量(A)和醇沉时间(C)曲面陡峭程度次之,提取时间(B)和醇沉时间(C)曲面陡峭程度最弱;由等高线同样可以看出,DESs-5含量(A)和提取时间(B)交互作用最显著,提取时间(B)和醇沉时间(C)之间的交互作用最小[20]。结果表明,因素间交互作用对灵芝多糖得率的影响顺序为AB>AC>BC。此外,根据F值大小可以判断各单因素对灵芝多糖提取的显著性排序:A>C>B,即DESs-5含量>醇沉时间>提取时间。
2.3.4 响应面模型预测值验证
通过回归模型的分析,获得GLP-5最佳提取工艺条件为DESs-5含量34.22%,提取时间1.91 h,醇沉时间7.26 h,灵芝多糖的预测提取得率为1.00%。为检验结果的可靠性,根据上面优化条件,同时为了方便实际操作,重新调整提取时间1.9 h,DESs-5含量34%和醇沉时间7.3 h,实际提取得率为1.10%,与理论值误差为0.10%。
采用水作为提取试剂,其他条件与GLP-5的提取条件保持一致,即常规热水浸提法获得的灵芝多糖GLP-W(得率0.60%)相比,采用该方法提取的灵芝多糖GLP-5得率提高了83.33%。
2.4 抗氧化结果分析
2.4.1 DPPH自由基清除率
不同多糖的DPPH自由基清除率见图5。

图5 不同多糖的DPPH自由基清除率Fig.5 The DPPH radical scavenging rate of polysaccharides of different polysaccharides
由图5可知,在样品浓度为2 mg/mL时GLP-5的清除率为59.37%,与GLP-W(49.27%)相比DPPH自由基的清除率提高了20.50%。该数据表明DESs-5提取的GLP-5的DPPH自由基清除活性较强,且随着浓度的增加DPPH自由基清除活性也不断提高。
2.4.2 羟基自由基清除率
不同多糖的羟基自由基清除率见图6。

图6 不同多糖的羟自由基清除率Fig.6 The hydroxyl radical scavenging rate of polysaccharides of different polysaccharides
由图6可知,羟基自由基的清除率高低顺序为GLP-W>GLP-5,这表明常规热水浸提获得的多糖清除羟基自由基能力比以氯化胆碱-尿素为低共熔溶剂提取的多糖能力强。此外,羟基自由基的清除率随样品浓度的增加而提高,说明两者呈明显的量效关系。
2.4.3 还原力的测定
不同多糖的还原力见图7。

图7 不同多糖的还原力Fig.7 The reducing power scavenging activity of polysaccharides of different polysaccharides
由图7得知,还原力高低顺序为:GLP-5>GLP-W,在样品浓度为2 mg/mL时GLP-5的还原力与GLP-W相比提高了47.47%。结果表明,DESs-5提取的多糖在还原力方面优于水提多糖,而且还原力随GLP-5浓度的增加而增加,表明两者呈正相关关系。
3 结论
本文对比了5种DESs溶剂结果表明,氯化胆碱-尿素提取多糖得率较高且羟基自由基的清除能力最好。进行响应面试验得到GLP-5的最优提取工艺为DESs-5含量34%,提取时间1.9 h,醇沉时间7.3 h,灵芝多糖的提取得率1.10%,比常规热水浸提法提高了83.33%。抗氧化试验表明:GLP-5具有一定的抗氧化活性,且呈剂量活性相关性。GLP-5的DPPH自由基清除率和还原力均优于GLP-W,分别提高了20.50%和47.47%。DESs与其他离子试剂相比较,不仅价格低廉易制备,而且绿色环保易于回收。
本试验结果表明,采用低共熔溶剂法制备灵芝多糖,不仅提高了提取率,抗氧化活性也有显著提升,值得进一步开发利用。
