基于16SrRNA测序分析两种呼肠孤病毒对小鼠肠道菌群的影响
2022-03-24王诗雨林家锋蒋欣如孙淼王颖陶晓莉
王诗雨林家锋蒋欣如孙淼王颖陶晓莉
(锦州医科大学基础医学院病原生物学教研室,辽宁 锦州 121000)
人类肠道富含多种微生物群落,能够定期监视免疫系统、提供营养物质及抵抗致病物质侵害,拥有极其重要的功能[1-3]。由于个体之间肠道菌群存在差异,且菌群微生态和宿主之间的联系每时每刻都在变化,因此菌群和宿主间的作用机制成为新兴研究的热点[4-5]。一旦有病原微生物感染机体,这种作用机制是否有效、菌群的丰度和多样性是否差异显著、肠道微生态紊乱的过程又是怎样,种种疑问都亟需进一步的解决。
正呼肠孤病毒是一类双链RNA病毒,无囊膜,一般可分为两种亚型:哺乳动物非融合性病毒(MRV)、融合性病毒(NBV、ARV、BroV等)[6-8]。T1L隶属于MRV Lang型,分离自人体肠道及呼吸道,研究表明,经口接种的T1L能够跨越回肠细胞直接攻击肠道微环境,扰乱消化系统正常的免疫功能[9]。NBV为纳尔森海湾病毒,可从人、鸟、牛、羊中分离出来,是一种典型的人兽共患病病毒;它能特异性结合膜受体NgR1,在黏附因子A的作用下释放出病毒颗粒入侵呼吸道和消化道,扰乱宿主体内微生物正常活动[10-11]。本研究通过16SrRNA测序分析NBV和T1L两种正呼肠孤病毒对小鼠肠道菌群的影响,比较不同感染方式对微生物群落及其结构的差异,从肠道微生态的角度为正呼肠孤病毒的防治提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
25只SPF级雄性封闭群KM小鼠,4~5周龄,体重15~18 g,健康状况良好,购于锦州医科大学实验动物中心【SCXK(辽)2019-0003】。动物饲养于锦州医科大学动物实验室【SYXK(辽)2019-0007】,湿度60%,温度25℃,12 h昼夜交替。所有操作均经锦州医科大学实验动物伦理委员会审核(IACUC号:2019014)。
1.1.2 病毒株
NBV、T1L病毒株经空斑滴度测定,病毒浓度为2×107PFU/mL,由锦州医科大学病原生物学实验室-80℃冰箱保存。
1.1.3 主要试剂与仪器
粪便基因组DNA提取试剂盒(中国TIANGEN公司,DP328),无水乙醇(北京化工厂有限公司,20120110),乌拉坦(中国Sigma公司,94300)。
微量分光光度计(Thermo,美国),高通量测序仪(Illumina,美国),分析天平(Mettler Toledo,瑞士),超纯水机(Millipore,德国),-80℃低温冰箱(Thermo,美国)。
1.2 方法
1.2.1 小鼠分组及处理
随机将25只SPF级KM小鼠均分为5个组别,每组5只,每天按照所称量的体重处理,即:对照组(Control组)、NBV滴鼻组(Int-NBV组)、NBV灌胃组(Oral-NBV组)、T1L滴鼻组(Int-T1L组)、T1L灌胃组(Oral-T1L 组)。处理方法:对照组:0.2 mL/10 g PBS灌胃;NBV滴鼻组:0.2 mL/10 g NBV滴鼻;NBV灌胃组:0.2 mL/10 g NBV灌胃;T1L滴鼻组:0.2 mL/10 g T1L滴鼻;T1L灌胃组:0.2 mL/10 g T1L灌胃。连续7 d,期间给予充足的超纯水和小鼠饲料以供自由摄取。
1.2.2 小鼠粪便样品采集
灌毒完成后,次日于超净无菌环境下用20%乌拉坦麻醉小鼠,75%乙醇消毒腹部,腹腔正中解剖,采集小鼠肠道内容物于高压灭菌过的2 mL EP管中,称重标记,迅速置于-80℃里保存。
1.2.3 粪便16SrRNA测序
从每组5个粪便样品中遴选出重量较高的3个样本,分别提取总DNA并测定浓度及纯度。按照引物序列(338F:5’-ACTCCTACGGGAGGCAGCAG-3’;806R:5’-GGACTACHVGGGTWTCTAAT-3’),对 粪便DNA进行V3+V4可变区的特异性扩增且细菌的16SrRNA测序。
1.2.4 数据处理
按照新版Illumina MiSeq和HiSeq处理平台提供的模拟下机数据,经数据拆解、引物切除、PE Reads有效拼接和Tags过滤,OUTs聚类,在FLASH软件下进行质控分析,获得最终数据。
1.3 统计学分析
Excel 2010建立数据库,结果均用平均值±标准差(±s)表示,并且用IBM SPSS Statistics 22.0软件分析,两组间比较用成组t检验,多组间比较用单因素方差分析,Alpha和Beta多样性检验均经Bray Curtis检验,显著性水平α为0.05,P<0.05为差异具有显著性意义。
2 结果
2.1 菌群测序结果分析
16SrRNA测序显示,每组小鼠样品PCR扩增产物的大小集中在(400±100)bp之间,和V3+V4可变区大小基本吻合。小鼠粪便样品的稀释曲线(rarefaction curve)是计算随机抽取样品OTUs大小,按统计量和物种多样性来绘制曲线。结果显示,随着测序数量的增加,每个样品聚类物种数目也在增加,且斜率逐渐降低,说明小鼠粪便样品送测数量合理,测序深度足以满足后续研究(见图1)。

图1 小鼠粪便样品稀释曲线Figure 1 Rarefaction curve of mouse stool sample
物种累积曲线(species accumulation curve)用来判断样本量是否充分。结果显示,在样本量渐增的同时,所对应的物种数目也在增加,且曲线渐趋平坦,同样说明小鼠测序样品的数量合理(见图2)。
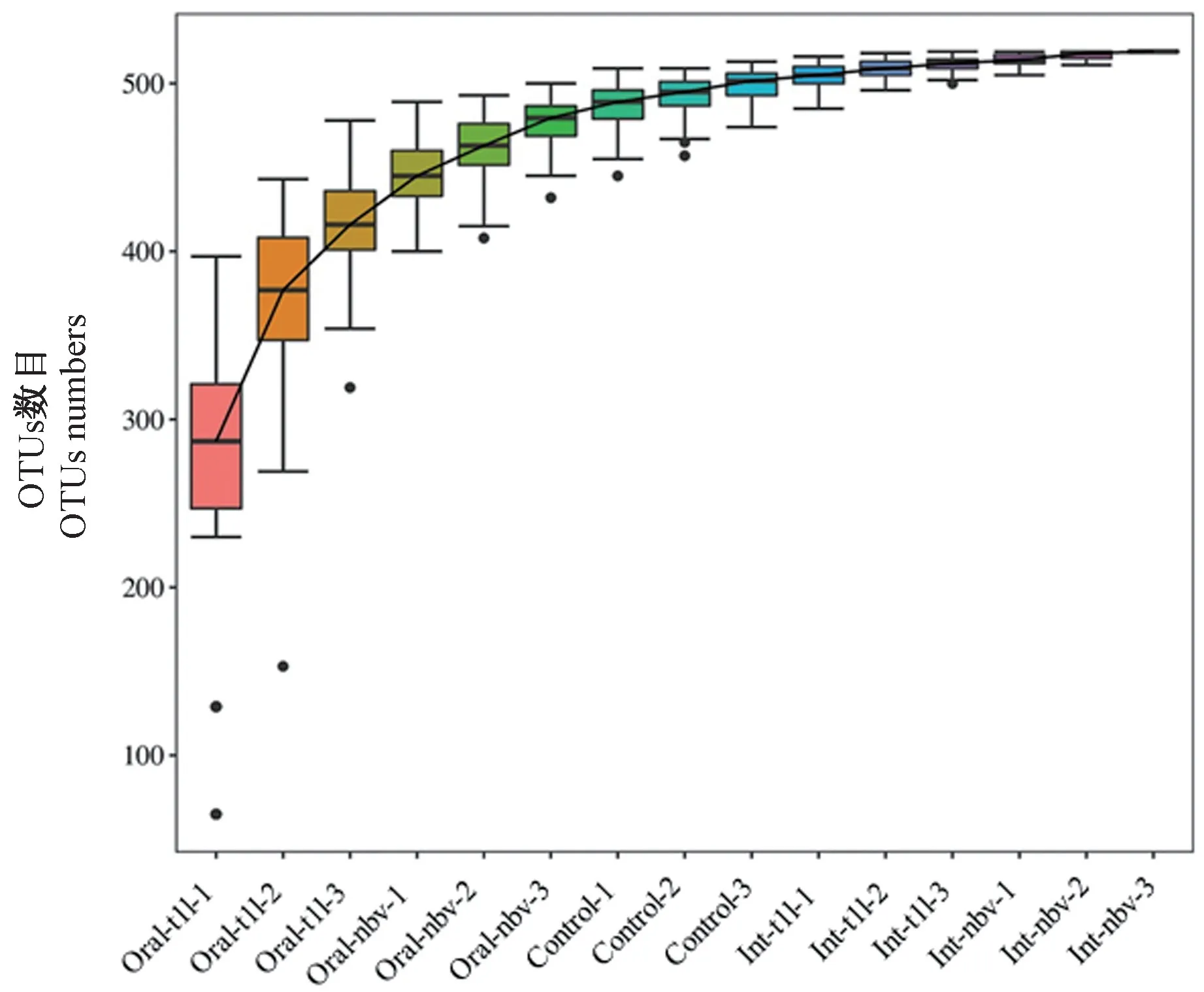
图2 小鼠粪便样品物种累积曲线Figure 2 Species accumulation curve of mouse stool sample
2.2 粪便样品比较分析
Anosim分析基于Bray Curtis距离来比较组间和组内差异,从而判断组间群落差异是否具有显著性。结果显示,统计参数R>0,即组间差异大于组内差异,说明分组合理,且P<0.05说明统计学上差异具有显著性(见图3)。

图3 基于Bray Curtis距离的Anosim盒状图Figure 3 Anosim box plot based on Bray Curtis distance
2.3 Alpha多样性分析
Alpha多样性由丰富度和多样性共同决定,囊括多个指标,以Chao1和Shannon指数最具代表。Chao1值越大,则物种越丰富、数量越多;Shannon_2值越大,则物种越多样化,分配越均匀。结果显示:和对照组相比,NBV和T1L感染后Chao1和Shannon_2值都降低,且T1L滴鼻组明显降低,具有显著性差异(P<0.05);NBV滴鼻组和灌胃组相比,两种指数升高且有统计学的差异(P<0.05)。总的来说,NBV和T1L灌毒后菌群丰度和多样性都有所下降,以T1L滴鼻组最为明显;两种灌毒方式相比,滴鼻后的小鼠菌群丰富度和多样性都有所增加,以NBV滴鼻组最为明显(见表1)。
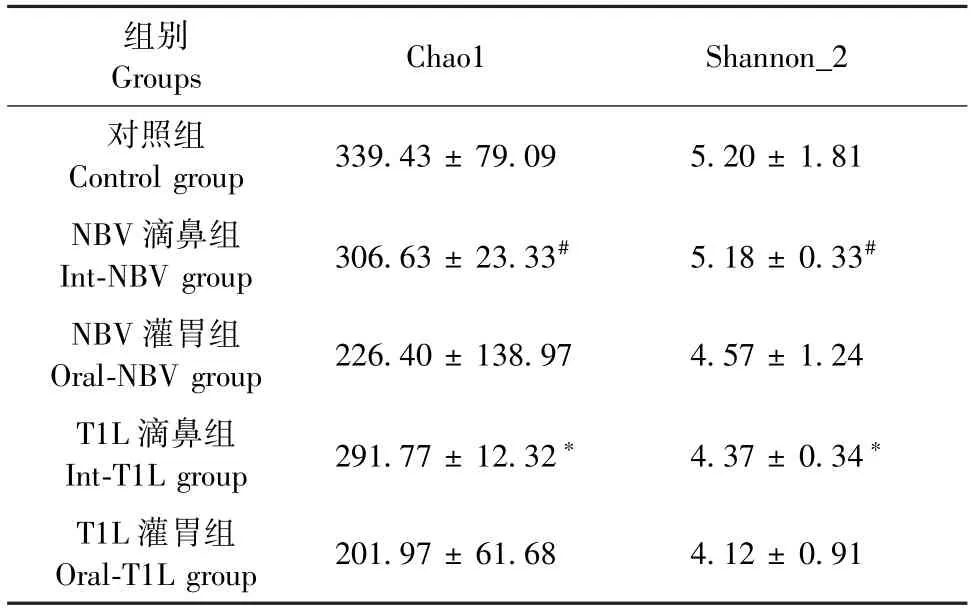
表1 小鼠菌群Alpha多样性(n=3)Table 1 Alpha diversity of mouse flora(n=3)
等级丰度曲线(rank abundance curve)宽度反映物种丰度,平缓程度反映均匀性。结果显示,对照组小鼠肠道微生物丰度和均匀性最高,而NBV、T1L灌毒后都有所降低(见图4)。

图4 小鼠菌群的等级丰度曲线Figure 4 Rank abundance curve of mouse flora
2.4 Beta多样性分析
Beta多样性是对 Bray Curits、Unweighted UniFrac、Weighted UniFrac多变量综合统计,探讨多个样品间是否具有显著群落差异。作为Beta多样性降维方式的一种,主坐标分析(PCoA分析)是从任意尺度寻找差异大小,点之间的距离越近,代表物种组成越相似。结果显示,各组点都较集中,其中NBV滴鼻组和对照组有明显分界线;此外,NBV滴鼻组和灌胃组之间相距甚远区分鲜明,说明NBV灌毒对菌群产生了影响。总的来看,NBV滴鼻能明显改变小鼠微生物群落的结构(见图5)。

图5 基于Bray Curtis距离的PCoA分析Figure 5 PCoA analysis based on Bray Curtis distance
2.5 粪便物种群落结构分析
从门级别的分布情况来看,共检测出9种主要细菌门类,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)位列前三。与对照组相比,T1L、NBV灌胃组的厚壁菌门丰度减少,NBV灌胃组的变形菌门丰度显著增加,T1L、NBV滴鼻组的拟杆菌门丰度减少。与NBV灌胃组相比,NBV滴鼻组变形菌门的含量显著降低;与T1L灌胃组相比,T1L滴鼻组拟杆菌门的含量显著降低(P<0.05)(见图6)。同样,从门级别的相应热图也显示一致结果(见图7)。
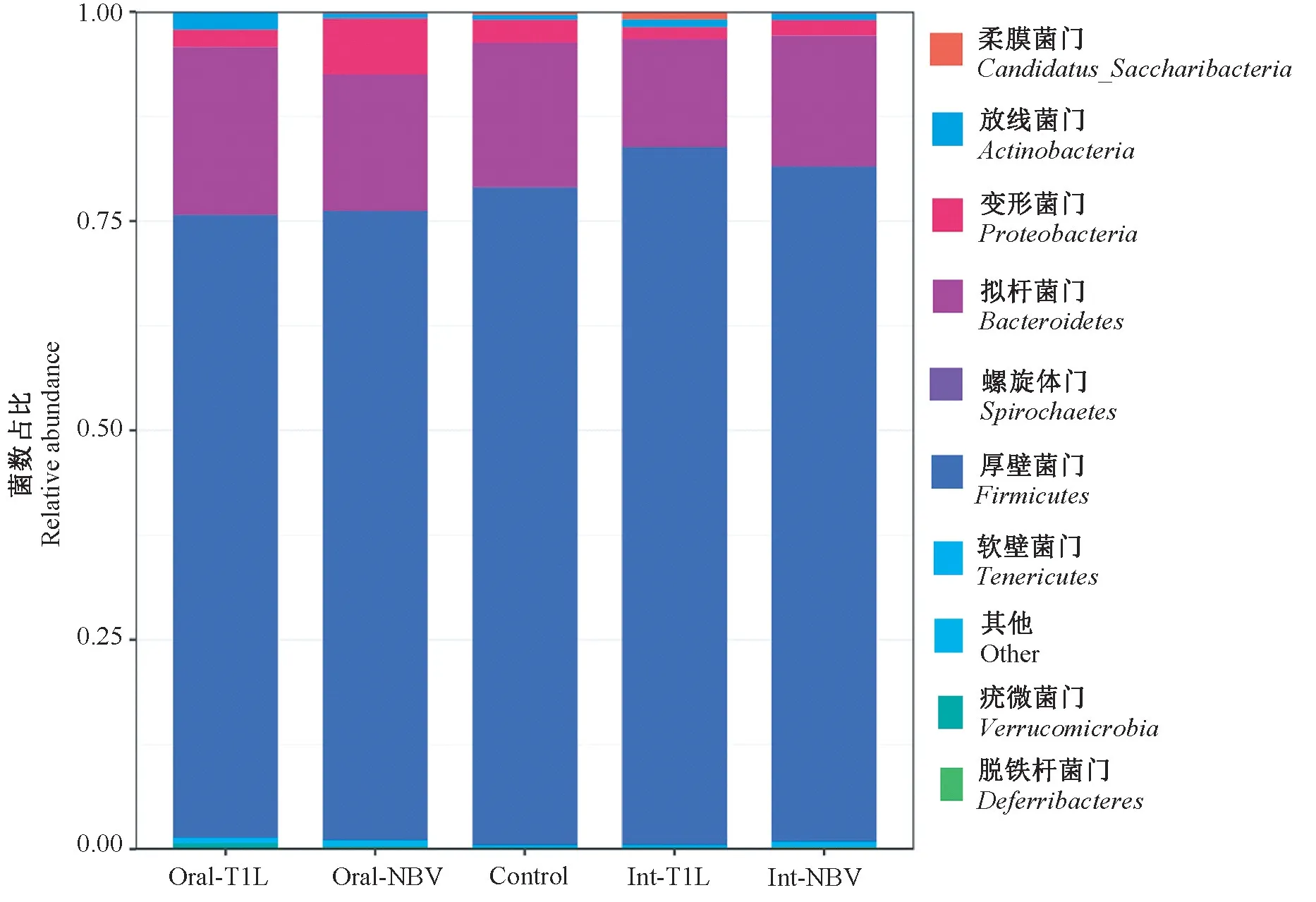
图6 门级别上物种的相对丰度柱状图Figure 6 Histogram of relative abundance of species at phylum level
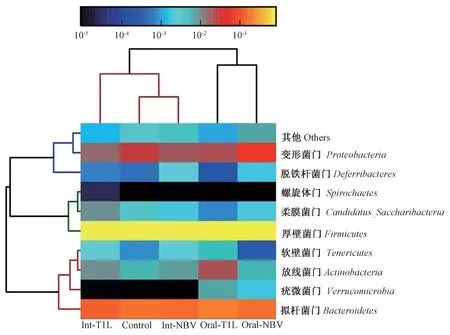
图7 门级别上物种的相对丰度热图Figure 7 Heat map of relative abundance of species at phylum level
从属级别的分布情况来看,与对照组相比,灌毒后的乳酸菌属(Lactobacillus)丰度显著增加,T1L滴鼻组的别样杆菌属(Alistipes)丰度显著增加,NBV灌胃组的瘤胃球菌属(Ruminococcus)丰度显著增加,T1L滴鼻组、T1L灌胃组和NBV灌胃组的罗姆布茨菌属(Romboutsia)丰度显著降低(P<0.05)(见图8)。同样,从属级别的相应热图也显示一致结果(见图9)。

图8 属级别上物种的相对丰度柱状图Figure 8 Histogram of relative abundance of species at genus level

图9 属级别上物种的相对丰度热图Figure 9 Heat map of relative abundance of species at genus level
3 讨论
肠道菌群维系着机体稳态,是不可小觑的“天然屏障”。通过寄居在与外界相通的呼吸道或肠道粘膜表面,细菌之间或细菌与环境之间形成了一种特殊的共生关系,且相对平衡[12]。若共生关系失衡,庞大的微生物群落会发挥独特作用,从而周而复始地保护免疫系统及相关器官,让机体处于健康状态[13]。因此,肠道菌群的相对稳定及其与宿主间形成的相互依存关系显得极为重要。
T1L和NBV都可经呼吸道和消化道感染宿主,诱发咳嗽、肺炎、腹泻、发热等炎症反应[14]。研究表明,病毒在气管表面首次增殖,能够破坏呼吸道菌群平衡,刺激细胞趋化因子生成,进而影响消化系统正常功能[15-16]。Chen等[17]发现,呼肠孤病毒感染会改变肠道菌群,主要表现在有益细菌的损失和致病菌的代偿性增多,这可能是肠道病变的主要原因,但具体机制尚未阐明。本次研究透过16SrRNA测序技术,展现了经T1L和NBV感染后小鼠肠道微生物丰度和多样性都有所降低,是菌群紊乱的潜在因素;其中,经呼吸道感染T1L对肠道菌群的影响最为显著。从门的级别上,厚壁菌等有益细菌在病毒感染后有所减少,而变形菌等机会致病菌被认为是大肠杆菌侵袭力增加的促进因素,它在NBV经胃肠道感染后显著增加;从属的级别上,别样杆菌增加可能导致哺乳动物发生肠道炎症,提示T1L经消化道感染会大大增强此菌的危害[18-20]。另一方面,感染方式不同,小鼠的肠道微生物群落也表现出差异。Bassis等[21]已经发现,病原微生物经口鼻摄入可直达胃肠道和呼吸道上皮,而且胃肠道病原体也可经肠胃-食管逆流至下呼吸道;尚且NBV作为一种既可经胃肠道又可经呼吸道侵入的呼肠孤病毒,通过呼吸道感染会大大增加对正常微生物定植的威胁[22]。基于前人勘究及本次实验研究,初步推测NBV经呼吸道感染比消化道更能改变菌群的丰度和多样性,可能对宿主微生态平衡的破坏力更强,但具体机制还有待深入研究。
综上,T1L和NBV两种呼肠孤病毒感染均可致小鼠肠道菌群紊乱,主要表现在丰度和多样性减低,且机会致病菌富集。此外,病毒的感染方式不同也会导致肠道菌群的结构不同,优势菌种呈现明显差异。因此,从肠道菌群的角度出发,抗病毒药物如何能够在发挥药效的同时维护微生态的平衡,将是未来思考的一大课题。
