维生素C碳点对IgY二级结构及提取效果的影响
2022-03-24郭培红田丹阳孙丙耀宋学宏
郭培红,田丹阳,黄 健,孙丙耀,宋学宏*
(1. 昆山贝瑞康生物科技有限公司,江苏昆山 215345;2. 苏州大学医学部基础医学与生物科学学院,江苏苏州 215123)
卵黄抗体又称卵黄免疫球蛋白(egg yolk immunoglobulin,IgY),是鸡血清IgG转移到卵黄中形成的特异性抗体。常见的IgY提取方法有冻融法、水稀释法、盐析法、有机溶剂沉淀法、天然胶法、去污剂提取法等[1-5],但这些方法存在工艺流程多、设备要求高、试剂用量大、化学物质残留、污染环境等弊端。
碳点(carbon dots)是一种近似球形的直径小于10 nm的零维半导体纳米晶体,是极少分子或者原子组成的纳米团簇,其表面存在羟基、羧基、羰基等多种含氧官能团[6-7],具有水溶性好、易功能化、低毒性和生物相容性强等特点,广泛应用于不同生物及医学领域[8~10]。碳点表面存在多种含氧官能团,这一特性能否促进卵黄中蛋白质聚合体的解聚或脂蛋白中脂肪的去除,从而提高IgY的提取效率,有待验证。旨在分析维生素C碳点对IgY提取效果的影响,从而为规模化提取IgY的可行性以及碳点的创新性应用提供依据。
1 材料与方法
1.1 材料
1.1.1 材料 抗草鱼IL-1β高免蛋:选择苏州市吴江区汾湖镇红兴禽蛋经营部130日龄健康产蛋鸡,按照既定流程免疫,收集高免蛋[11];维生素C碳点由苏州大学功能纳米与软物质研究院前期制备,实验室保存。
1.1.2 试剂及仪器 BCA蛋白浓度测定试剂盒购自北京索莱宝生物科技有限公司;HRP标记羊抗鸡IgY抗体购自Thermo Fisher公司;邻苯二胺购自北京百灵威科技有限公司;其他试剂均为国产分析纯。CR22G型高速冷冻离心机为日本日立公司产品,J-815圆二色光谱仪为日本Jasco公司产品,酶标仪是美国BioTek公司产品,其他均为国产仪器。
1.2 方法
1.2.1 IgY提取方法 常温下用自来水清洗抗草鱼IL-1β高免鸡蛋,接着用0.25 mg·L-1的二氧化氯水溶液浸泡消毒5 min。用卵黄分离器获取卵黄,室温搅拌均匀得到混合卵黄液。将维生素C碳点溶入浓度为0.12 mol·L-1(pH 5.1)的乙酸-乙酸钠缓冲溶液,获得浓度分别为0.00、6.25、12.50及25.00 mg·L-1的维生素C碳点溶液。取卵黄液,按照卵黄与缓冲液体积比分别为1∶5、1∶7和1∶9的比例,加入含不同浓度维生素C碳点的乙酸-乙酸钠缓冲溶液,室温100 r·min-1混合10 min,每组设置5个重复,其中3个室温下,另2个4 ℃下避光静置沉淀15 h。最后,室温条件下4000 r·min-1离心30 min得上清,即为抗草鱼IL-1β IgY提取液,留样待测。同样方法制备普通鸡蛋IgY提取液。
1.2.2 IgY二级结构的圆二色光谱分析 卵黄与缓冲液体积比为1∶9组的不同浓度维生素C碳点提取的IgY提取液,经定性滤纸过滤除脂,然后加入硫酸铵晶体,使其终浓度为19%,室温静置1 h后,12000 r·min-1低温离心10 min,得白色沉淀。将白色沉淀溶解于原体积的PBS(0.01 mol·L-1,pH 7.4)中,再加入硫酸铵晶体至终浓度13%,室温静置1 h后12000 r·min-1低温离心10 min,取其白色沉淀,溶于PBS。4 ℃条件下,PBS中搅拌透析24 h,期间更换4次PBS,最终得到纯化的抗草鱼IL-1β IgY。调整各组IgY终浓度至0.2 g·L-1,在J-815圆二色光谱仪上测定IgY二级结构。测定参数:石英样品池光径1 mm,灵敏度20 mdeg,扫描速度100 nm·min-1,扫描范围190~250 nm,室温下进行测定。试验中以PBS缓冲液为空白扣除溶剂吸收峰,所有圆二色数据经3次扫描取平均值,得圆二色谱图。所得圆二色数据经仪器自带分析软件,采用杨氏算法拟合并计算各二级结构相对比例。
1.2.3 IgY提取液中蛋白含量的测定 采用BCA蛋白浓度测定试剂盒测定IgY提取液中水溶性蛋白含量。
1.2.4 IgY提取液中IgY量的直观测定 因IgY提取液中残存少量杂蛋白,为进一步直观检测不同浓度维生素C碳点对IgY提取效果的影响,将IgY提取液用定性滤纸过滤,用质量体积比为19%的硫酸铵晶体进行沉淀后,再用IgY提取液相同体积的PBS重悬,取20 μL重悬液上样进行SDS-PAGE电泳分析,鉴定IgY提取效果。
1.2.5 IgY提取液中抗体效价的测定 IgY提取液中抗体效价采用间接ELISA法测定:用碳酸盐缓冲液(0.05 mol·L-1,pH 9.6)稀释纯化的抗草鱼IL-1β重组蛋白至3 mg·L-1,包被96孔酶标板,37 ℃温育1.5 h后于4 ℃过夜,10%脱脂牛奶37 ℃封闭处理2 h;用抗体稀释液(含1%脱脂牛奶的PBS)将IgY提取液按不同倍数稀释待检;二抗为羊抗鸡辣根过氧化物酶(HRP)标记抗体(1∶2500稀释);邻苯二胺为显色底物;2 mol·L-1的H2SO4终止反应。用酶标仪在492 nm处读取OD值。以相同条件提取的普通鸡蛋的IgY作为阴性对照,抗体稀释液为空白对照。判定标准为:P/N =(待测OD值-空白对照OD值)/(阴性对照OD值-空白对照OD值),当P/N ≥ 2.1时抗体最大稀释度即为抗体效价。
1.2.6 IgY提取液中细菌含量测定 以4 ℃条件下提取的IgY提取液为对照,用LB固体平板涂布,测定当卵黄与缓冲液体积比为1∶9时不同浓度的维生素C碳点处理的草鱼IL-1β IgY提取液中总菌含量。为验证维生素C碳点的杀菌作用,并排除离心对IgY提取液中菌含量的影响,将IgY提取液与卵黄中原有脂肪沉淀混合后,分别取100 μL涂布,培养24 h后统计菌落数。
1.2.7 数据处理 试验结果表示为“平均值±标准差”,采用SPSS17.0经One-way NOVA分析后进行Duncan's多重比较法分析试验数据的差异显著性,显著水平为P< 0.05;用OriginPro 9.0软件和Excel 2007作图。
2 结果与分析
2.1 维生素C碳点对IgY二级结构的影响 蛋白质二级结构是蛋白质多肽链中有规则的重复的构象,其稳定性是通过肽链骨架上的羰基和酰胺基团之间形成的氢键维系,α-螺旋存在很多氢键,是蛋白质中最常见、最典型、含量最丰富的二级结构元件[12]。α-螺旋的圆二色谱在极值波长191 nm处呈正峰,在207~210 nm处及221~222 nm处呈负峰。不同浓度维生素C碳点提取的抗草鱼IL-1β IgY的圆二色光谱分析结果见图1。光谱结果经软件分析可知,抗草鱼IL-1β IgY是一个典型的只具有α-螺旋和β转角的蛋白,其中α-螺旋相对含量50%以上,这与方希修等[13]的研究结果略有差异,可能跟不同仪器的灵敏度及计算方法不同有关。随着维生素C碳点的添加,IgY二级结构中α-螺旋相对含量呈现先增加后减低的趋势,其中6.25及12.50 mg·L-1组的α-螺旋相对含量为59.0%和55.5%,分别较对照组提高了12.6%和5.8%,25.00 mg·L-1组的α-螺旋相对含量与对照组完全一致,分别为52.2%和52.4%。结果证明维生素C碳点有提高抗草鱼IL-1β IgY结构稳定性的作用。

图1 不同浓度维生素C碳点提取的抗草鱼IL-1β IgY的圆二色光谱图谱
2.2 维生素C碳点对高免蛋卵黄中水溶性蛋白的提取效果的影响 抗草鱼IL-1β IgY提取液中水溶性蛋白含量结果见表1。由表1可知,缓冲溶液不同稀释比例组IgY提取液中水溶性蛋白浓度随维生素C碳点浓度的增加而提高。各组间综合比较,当维生素C碳点浓度为25.00 mg·L-1时,缓冲液比例为1∶9组的IgY提取效果最好,达到极显著性差异(P<0.01),其次是缓冲液比例为1∶7组(P<0.05)。缓冲溶液稀释比例越高,可溶性蛋白提取效果越好,添加维生素C碳点有助于卵黄中水溶性蛋白的提取。
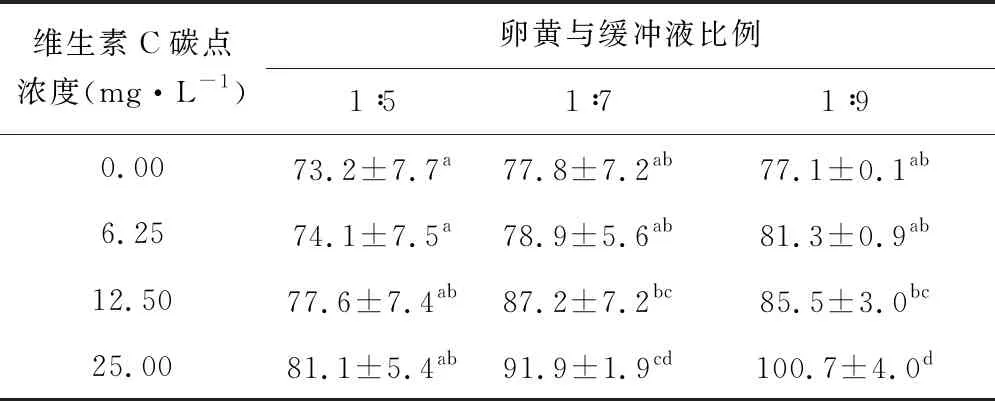
表1 不同浓度维生素C碳点及不同比例的缓冲液提取卵黄中水溶性蛋白的效率(mg·g-1卵黄)
2.3 维生素C碳点对IgY提取液中IgY量的直观影响 SDS-PAGE电泳分析了维生素C碳点添加对IgY提取效果的影响,其结果如图2。由图2可知,抗草鱼IL-1β IgY SDS-PAGE电泳图可观察到66 kDa左右的IgY重链、25 kDa左右的IgY轻链,以及40 kDa上下的两条杂蛋白条带(可能是卵黄蛋白原Ⅱ前体的C-末端片段[14])。从纯度(即条带灰度)分析,相同缓冲溶液比例组,当维生素C碳点浓度为6.25 mg·L-1时抗体提取效果最好,其次为12.50 mg·L-1浓度组,其它组差异不明显;三个比例的缓冲液提取的IgY均能达到较高纯度,且差异不明显。此结果与卵黄抗体提取液中水溶性蛋白含量结果不一致,说明高浓度维生素C碳点在提取IgY的同时提高了部分非IgY的水溶性杂蛋白,低浓度维生素C碳点更有利于IgY的提取。

注:M,蛋白分子量标准;泳道1~3,维生素C碳点浓度为0.00 mg·L-1;泳道4~6,维生素C碳点浓度为6.25 mg·L-1;泳道7~9,维生素C碳点浓度为12.50 mg·L-1;泳道10~12,维生素C碳点浓度为25.00 mg·L-1。泳道1、4、7、10,卵黄与缓冲液质量体积比为15;泳道2、5、8、11,卵黄与缓冲液质量体积比为1∶7;泳道3、6、9、12,卵黄与缓冲液质量体积比为1∶9。
2.4 维生素C碳点对IgY提取液中抗体效价的影响 将室温条件下,同一缓冲溶液体积比的相同维生素C碳点浓度的三个重复IgY提取液合并后测其抗体效价,结果如图3。由图3中ELISA结果可知,当卵黄与缓冲溶液比例为1∶5时,乙酸-乙酸钠缓冲溶液中添加维生素C碳点后各组IgY提取液中抗体效价均由对照组的1∶16 000提高到了1∶32000;当卵黄与缓冲溶液比例为1∶7时,维生素C碳点浓度6.25及12.50 mg·L-1组的抗体效价由1∶16000提高到了1∶32000,但维生素C碳点浓度25.00 mg·L-1组的抗体效价与未添加维生素C碳点组无差异;当卵黄与缓冲溶液比例为1∶9时,对照组抗体效价为1∶8000,维生素C碳点浓度25.00 mg·L-1组的抗体效价为1∶16000,而维生素C碳点浓度6.25及12.50 mg·L-1组的抗体效价达到了1∶32000。此结果一方面说明维生素C碳点的添加有助于IgY的提取,另一方面说明低浓度维生素C碳点提取IgY的效果较好。

图3 不同浓度维生素C碳点及不同比例缓冲液提取的卵黄抗体的抗体效价
2.5 维生素C碳点对IgY提取液中细菌含量的影响 当卵黄与缓冲液体积比为1∶9时不同浓度的维生素C碳点对抗草鱼IL-1β IgY提取液中总菌含量的影,室温条件下,未添加维生素C碳点的缓冲液提取的IgY液中细菌量较低温条件菌含量高(P<0.05);当缓冲液中加入维生素C碳点后IgY提取液中的细菌含量显著下降(P<0.05),且菌落数随维生素C碳点浓度的提高而减少,直至完全抑制细菌生长。说明在添加一定浓度维生素C碳点的情况下,可以实现室温提取IgY,且因维生素C碳点会降解而无毒,使得提取IgY后的副产品可进一步开发利用。
3 讨 论
IgY稳定性好,可室温长期保存,能够有效通过动物口腔和食道,在肠道发挥作用,同时还可在消化酶作用下降解成易被肠道吸收的具有免疫活性的小肽(Fab),转运至血液黏附病原体,或与宿主血液中的球蛋白末端结合免遭机体破坏[15-16]。同时,IgY不与哺乳动物及水产动物发生交叉血清学反应及补体系统反应、不结合类风湿因子或Fc受体等[17],使用更安全。IgY产自鸡蛋,产量高且获取方便,此外,还具有营养全面、富含生物活性物质、诱食性强等优势[18-19]。因此,突破规模化提取的技术瓶颈将极大地推进IgY在水产养殖上的应用。

图4 抗草鱼IL-1β IgY提取液中细菌含量测定
酸化水提取IgY工艺简单,成本低廉,除脂效果好,但提取液中仍有脂类与蛋白质结合。研究首次将维生素C碳点应用于IgY的酸化水提取,分析了维生素C碳点对IgY提取效果及二级结构的影响,结果表明,添加维生素C碳点有助于卵黄中水溶性蛋白的提取和抗体效价的提高,且低浓度维生素C碳点提取IgY的效果较好。圆二色光谱分析也表明,添加终浓度6.25和12.50 mg·L-1的维生素C碳点,使抗草鱼IL-1β IgY二级结构中α-螺旋相对含量分别较对照组提高了12.6%和5.8%,而25.00 mg·L-1组含量与对照组基本相同,出现这一结果,推测可能与维生素C碳点表面的羟基、羧基和氨基等官能团引起的极佳水溶性和化学反应性有关。这些官能团可与IgY结构中氨基酸残基相互作用,形成氢键或者范德华力等作用力[20],提高蛋白质的水溶性,IgY构象发生变化,但同时这种作用力的形成具有竞争性,低浓度可以促进α-螺旋的形成,提高IgY刚性,浓度过高则不利于氢键网络结构的形成;此外IgY构象的改变可能影响到了IgY的活性位点,导致高浓度维生素C碳点组的抗体效价不及低浓度组的高,具体机理有待进一步研究。维生素C碳点的添加能有效抑制IgY提取液中细菌的生长,实现室温条件下提取IgY,其杀菌原理是维生素C碳点可以通过破坏细胞壁扩散进入细菌和真菌细胞内部,与细菌和真菌的DNA和RNA结合,抑制rSNPs基因表达,并最终杀死细菌和真菌[21]。
口服用IgY对纯度要求不高,本研究发现添加维生素C碳点后1∶5~1∶9比例的缓冲液提取IgY均可达到很好的效果且菌含量极低,所以可以根据实际应用情况确定缓冲溶液的比例。
4 结 论
与传统的酸化水提取方法相比,缓冲溶液中添加6.25 mg·L-1的维生素C碳点,一方面可以进一步提高IgY得率,所得IgY稳定性好,解决了现有技术中提取卵黄抗体方法中存在成本大、抗体损耗大的问题,另一方面,IgY提取过程可在室温进行,设备要求简单,操作简便;同时解决了常规方法中提取液中残留的有机物及高剂量防腐剂对动物或人体存在潜在风险的技术问题;此外,因维生素C碳点具有良好的生物相容性,所以沉淀物还可开发为食品或饲料原料,或进一步用于卵黄高磷蛋白的提取[22]等,提高利用率,实现零污染。
