脾脏硬度联合流式细胞术在急性髓系白血病微小残留病监测中的意义
2022-03-24赵崇山王宁方
赵崇山,王宁方
(河北中石油中心医院感染科1,血液科2,河北 廊坊 065000)
急性髓系白血病(acute myeloid leukemia,AML)是起源于造血干/祖细胞的克隆性恶性血液病,随着新药的使用及造血干细胞移植的开展,有70%~80%AML 患者可以获得完全缓解,但仍有50%~70%患者最终复发[1-4]。微量残留病(minimal residual disease,MRD)指白血病患者按疗效标准经过治疗取得完全缓解(complete remission,CR)后体内残存微量白血病细胞的状态。据研究表明[5],若MRD 水平在治疗后第12 周仍高于10-4时,则急性白血病复发的概率极高。因此,通过监测MRD 水平可预测早期复发。但目前对于无特异融合基因及重现性遗传学异常的AML 患者,缓解后MRD 的监测缺乏有效的手段。近年来,FibroScan(FS)检测脾脏硬度(SSM)已被广泛应用于门脉压力与食管静脉曲张出血的评估[6,7]。有研究报道[8],FS 或可用来评估骨髓纤维化患者抗JAK2 治疗的效果。而白血病患者常伴有脾脏增大,且脾脏硬度增加往往比脾脏体积增大出现更早。因此,进行SSM 动态监测或可预测MRD 的变化,进而可以对白血病化疗后复发进行监测。为此,本研究选择33 例初诊AML 患者展开研究,分析SSM 与MRD 的相关性,现报道如下。
1 资料与方法
1.1 一般资料 选取2016 年3 月-2020 年3 月于河北中石油中心医院就诊的初治AML 患者(非M3)33 例,男17 例,女16 例;年龄24~82 岁,中位年龄53 岁;其中M0 3 例,M1 5 例,M2 10 例,M4 7 例,M5 8 例;随访时间为3~36 个月,中位随访时间18个月。纳入标准:根据患者骨髓细胞学、免疫分型、细胞遗传学、分子生物学、骨髓病理等确诊为AML。排除标准:①不能控制的癫痫患者;②有严重未控制的精神疾病。复发标准:完全缓解后外周血重新出现白血病细胞或骨髓原始细胞>0.05 或髓外出现白血病细胞浸润。流式检测骨髓中白血病细胞≥0.01%和<5%为MRD 阳性,白血病细胞<0.01%为阴性。将33 例初治AML 患者作为初诊组,经诱导化疗后作为诱导化疗后组,根据MRD 变化情况将诱导化疗后患者进一步分为MRD+组、MRD-组;另收集15例健康志愿者作为对照组,对照组中男8 例,女7例;年龄34~60 岁,中位年龄52 岁。
1.2 方法 收集患者临床资料,通过门诊及电话对患者预后情况进行随诊。SSM 检测:采用FibroScan 502(购自法国Echo Sens 公司)通过瞬时弹性成像技术检测SSM。检测时间点:AML 患者初诊、诱导化疗后14 d、随后每2 个月1 次。由同1 名专业医师对患者及健康志愿进行检测,测量区域要求远离脾脏边缘,没有大血管结构,脾脏有足够的厚度,将扫描仪M 探头垂直于受检者的皮肤表面,患者取侧卧位,左上肢上举,将探头置于其左腋前线9~11肋间[9],检测成功需满足以下条件:检测成功10 次以上,四分位间距≤30%,成功率≥60%[10],检测值以Kpa 表示。无血栓生存期(Thrombosis-free survival,TFS)定义为确诊时间至治疗期间发生血栓或随访结束,随访时间7~56 个月,中位随访时间33 个月。MRD 检测:AML 患者初诊、诱导化疗后14 d、随后每2 个月1 次抽取肝素抗凝骨髓血3 ml,对细胞进行计数,调整每管细胞106个,加入抗CD56-FITC、CD15 -FITC、CD64 -FITC、CD19 -PE、CD11b -PE、CD34 -PE、CD117 -PE、CD45 -Percp、CD33 -APC、CD13-APC、CD14-APC、HLA-DR-APC 单抗(beckman coulter,BD)各20 μl,混匀,室温避光孵育20 min,后加入红细胞裂解液裂解红细胞15 min,离心去上清,用PBS 洗涤两遍,条件500 g×5 min,最后用PBS重悬细胞,用用流式细胞仪(BD 公司的FACS CaliburTM)进行检测。
1.3 统计学方法 采用SPSS 17.0 软件包进行数据的统计学分析。计量资料用()表示,正态分布采用t检验或单因素方差分析,非正态分布用Kruskal Wallis 或Mann-UhitneyU检验,组间比较用Bonferroni 法,相关性采用Spearman 相关分析。所有检验均为双侧检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 不同组间SSM 比较 对照组、初诊组、诱导化疗后组SSM 值比较,差异有统计学意义(P<0.05),其中初诊组SSM 高于对照组、诱导化疗后组,见表1。诱导化疗后患者中,MRD+组SSM 高于MRD-组,差异有统计学意义(P<0.05),见表2;Spearman 相关性分析显示,MRD+组SSM 与MRD 水平呈正相关(r=0.877,P=0.000)。
表1 对照组、初诊组、诱导化疗后组SSM 比较(,Kpa)

表1 对照组、初诊组、诱导化疗后组SSM 比较(,Kpa)
表2 诱导化疗后不同MRD 组间SSM 比较(,Kpa)

表2 诱导化疗后不同MRD 组间SSM 比较(,Kpa)
2.2 复发及持续缓解患者SSM 的动态随访 治疗后复发及持续缓解患者SSM 变化见图1。8 例患者复发时间均在1 年内,其中患者2 在1 年内有2 次复发,随访时间分别为2、12 个月;7 例患者复发时SSM 升高,有明显的峰值,这些患者复发时均采取再诱导化疗,化疗后SSM 仍可下降;患者6 在随访过程中SSM 未升高,最终在随访12 个月时复发(图1B)。9 例持续缓解患者SSM 波动在3.9~8.7 Kpa,总体呈下降趋势,无明显峰值(图1A)。SSM 在复发时升高,治疗后不同程度下降。
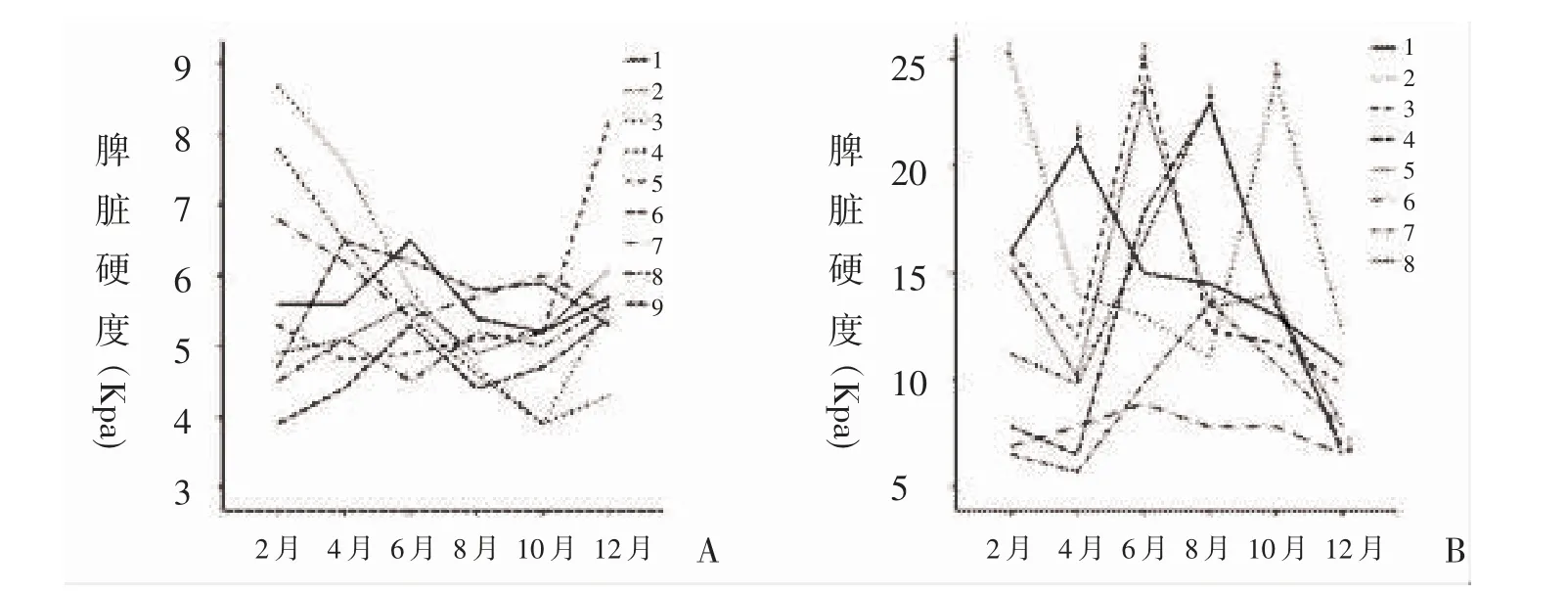
图1 AML 患者SSM 的动态随访
3 讨论
AML 是发生于造血干/祖细胞的恶性增殖性疾病。MRD 是影响AML 患者生存的重要因素,是复发的根源[11,12]。检测化疗后MRD 对AML 患者的危险分层以及治疗方案的选择具有重要作用。FS 因其具有无创、快速、准确度高等特点在肝病方面有广泛应用[13]。目前,SSM 可用来预测胆道闭锁患儿的食管胃底静脉曲张程度[7,14]。而急性髓性白血病常伴有脾脏增大,因此本研究应用FS 对AML 患者进行SSM 检测,结果发现发现AML 患者治疗前SSM 高于对照组,猜测SSM 可能与AML 的发生发展有关。本研究还显示,诱导化疗后组SSM 较初诊组降低,提示在诱导化疗后随着疾病的缓解,患者SSM 也同步下降,进一步证实了SSM 变化与AML 发生发展有关,而较低的SSM 值往往预示着较高的缓解程度,而较高的SSM 值则提示较差的缓解状态或高复发风险。
研究报道[15],AML 患者完全缓解后MRD 水平在<10-4、10-4~10-3、10-3~10-2、>10-2的患者3 年复发率分别为0、14%、45%、85%。另有研究发现[16],诱导治疗后及巩固治疗后MRD 水平与AML 患者的临床结局有关,且巩固治疗后MRD 水平是影响预后的独立因素。本研究发现,诱导化疗后MRD+组SSM高于MRD-组,且诱导化疗后MRD+组SSM 与MRD水平呈正相关。由此推测,诱导化疗后SSM 值越高,MRD 水平越高,复发率可能越高,患者预后更差。需要说明的是,临床上监测MRD 需要进行多次骨髓穿刺,而SSM 检测为无创检测,在不增加患者痛苦的情况下可以更好的监测AML 的复发情况。
融合基因定量检测可作为预测AML 患者血液学复发的可靠指标,但基因检测花费大,耗时多,对实验室要求较高,常规开展存在一定难度。本研究发现,8 例复发患者均在1 年内,可能与患者年龄偏大及采取的治疗方案有关。7 例患者复发时SSM 升高,有明显的峰值,而再诱导化疗后SSM 有不同程度下降。患者6 在随访过程中SSM 未升高,最终在随访12 个月时复发,复发时间较其他患者晚。9 例持续缓解患者SSM 值较低,总体呈下降趋势。因此,诱导化疗后SSM 再次升高者提示存在复发风险,而持续低SSM 可能预示患者处于缓解状态。诱导化疗后SSM 高者采取异基因造血干细胞移植或可提高患者的生存期,而SSM 低者或可适当降低化疗强度,以避免过强化疗所致的脏器损害。
综上所述,诱导化疗后SSM 与MRD 密切相关,检测SSM 或可联合FCM 检测对AML 患者进行动态随访,以进一步评估其预后,指导临床治疗。
