NLR、PLR 与LMR 在儿童过敏性紫癜肾损害中的相关性
2022-03-24汪晶晶孙礼宾
汪晶晶,孙礼宾
(安徽医科大学附属巢湖医院儿科,安徽 合肥 238000)
过敏性紫癜(Henoch-Schönlein purpura,HSP)是儿童时期最常见的血管炎症疾病之一,主要以非血小板减少性紫癜、关节炎或关节痛、伴或不伴腹痛、胃肠出血及肾损害为主要临床表现[1]。HSP 患者中有30%~50%累及肾脏,肾损害是决定其临床病情程度及预后的重要因素[2,3]。中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板/淋巴细胞比值(platelet to lymphocyte ratio,PLR)和淋巴细胞/单核细胞比值(lymphocyte-monocyte ratio,LMR)是近年来被广泛研究的一种新的非特异性炎症标志物,能同时反映机体的免疫和炎症状态,不易受机体感染、应激、外伤等因素的影响,被证实在心血管疾病、血管炎、肿瘤及其他自身免疫性疾病中是判断炎症程度的潜在指标[4-6],与疾病进展及预后有关。NLR、PLR、LMR 在自身免疫性疾病,如系统性红斑狼疮、类风湿关节炎、血管炎综合征等肾损害中均有相关研究,但与HSP 肾损害的关系尚不明确。本研究通过回顾性分析,探讨NLR、PLR、LMR 及三者联合检测在儿童HSP 肾损害中的预测价值,现报道如下。
1 资料与方法
1.1 一般资料 选取2016 年6 月-2021 年6 月安徽医科大学附属巢湖医院儿科初次诊断为HSP 的180 例患儿为研究对象,纳入标准:符合HSP 诊断标准,满足下列至少任何一项即可确诊:①出现弥漫性腹痛;②组织病理学表现为以IgA 沉积为主的白细胞破裂性血管炎或以IgA 沉积为主的增殖性肾小球肾炎;③出现关节炎或关节痛;④肾脏受累,即蛋白尿>0.3 g/24 h,或尿白蛋白/肌酐比值>30 mmol/mg(晨尿),或血尿或红细胞管型>5 个红细胞/高倍镜[7,8]。排除标准:①有急慢性感染、血液系统疾病、恶性肿瘤、其他自身免疫性疾病等;②近30 d 内有输血史;③近30 d 内有糖皮质激素及免疫抑制剂治疗;④有其他原发性、继发性肾脏疾病史。根据是否发生肾损害分为肾损害组(n=30)和非肾损害组(n=150)。两组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经医院伦理委员会审批通过,患儿家属知情同意并签署知情同意书。
表1 两组一般资料比较(n,)
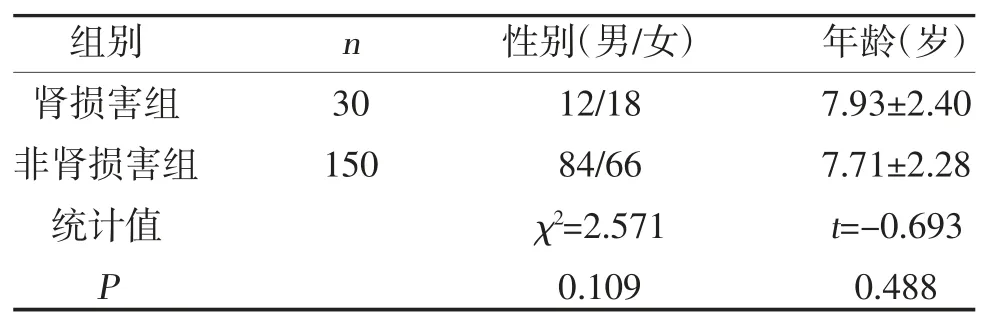
表1 两组一般资料比较(n,)
1.2 方法 采集患儿一般临床资料及入院首次空腹血常规指标,记录白细胞计数(WBC)、中性粒细胞计数(NEU)、淋巴细胞计数(LYM)、单核细胞计数(MONO)、血小板计数(PLT),并计算NLR、PLR、LMR。
1.3 统计学方法 采用SPSS 26.0 统计软件进行数据分析,计数资料以[n(%)]表示,采用χ2检验;正态分布的计量资料以()表示,比较采用t检验;偏态分布的计量资料以[M(P25,P75)]表示,比较采用Mann-WhitneyU检验;通过二元Logistic 回归分析HSP 肾损害的影响因素;采用ROC 曲线分析各指标对HSP 肾损害的预测价值。以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组血常规指标比较 肾损害组WBC、NEU、MONO、PLT、NLR、PLR 高于非肾损害组,LYM、LMR 低于非肾损害组(P<0.05),见表2。
表2 两组血常规指标比较[M(P25,P75),]

表2 两组血常规指标比较[M(P25,P75),]
2.2 HSP 肾损害的影响因素分析 二元Logistic 回归分析显示,NLR、PLR、LMR 是HSP 肾损害的影响因素(P<0.05),见表3。
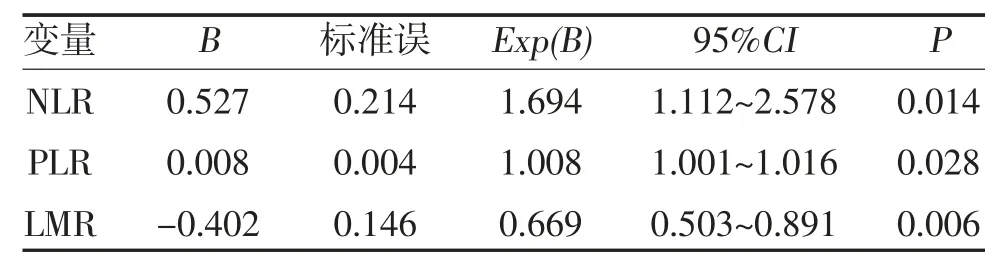
表3 HSP 肾损害的影响因素分析
2.3 各指标对HSP 肾损害的预测价值分析 NLR、PLR、LMR 联合检测的ROC 曲线下面积(AUC)分别为0.831、0.809、0.785、0.847,见表4、图1、图2。
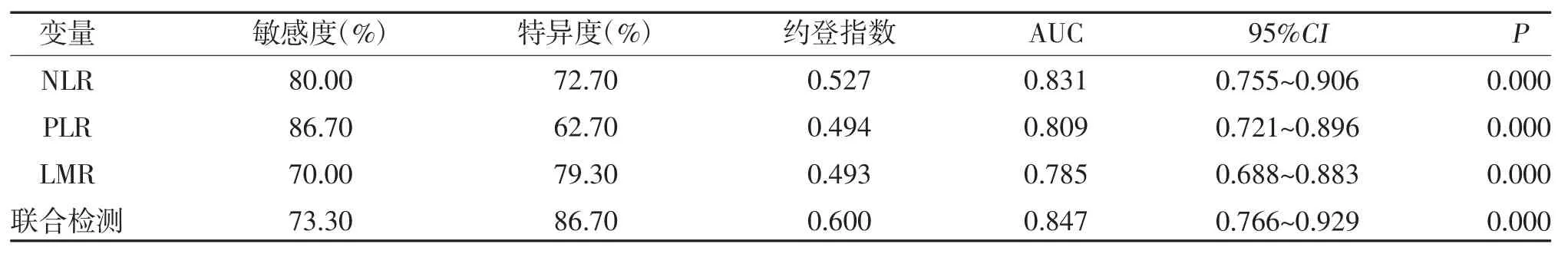
表4 各指标对HSP 肾损害的预测价值分析

图1 NLR、PLR 及联合检测预测过敏性紫癜肾损害的ROC 曲线
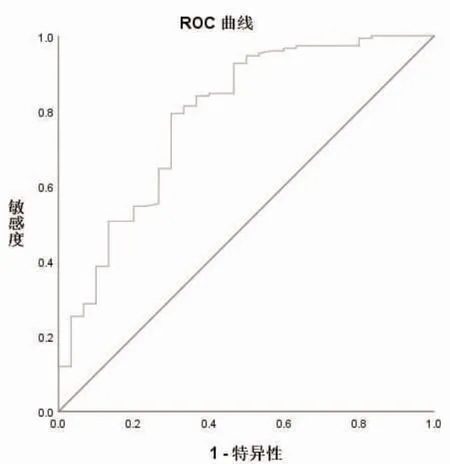
图2 LMR 预测过敏性紫癜肾损害的ROC 曲线
3 讨论
HSP 又称IgA 型血管炎,是主要发生在儿童时期以IgA 免疫复合物介导的急性血管炎综合征,以广泛的小血管炎症为病理基础,具有丰富毛细血管的肾脏是主要受累器官,而肾脏受累也是影响患儿预后的主要因素[9]。HSP 肾损害的发病机制尚不完全清楚,可能与遗传因素、免疫失衡、纤溶功能亢进、炎症反应及基因易感性等有关,由免疫介导、炎症介质等参与疾病进展,使肾脏固有组织发生炎症反应,从而引起肾脏不同程度损害[10]。
HSP 组织病理学特征之一是中性粒细胞浸润,中性粒细胞不止是第一批进入损伤/炎症部位清除细胞外病原体的效应细胞,而且还通过释放细胞因子、细胞外陷阱和效应分子等来影响免疫系统中其他细胞的激活、调节和功能[11]。HSP 患儿大多存在细胞免疫异常的现象,细胞免疫则主要通过诱导内皮细胞趋化因子的产生而引起中性粒细胞聚集,使外周血多核中性粒细胞水平升高[12]。本研究结果显示,肾损害组WBC、NEU、MONO、NLR 高于非肾损害组,LYM、LMR 低于非肾损害组(P<0.05)。HSP 肾损害与HSP 发病机制相似,免疫系统发挥功能使单核细胞大量增殖,导致淋巴细胞出现凋亡从而减少,使得肾小管血管及周围出现中性粒细胞浸润,免疫复合物沉积于肾脏引发炎症反应[13],因此在HSP 肾损害中可出现NLR 增高、LMR 降低。
血小板与中性粒细胞在肾损害中作用机制相似,在肾脏血流动力学过程中作为中枢效应细胞存在。相关研究表明[14],在IgA 型血管炎肾受累患者中血小板出现反应性增多和活化,而在急性感染性肾损伤中PLR 比值也有明显升高。本研究中HSP 肾损害组PLT、PLR 高于非肾损害组(P<0.05),其主要机制为HSP 肾损害患儿血管内皮细胞损伤,促使血小板活化及激活炎症因子,参与血管的炎症反应,肾小球毛细血管袢内聚集,形成肾小球毛细血管内微血栓,同时释放血管活性胺、生长因子、细胞因子、蛋白酶等活性物质影响肾血管微循环,使肾小球的通透性增加及肾小球系膜增生,促进免疫复合物沉积于系膜区,进而导致肾脏损伤[15]。本研究中二元Logistic 回归分析显示,NLR、PLR、LMR 是HSP肾损害的影响因素(P<0.05);ROC 曲线分析显示,三者联合检测的AUC 为0.847,敏感度为73.30%,特异度为86.70%。在单个指标中,NLR 为最佳预测因子,其AUC 为0.831,特异度为72.70%,敏感度为80.00%,临界值为2.48。HSP 患儿的NLR 比值随着肾脏功能损伤而增高,当NLR>2.48 时,或可作为临床预测HSP 肾损害的简易实验室指标。
综上所述,NLR、PLR、LMR 与HSP 肾损害相关,是发生肾损害的危险因素,三者联合检测对临床诊断HSP 肾损害有一定的价值。
