抑肝散提取物对环境内分泌干扰物神经毒性的抑制作用
2022-03-24穆轶朱彧
穆轶,朱彧
(1.天津医科大学第二医院药学部,天津 300211;2.天津市海河医院检验科,天津 300350)
双酚A(bisphenol A,BPA)和邻苯二甲酸二-(2-乙基)己酯(di-(2- ethylhcxyl)phthalate,DEHP)是广泛存在于日用品的环境内分泌干扰物(environmental endocrine disruptors,EEDs),主要存在于饮用水、食品容器、化妆品以及供水管等,主要暴露途径包括吸入、摄入和皮肤接触等[1]。BPA 和DEHP 能够穿透血-脑屏障,影响神经功能[2]。
抑肝散出自明代薛铠所著《保婴撮要》,可养血活血舒肝、抑制肝气亢盛和郁结,已应用于临床多年,疗效确切[3-4]。本研究考察了抑肝散对BPA+DEHP 暴露大鼠神经功能的保护作用及机制,为抑肝散应用于EEDs 神经毒性防治提供研究基础。
1 材料和方法
1.1 药物和试剂 BPA 和DEHP 购自美国Sigma公司;小鼠神经母细胞瘤细胞Neuro-2a 细胞购自北京协和细胞资源中心;抑肝散由钩藤、柴胡、茯苓、白术、川芎、当归、甘草按3∶4∶2∶4∶1.5∶3∶3 比例组成,所有均购自天津医科大学第二医院,经乙醇/氯仿提取后使用;caspase-3 活性、总抗氧化能力(total antioxidant capacity,T-AOC)、丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)含量和线粒体膜电位(mitochondrial membrane potential,MMP)试剂盒均购自索莱宝公司;星形胶质细胞胶质纤维状酸性蛋白(GFAP)、巢蛋白(nestin)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)、哺乳动物雷帕霉素靶蛋白mTOR、β-actin 抗体和羊抗兔IgG-FITC 荧光二抗均购自Santa Cruz 公司;CCK8 试剂盒购自美国abcam 公司;Annexin V-PE 细胞凋亡检测试剂盒和活性氧检测试剂盒购自上海碧云天生物科技有限公司;全自动生化分析仪购自美国Beckman Coulter 公司,酶标仪购自美国Thermo Fisher Scientific 公司,FACSAria 流式细胞仪购自美国BD 公司。
1.2 细胞培养 小鼠神经母细胞瘤细胞Neuro-2a细胞培养于37℃、5%CO2、饱和湿度的培养箱中,培养基为H-DMEM,添加10%胎牛血清。0.25%胰酶-EDTA 消化传代,所有实验均采用对数生长期细胞。
1.3 细胞增殖实验 将Neuro-2a 细胞(5 000 个/孔)培养于96 孔板中,经BPA(0.1 mmol/L)+DEHP(0.1 mmol/L)与3 mg/mL(低剂量组)和6 mg/mL(高剂量组)抑肝散乙醇/氯仿提取物共培养72 h 后,更换新鲜完全培养基,加入10 μL/孔CKK-8 溶液,37℃孵育4 h,应用酶标仪在460 nm 吸收波长处检测OD 值。未处理组作为对照组,BPA+DEHP 处理组作为暴露组。
1.4 流式细胞术 将Neuro-2a 细胞(3×105个/孔)培养于6 孔板中,经BPA(0.1 mmol/L)+DEHP(0.1 mmol/L)与3 mg/mL(低剂量组)和6 mg/mL(高剂量组)抑肝散乙醇/氯仿提取物共培养72 h 后,0.25%胰酶-EDTA 消化后转移至PE 管中,加入5 μL Annexin V-PE 溶液,室温避光孵育10 min,通过流式细胞仪检测细胞凋亡水平。加入10 μL 荧光探针DCFH-DA,室温避光孵育20 min,通过流式细胞仪检测细胞ROS 水平。未处理组作为对照组,BPA+DEHP 处理组作为暴露组。
1.5 动物实验 初断乳雄性Sprague-Dawley(SD)大鼠(180~220 g),购自北京华阜康生物科技有限公司,许可证号:SCXK(京)2019-0008。于实验前适应性饲养1 周,饲养温度25 ℃,湿度60%,自由饮食。所有行为学实验操作步骤均严格参照动物伦理协会指导原则进行。
将25 μg/(kg·d)BPA+50 μg/(kg·d)DEHP(溶于玉米油)连续灌胃暴露90 d,同时隔天灌胃给予300 mg/kg(低剂量组)和600 mg/kg(高剂量组)抑肝散乙醇/氯仿提取物(重新溶于玉米油),玉米油作为对照组,构建抑肝散治疗大鼠模型,分为对照组、暴露组、低剂量组和高剂量组,12 只/组。
暴露和给药结束时,通过Y 迷宫实验观察BPA+DEHP 对大鼠短期记忆能力的影响,具体步骤如下:将大鼠放入Y 迷宫三臂交汇处,让其自由探索8 min,记录大鼠正确臂的次数和进臂总次数,计算出自发交替正确率。自发交替正确率=进入正确臂的次数/(进臂总次数-2)×100%。
Y 迷宫实验后,将大鼠禁食过夜,并且在24 h后,大鼠经腹腔注射10%水合氯醛(3 mg/kg)麻醉,并腹膜内注射肝素(1 U/g 体重)以避免血液凝固。然后将海马组织切除,生理盐水冲洗后,称重,保存在4℃下4%液氮中。
1.6 免疫荧光实验 取大鼠海马组织切片,75℃烘片1 h,脱蜡,柠檬酸钠溶液120℃、2.5 min 抗原修复,5%BSA 溶液室温封闭20 min,GFAP(1∶1 500)和nestin(1∶1 500)一抗4℃孵育过夜,PBS 溶液清洗后在切片上滴加羊抗兔IgG-FITC 荧光二抗,37℃避光孵育1.5 h,封片后经荧光显微镜观察(100×)。
1.7 生化法检测 取海马组织液氮反复冻融3 次,4℃条件下800 r/min 离心(5 min)2 次,均取上清。按照试剂盒说明书方法,通过酶标仪根据吸光度检测海马组织中丙二醛、还原型谷胱甘肽含量、总抗氧化能力和caspase-3 活性的变化,通过全自动生化分析仪检测葡萄糖含量的变化。
1.8 线粒体膜电位检测 取海马组织匀浆后,4℃条件下800 r/min 离心(5 min)2 次,均取上清,4℃条件下10 000 r/min 离心10 min,取沉淀在离心管底部的线粒体,洗涤后4℃条件下12 000 r/min 离心10 min,弃上清取线粒体。按照试剂盒说明书方法,通过酶标仪检测海马组织中线粒体膜电位的变化。
1.9 Western 印迹实验 将海马组织剪碎、细胞裂解、收集蛋白,取等量蛋白质以12% SDS-PAGE 分离,然后转移至PVDF 膜上,5%脱脂牛奶封闭后以p-mTOR(1∶2 000)和mTOR(1∶2 000)抗体检测目标蛋白,以HRP 连接的二抗温育,洗涤,显示免疫反应条带,β-actin(1∶5 000)作为内参。
1.10 realtime PCR 实验 海马组织经匀浆器研磨、Trizol 法提取总RNA,通过逆转录试剂盒进行逆转录得到cDNA,通过荧光定量PCR 技术对靶基因以及内参基因GAPDH 进行荧光定量PCR 反应(95℃10 min 后,95℃10 s、60℃30 s,共进行40 个循环),分别取得CT 值,采用2-△△CT法分析各个样品的基因相对表达差异(表1)。

表1 PCR 引物序列Tab 1 PCR primer sequence
1.11 统计学处理 采用SPSS 11.0 软件,数据经过正态性检验符合正态分布,以±s 表示,多组间比较采用单向方差分析(One-way ANOVA),组间多重比较采用LSD-t 检验,以P<0.05 代表差异具有统计学意义。
2 结果
2.1 Neuro-2a 细胞增殖、凋亡和氧化应激 BPA+DEHP 处理可抑制Neuro-2a 细胞体外增殖,诱导凋亡和氧化应激,抑肝散提取物可逆转BPA+DEHP对Neuro-2a 细胞体外增殖、凋亡和ROS 的影响(表2~4)。
表2 Neuro-2a 细胞体外增殖的改变(OD 值,±s,n=10)Tab 2 The changes in Neuro- 2A cell proliferation in vitro(OD value,±s,n=10)

表2 Neuro-2a 细胞体外增殖的改变(OD 值,±s,n=10)Tab 2 The changes in Neuro- 2A cell proliferation in vitro(OD value,±s,n=10)
注:与对照组相比,*P<0.05;与暴露组相比,#P<0.05;与低剂量组相比,ΔP<0.05
组别 0 h 24 h 48 h 72 h对照组 0.11±0.02 0.30±0.04 0.58±0.07 1.03±0.14暴露组 0.11±0.03 0.22±0.05* 0.34±0.05* 0.67±0.08*低剂量组 0.11±0.03 0.28±0.04# 0.47±0.05# 0.75±0.09高剂量组 0.11±0.02 0.29±0.03# 0.55±0.04#Δ 0.86±0.08#Δ F 1.000 7.828 40.002 23.993 P 0.404 0.000 0.000 0.000
表3 Neuro-2a 细胞凋亡率的改变(%,±s,n=3)Tab 3 The changes in apoptosis rate of neuro-2A cells(%,±s,n=3)

表3 Neuro-2a 细胞凋亡率的改变(%,±s,n=3)Tab 3 The changes in apoptosis rate of neuro-2A cells(%,±s,n=3)
注:与对照组相比,*P<0.05;与暴露组相比,#P<0.05;与低剂量组相比,ΔP<0.05
组别 活细胞 早期凋亡 晚期凋亡 死亡细胞对照组 91.87±1.50 1.77±0.45 1.93±0.38 4.43±0.97暴露组 64.80±3.85* 20.97±2.32* 7.67±1.46* 6.57±0.93低剂量组 71.53±6.28 17.47±7.52 6.00±1.31 5.00±0.72高剂量组 82.63±2.64#Δ 8.97±2.43# 3.77±0.51# 4.63±0.51#F 27.072 13.161 17.843 4.376 P 0.000 0.002 0.001 0.042
表4 Neuro-2a 细胞氧化应激水平的改变(±s,n=3)Tab 4 The changes in oxidative stress levels of neuro-2A cells(±s,n=3)

表4 Neuro-2a 细胞氧化应激水平的改变(±s,n=3)Tab 4 The changes in oxidative stress levels of neuro-2A cells(±s,n=3)
注:与对照组相比,*P<0.05;与暴露组相比,#P<0.05;与低剂量组相比,ΔP<0.05
组别 荧光相对强度对照组 露组 1.00±0.08暴2.52±0.72*低剂量组 1.99±0.35#高剂量组 1.38±0.20#Δ F 7.839 P 0.009
2.2 大鼠短期记忆能力分析 各组大鼠Y 迷宫的进臂总次数无统计学差异(P<0.05),BPA+DEHP 暴露组大鼠自发交替正确率显著降低,抑肝散组大鼠自发交替正确率有所提高,其中高剂量组正确率显著提高(P<0.05)(表5),表明BPA+DEHP 可造成大鼠短期记忆能力下降,而抑肝散提取物可抑制BPA+DEHP 对大鼠短期记忆能力的损害。
表5 大鼠短期记忆能力的改变(±s,n=12)Tab 5 The changes in rat short-term memory ability(±s,n=12)
表5 大鼠短期记忆能力的改变(±s,n=12)Tab 5 The changes in rat short-term memory ability(±s,n=12)
注:与对照组相比,*P<0.05;与暴露组相比,#P<0.05
?组别 进臂总次数 自发交替正确率(%)对照组 12.00±3.05 63.88±24.06暴露组 11.42±2.94 46.51±14.97*低剂量组 11.17±3.13 54.87±15.60高剂量组 11.50±2.75 60.26±14.40#F 0.165 2.182 P 0.920 0.104
2.3 大鼠海马组织神经标志物和线粒体膜电位分析 免疫荧光组化实验和realtime PCR 结果均显示,BPA+DEHP 暴露组大鼠海马组织中GFAP 表达上调,nestin 表达下调,海马组织线粒体膜电位显著降低,抑肝散组大鼠海马组织GFAP 表达下调,nestin表达上调,线粒体膜电位显著提高,且高剂量组高于低剂量组,表明BPA+DEHP 可损伤大鼠海马组织神经元和线粒体功能,而抑肝散提取物可抑制BPA+DEHP 的上述毒性作用(图1,表6)。
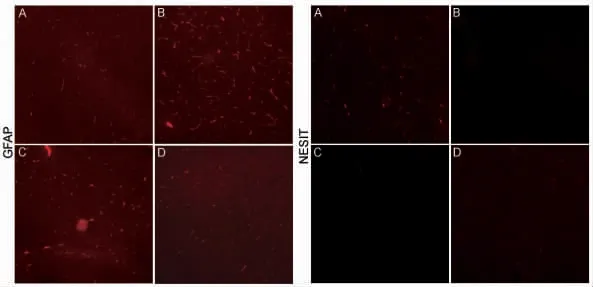
图1 大鼠海马组织中神经标志物的表达Fig 1 The expression of neural markers in rat hippocampus
表6 大鼠海马组织神经标志物mRNA 和线粒体膜电位的改变(±s,n=12)Tab 6 The changes of neuronal marker mRNA and mitochondrial membrane potential in rat hippocampus(±s,n=12)

表6 大鼠海马组织神经标志物mRNA 和线粒体膜电位的改变(±s,n=12)Tab 6 The changes of neuronal marker mRNA and mitochondrial membrane potential in rat hippocampus(±s,n=12)
注:与对照组相比,*P<0.05;与暴露组相比,#P<0.05;与低剂量组相比,ΔP<0.05
组别 GFAP对照组 1.00±0.07暴露组 1.35±0.23*低剂量组 1.23±0.09*高剂量组 1.12±0.05*#Δ F 15.742 P 0.000 nestin 1.00±0.07 0.76±0.07*0.80±0.05*0.90±0.07*#Δ 32.283 0.000 MMP 1.00±0.10 0.55±0.12*0.76±0.11*#0.90±0.09*#Δ 40.922 0.000
2.4 大鼠海马组织氧化和葡萄糖消耗分析 BPA+DEHP 暴露组大鼠海马组织中Glu、T-AOC 以及还原性物质MDA 和GSH 水平显著降低,抑肝散组大鼠Glu、T-AOC、MDA 和GSH 水平显著提高(P<0.05)(表7),表明BPA+DEHP 可增强大鼠海马组织氧化反应,而抑肝散提取物可增强大鼠海马组织中的抗氧化能力,可能与降低大鼠脑组织葡萄糖消耗有关。
表7 大鼠海马组织氧化和葡萄糖水平的改变(±s,n=12)Tab 7 The changes of oxidation and glucose in rat hippocampus(±s,n=12)

表7 大鼠海马组织氧化和葡萄糖水平的改变(±s,n=12)Tab 7 The changes of oxidation and glucose in rat hippocampus(±s,n=12)
注:与对照组相比,*P<0.05;与暴露组相比,#P<0.05
GSH(μmol)对照组 4.28±0.67 3.16±0.38 3.54±0.83 5.15±0.73暴露组 2.44±0.58* 2.81±0.56 2.49±0.50* 2.49±0.62*低剂量组 3.92±0.73# 3.00±0.51 2.98±0.65 3.98±0.74*#高剂量组 4.07±0.79# 3.17±0.28 3.28±0.54# 4.02±0.94*#F 17.363 1.722 5.899 24.331 P 0.000 0.176 0.002 0.000组别 T-AOC(mmol/mg prot)Glu(mmol/L)MDA(nmol/mg prot)
2.5 海马组织凋亡和信号通路活性 BPA+DEHP暴露组大鼠海马组织capase-3 活性显著上调[暴露组(1.35±0.11)vs.对照组(1.00±0.08)](P<0.05);高剂量抑肝散组capase-3 活性显著下调 [低剂量组(1.29±0.07)vs.暴露组(1.35±0.11)](P<0.05)[高剂量组(1.19±0.10)vs.暴露组(1.35±0.11)](P<0.05),且高剂量组显著低于低剂量组(P<0.05),表明BPA+DEHP 的神经毒性可能与诱导大鼠海马组织神经元凋亡有关,而抑肝散提取物可缓解神经元凋亡。
BPA+DEHP 暴露组大鼠海马组织mTOR 磷酸化水平下调,抑肝散组mTOR 磷酸化上调,且高剂量组磷酸化低于低剂量组,表明BPA+DEHP 的神经毒性可能与诱导mTOR 磷酸化有关,而抑肝散提取物可抑制mTOR 磷酸化(图2)。

图2 大鼠海马组织中p-mTOR 和mTOR 的表达Fig 2 The expression of p-mTOR and mTOR in rat hippocampus
3 讨论
EEDs 是一种广泛存在的危险化学物质,可对人体内分泌、神经、免疫和生殖系统功能产生广泛的危害[5-6]。本课题组前期研究发现,苯并[a]芘暴露可以抑制人胚胎干细胞来源拟胚体的体外增殖,诱导细胞凋亡,抑制间充质转变和Akt/GSK-3β 信号通路活性,提示EEDs 具有显著的神经毒性[7]。本研究发现,将BPA+DEHP 与小鼠神经母细胞瘤细胞Neuro-2a细胞共培养,也可以抑制细胞体外增殖,诱导细胞凋亡并产生氧化损伤。体内实验中,大鼠经BPA+DEHP灌胃暴露90 d 后,其短期记忆能力下降,证实了BPA+DEHP 可损伤神经功能的假设。
中枢神经系统中星形胶质细胞增生是退行性病变及中枢神经损伤引发神经组织变化的主要表现[8-9]。GFAP 是星形胶质细胞特异性标志物,与微管和微丝构成神经元细胞的骨架,维护星形胶质细胞形态稳定,参与神经递质循环、营养支持、突触功能调节等多种神经功能[10-11]。Nestin 是特异性的表达于神经上皮干细胞上的一种中间丝类型的蛋白,是神经干细胞的特征性标志物[12-14]。本研究发现,BPA+DEHP 暴露可导致大鼠海马组织中GFAP 表达上调,nestin 表达下调,细胞凋亡早期标志线粒体膜电位下降、caspase-3 活性升高和mTOR 磷酸化下调,证实了BPA+DEHP 可损伤神经细胞增殖能力,诱导细胞凋亡的体外实验结果,并提示BPA+DEHP 的神经毒性可能与抑制mTOR 信号通路活性有关。
本研究发现,BPA+DEHP 增强海马组织氧化反应可能与提高大鼠脑组织葡萄糖消耗有关。结合前期研究,笔者认为EEDs 首先通过抑制生长和凋亡造成神经元损伤[7],机体通过增强能量和营养供给修复神经元的损伤,但是由于过度氧化应激激活凋亡途径,进一步的加重了神经元损伤,最终造成神经失能。
中医理论认为“肝脑相维”,肝主疏泄,又主藏血,气机调畅,气血和调,则脑清神聪,疏泄失常,则情志失调。抑肝散中包括钩藤、柴胡、茯苓、白术、川芎、当归、甘草,其中钩藤钩有平肝镇静的作用,与柴胡、甘草合用可缓解肝气亢盛,镇静神经兴奋。当归和川芎滋润肝血,促进肝脏血液循环,疏通肝血,缓解肝气亢盛,茯苓和白术可以调节肝气,缓解交感神经紧张。本研究通过乙醇/氯仿提取抑肝散中黄酮等活性成分,并证实可抑制BPA+DEHP 的神经毒性,其机制可能与增强大鼠海马组织中的抗氧化能力并调节糖代谢紊乱,进而缓解由于氧化应激造成的神经元凋亡和神经损伤有关,并为传统方剂抑肝散的新剂型开发提供了研究基础。
