乳腺良性病变误诊为乳腺癌临床分析
2022-03-24龙天柱扶本洁潘玉鸿宁梓妤蔡媛璇马宏民
龙天柱,扶本洁,李 铨,张 蕊,潘玉鸿,宁梓妤,蔡媛璇,马宏民
乳腺超声(US)和数字化乳腺X线摄影(DM)是诊断乳腺疾病最常用的医技检查方法。对于部分可疑病变补充乳腺MRI检查有助于进一步提高早期乳腺癌的检出率[1]。既往研究指出,在中国人群中单一US诊断乳腺癌的阳性预测值可以高达94.2%,单一DM也高达95.0%,而二者联合还能进一步提高到98.6%[2],说明无论应用何种检查方法诊断乳腺癌均具有极高的准确性;当两种方法都一致指向乳腺癌诊断的时候,基本就可以“确诊”为乳腺癌。然而受限于现有检查方法的局限性,仍无一种影像学检查方法能够达到100%的特异性,意味着误诊依然不可避免,即使再高的阳性预测值依然不能作为确诊的依据,只有组织病理检查才是唯一的金标准[3]。过分迷信影像学检查的结论可能导致误诊误治,值得临床关注。为此在临床诊治过程中需要不断总结经验,以提高乳腺癌的诊疗水平。本研究对2013年11月—2016年4月我院收治4例误诊为乳腺癌的乳腺良性病变的临床资料进行回顾分析,报告如下。
1 病例资料
【例1】女,56岁。因“体检发现左乳肿物3个月余”入院。临床查体阴性。US:左乳(1-1)可见大小为7 mm×6 mm×7 mm低回声肿物,形态不规则,边界欠清、毛糙,内部回声欠均匀,后方回声无明显变化。彩色多普勒血流显像(CDFI):未见明显血流信号;右乳乳腺影像报告与数据系统(BI-RADS)1类,左乳BI-RADS 4c类。DM:左乳头后上方大小1.3 cm×0.9 cm密度增高毛刺状肿块,周边毛刺长短不一,并见低密度水肿带环绕,其后方见多枚粗细不一钙化点聚集;左乳BI-RADS 5类,右乳BI-RADS 2类。X线胸片:右肺中侧带见一小结节影,边界尚清晰,直径为6.2 mm;请结合临床,建议进一步检查。遂行胸部CT:右肺小钙化灶;肝脏多发低密度灶,请结合临床,待排除转移瘤。进一步追问病史,患者有肺结核病史,已治愈。临床诊断:左乳肿物恶性待排。行左乳肿物切除活检术,切除区段组织送放射科X线摄片:标本内含原左乳头后上方小团块多枚粗细不一钙化聚集灶。确认病灶已切除,送术中快速病理检查:(左乳)多个导管增生性病变,未见明确的癌,具体待石蜡病理检查。术后石蜡病理检查:(左乳)镜下见部分乳腺导管普通型增生,个别导管上皮轻度异型性,建议随访。术后诊断:左乳腺增生病。
【例2】女,44岁。因“发现右乳肿物3年”入院。观察期间右乳无痛性肿物进行性增大。临床查体:右乳(1-1)扪及大小为3.5 cm×3.0 cm质中活动肿物,光滑,边界清,伴压痛,与周围组织无粘连。双侧腋窝未扪及明显增大淋巴结。US:右乳(1-1)见大小为32 mm×18 mm×24 mm低回声肿物,边界模糊,似为水肿带,小分叶状,内部回声不均,内见无回声区,后方回声无明显变化。CDFI:肿瘤周围可见点条状血流信号;右乳BI-RADS 5类,左乳BI-RADS 3类。DM:右乳后上方大小为3.6 cm×2.7 cm分叶状肿块,密度明显增高,部分边界毛糙,血运丰富,右乳晕及其上方部分皮肤增厚;右乳BI-RADS 5类,左乳BI-RADS 2类。胸腹部CT:结合临床,考虑右侧乳腺癌并局灶坏死;双肺纹理增强;肝、胆、脾、胰及双肾未见明显异常。临床诊断:右乳肿物恶性待排。行右乳肿物空芯针穿刺活检术,病理回报:(右乳)穿刺组织镜下为腺上皮局部密集,肌上皮存在,部分区域纤维组织增生,乳腺小叶结构破坏;改变符合乳腺硬化性腺病,伴纤维腺瘤形成。遂进一步行右乳肿块切除术,术后石蜡病理检查:(右乳)乳腺纤维腺瘤伴局灶缺血性改变。术后诊断:右乳腺纤维腺瘤。
【例3】女,50岁。因“体检发现右乳肿物2 d”入院。临床查体:右乳(11-2)扪及大小为2.0 cm×1.8 cm质中肿块,边界欠清,活动一般,深压痛,双腋下未扪及明显增大淋巴结。US:右乳(11-2)见大小为7 mm×4 mm×5 mm低回声肿块,边界欠清,形状欠规则,纵横比>1,内部回声不均,可见强回声光点,部分后方回声衰减。CDFI:未见明显异常血流信号;右乳BI-RADS 5类,左乳BI-RADS 1类。DM:右乳外上见1.9 cm×1.5 cm大小肿块影,内杂密集泥沙状钙化;右乳BI-RADS 5类,左乳BI-RADS 1类。行右乳肿物切除活检术,切除区段组织送放射科X线摄片:原钙化灶已切除。送术中快速病理检查:(右乳)乳腺增生病伴大汗腺化生,部分导管上皮增生活跃,确诊待石蜡病理检查。术后石蜡病理检查:(右乳)乳腺增生病,腔内可见钙盐沉积,局部终末小叶单位上皮细胞柱状变。术后诊断:右乳腺增生病。
【例4】女,56岁。因“体检发现左乳肿物1周”入院。临床查体阴性。US:左乳(10-2)见大小为4 mm×6 mm×6 mm不规则低回声肿块,内部回声均匀,纵横比>1,后方回声无明显变化。CDFI:未见明显异常血流信号;左乳BI-RADS 4b类,右乳BI-RADS 1类。DM:左乳后区偏内侧见一大小为0.9 cm×0.8 cm星芒状影,周边可见长短不一毛刺;左乳BI-RADS 4c类,右乳BI-RADS 1类。乳腺MRI:左侧乳腺内侧象限(9点钟位置)可见一斑片状影,大小为5 mm×5 mm,边缘欠清,毛刺征不明显,在T2WI上呈稍高信号,在T1WI上呈等信号。动态增强肿块呈明显强化,动态增强曲线呈持续上升型;左乳BI-RADS 4b类。行左乳区段切除活检术,切除区段组织送放射科X线摄片:确定病灶已完全切除。术后石蜡病理检查:(左乳)乳腺增生病,伴个别导管上皮非典型增生。术后诊断:左乳腺不典型增生。
2 结果
2.1影像学检查分析 4例均以乳房肿块为主诉就诊,其中左侧2例,右侧2例;肿块可触及2例,肿块未触及2例。病例1的US表现为肿物边界毛糙,内部回声欠均匀(图1a);DM表现为长短不一的毛刺状高密度影,见粗细不一钙化点聚集(图1b)。病例2的US表现为肿物边界模糊,似为水肿带,肿瘤内可见液性暗区,肿瘤坏死可能(图1c);DM表现为分叶状肿块密度明显增高,血运丰富,伴表面皮肤水肿(图1d)。病例3的US表现为形状欠规则肿物,纵横比>1,可见强回声光点,部分后方回声衰减(图1e);DM表现为内见泥沙样钙化肿块影(图1f)。病例4的US表现为形态不规则低回声肿块,纵横比>1(图1g);DM表现为星芒状长短不一毛刺影(图1h)。

图1 4例类似乳腺癌临床表现良性疾病的US及DM图像
本组4例术前US均满足至少2项恶性征象,BI-RADS分类:1例4b类,1例4c类,2例5类;4例均高度怀疑乳腺癌。术前DM的BI-RADS分类:1例4c类,3例5类。3例表现为肿块,1例为结构扭曲;符合恶性钙化2例,可见星芒状毛刺2例,可见表面皮肤增厚1例。4例DM检查均存在典型的恶性表现,符合乳腺癌诊断。
本组DM表现为结构扭曲患者术前行乳腺MRI检查,MRI提示左侧乳腺内侧象限乳腺斑片影,动态增强曲线呈持续上升型,BI-RADS 4b类。有3例因病变较小,切除病变组织后行术中X线摄片(图2),确认病灶已完全切除,并行可疑病变部位标记。
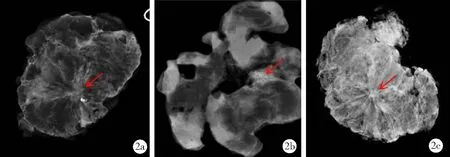
图2 3例类似乳腺癌临床表现良性疾病病灶区段切除标本术中X线摄片
2.2病理检查结果 本组中1例术前行空芯针穿刺活检,病理诊断为良性;2例术中送快速病理检查,均提示良性病变;而4例病变组织术后石蜡病理检查均不支持恶性诊断,其中1例为乳腺不典型增生,1例为乳腺纤维腺瘤伴局部缺血性改变,2例为乳腺增生病。
2.3治疗及随访情况 本组诊断为乳腺不典型增生患者术后予以他莫昔芬预防治疗5年,其余3例未予进一步干预。4例均按医嘱定期复查,最长1例至今随访8年,最短1例随访也超过5年,未出现复发或进展为乳腺癌。
3 讨论
3.1疾病概述 乳腺癌近年来发病率逐渐增高,患病人数也不断增加,2020年全球肿瘤学年报显示,女性乳腺癌已超越肺癌成为全球第一的癌症[4]。而我国乳腺癌早已成为女性恶性肿瘤的第一位[5]。乳腺癌的规范诊治值得临床重视,其治疗的前提在于准确诊断,而乳腺癌除了临床查体以外,常用的医技检查方法有US、DM以及乳腺MRI[6]。乳腺X线检查是目前全球公认诊断乳腺癌最有效的手段。循证医学证据表明,乳腺X线检查是唯一能用于筛查早期诊断乳腺癌并降低乳腺癌病死率的有效检查手段[7]。然而亚裔女性乳房多为致密型,病变在X线下对比显示不清,容易漏诊。故在我国US是作为一项独立的检查方法,用于诊断乳腺疾病[8]。国内研究表明,US对于乳腺癌诊断无论是敏感性或特异性均较DM高[9]。国外有研究针对8103例临床查体及乳腺X线检查阴性的致密型乳腺人群,使用乳腺高频超声检查,发现乳腺癌32例,检出率为0.39%,检出肿瘤平均直径9.1 mm[10]。对于致密型乳腺,高频超声检查价值不容忽视。目前,国内对于乳腺癌的诊断,已很少依靠单一DM或US。越来越多证据显示,DM联合US能大大提高乳腺癌的检出率及准确率[11-12]。
部分恶性病例在US及DM下均为阴性表现,造成了漏诊;还有部分良性病例在US及DM均为阳性表现,造成了误诊。以往大家对漏诊重视较多,很少见到临床研究对乳腺癌误诊的报道,但临床误诊病例同样值得重视,需要不断总结经验,降低误诊率,提高临床的诊治水平。
3.2误诊原因分析 现回顾4例有乳腺癌典型临床表现的良性疾病发现,患者年龄均为围绝经期前后或绝经后,属于我国女性乳腺癌的高发年龄段[13]。虽然DM或US表现不同,但都有共同点就是具备恶性肿瘤表现特征,所以无论US还是DM诊断级别都是BI-RADS 4b类或以上。每例US检查均至少存在2项恶性征象,DM检查亦符合典型的恶性表现。导致误诊可能是主观因素,但是客观因素更是不可避免;可能是现有条件的限制,也可能是技术本身存在的缺陷。
本组无论哪个病例,单纯依靠US或DM均会做出可能恶性的诊断,且二者联合检查不谋而合时,恶性诊断的“把握”进一步加大。病例1诊治过程中出现的“转移”假象也进一步“坚定”了恶性肿瘤的判断。肺内病灶是乳腺癌好发的转移部位;所幸结合既往史及胸部CT检查做出了鉴别,肺内考虑为陈旧的结核灶钙化。病例2病史符合典型的乳腺癌病程,无痛性增大肿块。因X线胸片提示肺纹理增粗行胸部CT检查,做出乳腺癌伴局部坏死的诊断,从侧面进一步说明影像学下乳腺癌的表现典型。良性肿瘤生长缓慢,极少出现坏死[14];而恶性肿瘤生长速度快,易出现乏血供瘤内局灶坏死,所以乳腺癌肯定是首先考虑的诊断。病理确诊前高度怀疑恶性,病例2在穿刺诊断为良性病变时仍考虑不排除假阴性的可能[15]。病例4则有乳腺MRI的进一步佐证,动态增强曲线呈持续上升型,BI-RADS 4b类。研究显示,乳腺MRI结合动态增强曲线可进一步提高乳腺癌诊断的准确率[16-17]。
本组4例出现误诊的主要原因在于客观因素,即现有的医技检查手段无法鉴别这些具有恶性影像学表现的良性病例;但这种情况只是“个别”现象,并不具有普遍性。
3.3防范误诊措施 术前准确做出乳腺癌诊断,需要以下多方面措施:①详细的病史采集和全面的专科查体是做出正确临床诊断的首要条件;②影像学医生对自身严格要求,不断总结经验,提高诊断水平;③对于可疑病变需联合多种辅助检查方法,相互印证,进一步提高诊断的准确性;④需意识到术前穿刺可能存在病理低估现象,即使病理检查回报为良性,对于临床高度怀疑的恶性病变,随访观察可能是不适合的,仍建议进一步完整切除病理活检,避免漏诊[15];⑤对于DM显示不可触及的结构扭曲或钙化灶,根据术前定位设计切除范围,切除后术中X线摄片有助于确认病灶是否切除,且在标本上确定病变位置,提高活检的准确性[3];⑥从技术层面研发新型乳腺辅助检查方法,在考虑解剖结构改变的基础上,同时引入病理生理学指标,进一步提高乳腺癌诊断准确率[18-20]。
总之,乳腺癌基于典型的临床表现大多可做出临床诊断,而其中影像学检查更是充当着重要的角色;且随着辅助检查技术的不断进步和优化,临床医生对辅助检查表现出更大的依赖性,但是辅助检查终究只是辅助,最终的确诊需要依靠病理检查。由于临床表现高度符合乳腺癌的乳腺良性病变不典型病例具有欺骗性,影像学等辅助检查只是参考,不能单纯根据影像学检查做出定性诊断,只有病理检查确诊为乳腺癌的前提下才能按照乳腺癌进行规范治疗,避免误诊误治。
