慢性盐负荷对成年人血清和尿液中尿调节素水平的影响
2022-03-24牛泽家馨胡桂霖闫睿晨杜鸣飞张晓玉廖月圆王科科
汪 洋,牛泽家馨,王 兰,胡桂霖,闫睿晨,杜鸣飞,邹 婷,张晓玉,褚 超,廖月圆,马 琼,袁 悦,严 瑜,孙 月,王科科,王 丹
贾 昊1,周浩伟1,陈 晨1,张 玺1,张 婕3,胡佳文4,高卫华5,高 可1,牟建军1
(1.西安交通大学第一附属医院心内科,陕西西安 710061;2.西安国际医学中心医院心内科,陕西西安 710075;3.西安市人民医院心内科,陕西西安 710004;4.西安交通大学第一附属医院心外科,陕西西安 710061;5.西安市第一医院心内科,陕西西安 710002)
高血压是心血管疾病的全因死亡风险的重要因素,已成为世界范围内沉重的公共卫生负担[1-2]。高盐饮食是高血压的重要环境因素。高盐能够显著升高血压,而限盐则可降低高血压及心血管事件的发生风险[3-4]。尿调节素是由肾脏的髓袢升支粗段和远曲小管合成的一种糖蛋白[5],大部分通过尿道从尿液中排泄,发挥着抗炎、抗感染和调节电解质平衡的作用,少量的尿调节素进入血液中[6-8]。有研究表明,高盐摄入显著增加大鼠肾脏尿调节素的表达水平,促进尿液中尿调节素的排泄[9-10]。然而,对于血液中尿调节素在高血压患者中的水平,以及人群中饮食盐摄入与尿液中尿调节素水平之间的关系,目前尚无相关报道。本研究通过本课题组建立的人群干预队列,探讨高血压患者血清尿调节素的水平,以及盐摄入对血清和尿液中尿调节素水平的影响。
1 对象与方法
1.1 研究对象
在陕西省礼泉县和蓝田县的两个村招募18岁以上的成年志愿者,性别不限。经问卷调查及体格检查后,排除有严重心血管疾病史、糖尿病、肝肾功能不全、继发性高血压患者,以及急慢性感染者、酗酒者或服用降压药、激素、非甾体类抗炎药等可能对研究结果造成影响的药物使用者,和不愿签署知情同意书或不能配合完成整个试验的受试者。具体的纳入和排除标准参照本课题组既往研究[11-12]。最终共纳入80名研究对象。所有受试者均签署知情同意书。
1.2 基线调查和饮食干预
由专业医师对所有受试者进行为期3 d的基线调查,包括问卷调查(病史询问、生活方式、家族史);测量身高、体质量、腰围、臀围和血压。随后对80名受试者开始为期2周的慢性盐负荷饮食干预,依次为:低盐期(1周):每天摄盐3 g(相于钠51.3 mmol/d),即早餐无盐,午餐及晚餐各1.5 g。高盐期(1周):每天摄盐18 g(相当于钠307.8 mmol/d),即早、中、晚三餐各6 g盐。本研究请专业厨师加工食物以保证食物本身不含任何盐和含盐制品,就餐时由专业医师负责将称量好的盐包撒入食物中,为了确保依从性,受试者在整个干预期间必须在研究厨房吃完早餐、午餐和晚餐。具体的饮食干预操作流程参照本课题组既往研究相应流程[11-15]。本研究得到了西安交通大学第一附属医院伦理委员会的批准。
1.3 血压测量
基线期和饮食干预期的第5、6、7天采用标准水银血压计进行血压测量。具体血压测量方法参照本课题组既往研究[11-15]。每一阶段进行3 d血压测量,将9次血压的平均值纳入最后的统计分析。平均动脉压=2/3舒张压+1/3收缩压。按照《中国高血压防治指南2018年修订版》,在基线期根据血压水平将受试者分组:收缩压≥140 mmHg和(或)舒张压≥90 mmHg(1 mmHg=0.133 k Pa),或目前正在使用降压药物治疗者为高血压组;收缩压<140 mmHg和舒张压<90 mmHg为血压正常组[16]。
1.4 血、尿标本的采集
每轮饮食干预的最后一天留取血标本及24 h尿标本。清晨空腹静脉采4 mL非抗凝血,3 000 r/min离心15 min,分离血清标本于-80℃冷冻保存待测。
1.5 生化指标的测定
采用Hitachi 7060全自动生化分析仪(日立,日本)检测血生化指标,包括总胆固醇、三酰甘油、低密度脂蛋白、高密度脂蛋白、血尿酸、丙氨酸氨基转移酶(ALT),天冬氨酸氨基转移酶(AST)、血钠、血钾、血肌酐、空腹血糖和尿生化指标(包括尿钠和尿钾浓度)。
血清和尿液中尿调节素水平通过酶联免疫吸附测定(ELISA)试剂盒(Cusabio Biotech,武汉,中国)测定。试剂盒的批内和批间系数差异分别为2.1%~5.2%和3.8%~6.5%。
1.6 统计学分析
采用SPSS 16.0统计软件进行统计分析。变量的分布情况采用Kolmogorov-Smirnov检验进行正态性检验。正态分布的连续变量用均数±标准差(±s)表示,非正态分布的用中位数(四分位间距)表示,分类变量用频数表示。各期血清和尿液中尿调节素水平差异比较采用重复测量的方差分析。采用独立样本t检验进行高血压和血压正常组间差异比较。采用Pearson或Spearman相关性分析24 h尿钠排泄与血清和尿液中尿调节素水平的关系。P<0.05为差异有统计学意义。
2 结 果
2.1 受试者基线期的一般特征
所有80名受试者均完成了饮食干预试验。在基线期,高血压组受试者体质指数、收缩压、舒张压、平均动脉压、空腹血糖显著高于血压正常组(表1)。

表1 受试者基线期的一般特征Tab.1 Baseline demographic and clinical characteristics
此外,高血压组血清中尿调节素水平显著低于正常 血 压 组[(26.7±9.9vs.57.9±9.7)ng/mL,P=0.033]。然而,尿液中尿调节素排泄量在两组间无明显 差 异[(227.5±58.6vs.295.7±86.4)ng/mL,P=0.819](图1)。

图1 高血压组与血压正常组血清(A)和尿液(B)中尿调节素水平的比较Fig.1 Serum(A)and urinary(B)levels of uromodulin in hypertensive and normotensive groups
2.2 盐摄入对受试者血压和24 h尿钠钾排泄的影响
与基线期相比,低盐饮食期受试者收缩压水平显著降低,而高盐饮食期受试者的收缩压和舒张压明显升高(P<0.05);24 h尿钠排泄量在低盐期较基线期明显降低,高盐负荷后明显升高(P<0.05);受试者基线期、低盐期、高盐期24 h尿钾无显著性差异(表2)。这提示受试者对饮食干预具有很好的依从性。
表2 受试者各阶段血压和24 h尿钠钾的比较Tab.2 Blood pressure levels and 24 h urinary sodium and potassium excretions at baseline and during dietary interventions (±s)

表2 受试者各阶段血压和24 h尿钠钾的比较Tab.2 Blood pressure levels and 24 h urinary sodium and potassium excretions at baseline and during dietary interventions (±s)
与基线期比较,#P<0.05;与低盐期比较,*P<0.05。
组别基线期低盐期高盐期24 h尿钾排泄(mmol/24 h)37.9±19.1 35.8±16.3 37.5±16.2收缩压(mmHg)116.9±16.4 112.4±12.7#122.0±18.3*舒张压(mmHg)75.3±9.3 75.6±8.2 78.7±9.0*平均动脉压(mmHg)89.2±10.8 87.9±9.0 93.1±11.3*24 h尿钠排泄(mmol/24 h)172.1±71.8 91.2±38.1#266.7±71.3*
2.3 盐摄入对血清和尿中尿调节素水平的影响
与基线期相比,高盐饮食期受试者血清中尿调节素水平(ng/mL)明显降低(54.9±8.8vs.28.3±4.5,P=0.007);高盐期受试者尿液中尿调节素排泄量为(28.4±6.6)ng/mL,显 著 低 于 基 线 期 的(282.1±70.0)ng/mL和低盐期的(154.1±21.3)ng/mL(图2)。
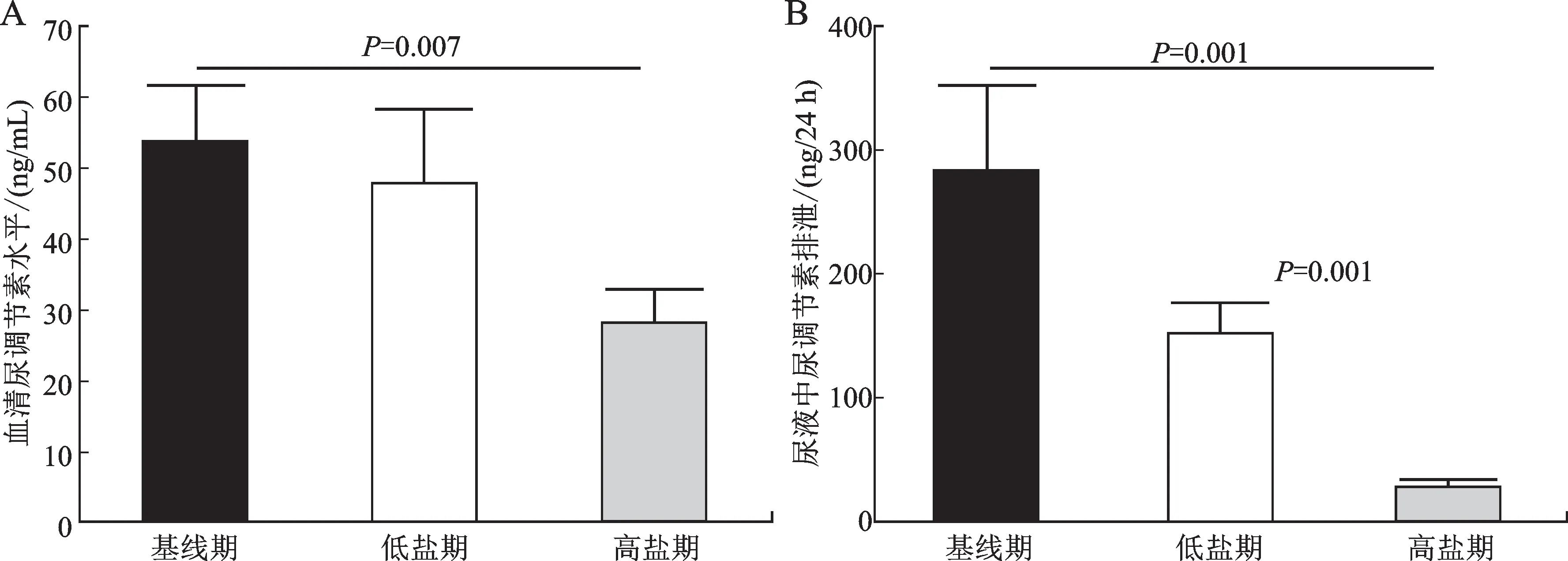
图2 盐摄入对受试者血清(A)和尿液(B)中尿调节素水平的影响Fig.2 Effects of salt intake on plasma(A)and urinary(B)uromodulin levels in all subjects
相关性分析结果显示,24 h尿钠排泄与尿液中尿调节素排泄呈显著负相关(r=-0.40,P<0.001),而与血清中尿调节素水平无相关性(r=-0.129,P=0.133,图3)。

图3 受试者24 h尿钠排泄与尿液(A)和血清(B)中尿调节素水平的关系Fig.3 Correlations of 24 h urinary sodium excretions with serum uromodulin levels(A)and urinary uromodulin excretions(B)in all subjects
3 讨 论
尿调节素是一种95 ku的糖蛋白,也称为Tamm-Horsfall蛋白,由位于染色体16p12.3上的UMOD基因编码[6-7]。尿调节素由肾脏的髓袢升支粗段和早期的远曲小管合成,其中大部分尿调节素从肾小管分泌至尿道中,在生理条件下发挥抗炎、抗感染和调节电解质平衡的作用[6-8]。此外,小部分尿调节素也从基底外侧分泌到细胞间隙中,进一步进入到血液中[5]。然而,血液中尿调节素的生理功能尚不清楚。有研究表明,血清尿调节素可以作为反映肾功能损伤的敏感标志物[17-18]。
近年的研究表明,尿调节素可能参与血压的调节和高血压的发展。PADMANABHAN等[19]通过全基因组关联分析(GWAS)发现,在编码尿调节素的UMOD基因中发现了与血压表型和高血压相关的常见突变位点。也有在不同人群中UMOD基因突变与高血压的相关性报道[19-21]。此外,GRAHAM等[22]研究发现,尿调节素基因敲除小鼠的收缩压比野生型显著降低,且对盐诱导的血压变化产生抵抗,表现为血压-尿钠曲线的左移。通过对比研究发现,当尿调节素表达和排泄增加时,尿调节素过表达可以导致血压的剂量依赖性升高[23]。这些研究提示髓袢升支粗段中的钠离子交换是尿调节素和高血压之间的联系。本研究首次发现,高血压患者血清中尿调节素水平显著低于血压正常组,提示尿调节素可能参与高血压的形成。
有研究显示,高盐摄入能够增加大鼠肾脏中尿调节素的mRNA和蛋白质水平[10]。TORFFVIT等[9]在30名高血压受试者中发现,高盐饮食能够降低24 h尿液中尿调节素排泄率。然而,尚不清楚有关在人群中饮食的盐摄入与血液中尿调节素水平之间的关系。本研究通过人群干预试验首次发现,高盐饮食可显著降低尿液中尿调节素的排泄,且高盐同时降低血清中尿调节素水平。
目前关于盐摄入对血、尿中尿调节素水平影响的具体机制仍不明确。GRAHAM等[22]观察到一个有趣的现象,即仅在低盐饮食时,携带尿调节素突变位点rs13333226的G等位基因个体尿调节素排泄较低,而在高盐饮食时这种关系并不明显,这提示尿调节素的分泌受到基因与环境的相互作用。另外,尿液中尿调节素的排泄减少可能是由于低盐饮食过程中尿钠排泄减少所致。而高盐摄入能够增加钠的尿液浓度,进而降低24 h尿液中尿调节素的尿液浓度。本研究也发现24 h尿钠排泄与尿液中尿调节素排泄呈显著负相关,这可能是由于尿调节素的排泄与远端小管钠的重吸收率有关[23]。然而,具体机制有待进一步研究阐明。
综上所述,本研究通过课题组建立的人群干预试验发现,饮食的盐摄入能够显著影响血清和尿液中尿调节素水平,且高血压患者血清中尿调节素水平显著低于血压正常组。本研究为进一步探索尿调节素与血压、盐摄入的关系提供新的思路及研究方向。然而,本研究未考虑其他可能影响尿调节素水平的因素,因此仍需进一步研究探讨其影响因素。此外,本研究仍存在人群样本量相对偏小,且人群局限于中国北方汉族人群等不足之处。因而研究结果有待于在不同种族、不同民族、不同地区的人群中进一步加以验证。
