TGF-β1、HIF-1α在结直肠癌组织中的表达及临床意义
2022-03-24李海飞冯承保刘锦燕
李海飞,冯承保,刘锦燕
结直肠癌是一种常见的恶性肿瘤,其发病率居全身恶性肿瘤第3位,仅次于肺癌和胃癌,随着饮食结构和生活方式的改变,结直肠癌发病率呈逐渐上升趋势,严重威胁人们身心健康[1]。结直肠癌发病隐匿,早期症状不明显,容易因延误病情而降低治疗预后。探索结直肠癌发生发展机制,对于临床医生拟定合理治疗方案和改善患者预后具有重要意义。转化生长因子-β1(transforming growth factorβ1,TGF-β1)是由细胞自分泌或旁分泌产生的多功能生物因子,能促进细胞异质化,加快肿瘤血管的生成[2];缺氧诱导因子-1α(HIF-1α)则是一种DNA结合蛋白,当机体缺氧时,HIF-1α会在细胞内大量聚集[3]。有研究发现,TGF-β1和HIF-1α在肺癌、卵巢癌等肿瘤组织中表达量升高,参与肿瘤细胞增殖、分化、迁移以及肿瘤血管生成过程,但两者在结直肠癌病理中的具体作用机制尚不清楚[4]。本研究通过检测结直肠癌及正常癌旁组织中TGF-β1、HIF-1α的表达,分析其与临床病理特征及预后的关系,以期为结直肠癌的治疗提供依据。
1 对象与方法
1.1对象 收集2014年1月~2015年12月在保定市第二医院就诊并手术切除的80例结直肠癌患者病灶组织标本,其中男性42例,女性38例;年龄41~78岁,平均(63.58±8.79)岁;结肠36例,直肠44例;高分化11例,中分化47例,低分化22例;淋巴结转移56例,无淋巴结转移24例;TNM分期Ⅰ~Ⅱ期28例,Ⅲ~Ⅳ期52例。选取每例患者癌旁正常组织作为对照。纳入标准:经临床病理学诊断确诊为结直肠癌[5];尚未接受放疗、化疗等治疗措施;病理分期明确;临床及病理资料完整。排除标准:严重心肝肾等脏器功能异常;合并免疫性疾病、血液疾病等;伴有息肉病、炎症性肠病等肠道疾病;合并其他系统肿瘤或转移瘤;已接受放化疗而导致病理组织形态改变;临床资料不完整,随访资料不全。
1.2方法 采集手术切除的癌组织及癌旁组织标本,经4%甲醛固定,常规石蜡包埋备用。取出石蜡标本,连续切片(厚4μm),60℃烤箱内烤片,二甲苯脱蜡,梯度乙醇浸泡水化,再以3%过氧化氢孵育请去除内源性过氧化物酶,磷酸盐缓冲液(PBS)冲洗抗原修复。加入山羊血清封闭30 min,加入TGF-β1、HIF-1α一抗,4℃孵育过夜;PBS溶液冲洗3次,滴加二抗,37℃孵育1 h;PBS溶液冲洗,加入DAB显色液染色,苏木精复染,然后脱水、透明、封片,光学显微镜下阅片。
每份切片随机选10个200倍视野观察,首先依据染色程度评分,不着色0分,黄色1分,棕黄色2分,深褐色3分;再依据染色细胞比例评分:≤25%为1分,25%~50%为2分,51%~75%为3分,>75%为4分。两种评分乘积为免疫组化得分,≤4分判定为阴性,>4分判定为阳性。
1.3随访 以电话或门诊复查方式进行定期随访,记录研究对象出院后5年内生存情况,随访截止至患者死亡或5年随访期结束。
1.4统计学处理 采用SPSS 19.0统计软件进行数据分析,计数资料以(%)表示,用χ2检验;采用Spearman法分析TGF-β1、HIF-1α表达的相关性,应用Kaplan-Meier曲线分析TGF-β1、HIF-1α表达与结直肠癌患者5年生存预后的关系;以P<0.05为差异有统计学意义。
2 结果
2.1不同组织中TGF-β1、HIF-1α表达比较 结直肠癌组织中TGF-β1、HIF-1α表达阳性率高于癌旁组织,差异有统计学意义(P<0.05)。见表1。
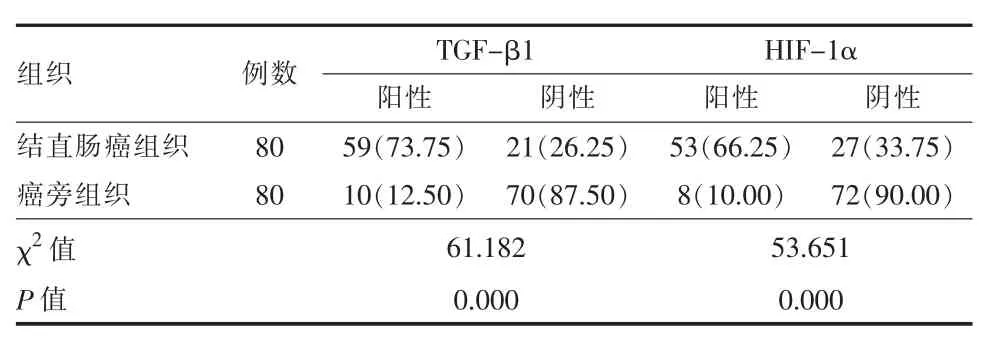
表1 结直肠癌患者不同组织中TGF-β1、HIF-1α表达比较[例(%)]
2.2结直肠癌组织中TGF-β1、HIF-1α表达与临床病理特征的关系 不同性别、年龄、病变部位、肿瘤直径患者病灶组织中TGF-β1、HIF-1α阳性率相比,差异无统计学意义(P>0.05);TGF-β1、HIF-1α表达阳性率与结直肠癌分化程度、TNM分期、淋巴结转移相关(P<0.05)。见表2。

表2 TGF-β1、HIF-1α表达与病灶临床病理特征的关系[例(%)]
2.3结直肠癌组织中TGF-β1、HIF-1α表达与预后的关系 结直肠癌组织中TGF-β1与HIF-1α的表达呈显著正相关(r=0.475,P<0.05)。经过5年随访,80例结直肠癌患者生存45例,5年生存率为56.25%。TGF-β1阳性组生存率为49.15%,TGF-β1阴性组生存率为76.19%,两组生存率差异有统计学意义(χ2=5.204,P<0.05);HIF-1α阳性组生存率为47.17%,HIF-1α阴性组生存率为74.07%,两组生存率差异有统计学意义(χ2=6.535,P<0.05)。
3 讨论
结直肠肿瘤生长缓慢,早期无明显症状,当肿瘤较大时才会有梗阻、疼痛、消化道出血等症状,容易导致治疗延误[6-7]。肿瘤的发病机制复杂,受内、外多种因素影响,涉及组织学、形态学、遗传学等方面,TGF-β1通路在肿瘤发生、发展过程中起着重要作用[8]。本研究结果显示,结直肠癌组织中TGF-β1阳性表达率高于癌旁正常组织,且低分化、存在淋巴结转移和高TNM分期患者肿瘤组织中TGF-β1表达量分别高于中高分化、无淋巴结转移和低TNM分期患者,提示TGF-β1在结直肠癌组织中高表达,其表达量与肿瘤分期、转移等生物学行为有关。本研究还发现,不同TGF-β1表达患者5年生存率存在显著差异,TGF-β1阳性表达患者5年生存率明显降低,说明TGF-β1表达与结直肠癌患者预后有关,检测病理组织中TGF-β1的表达能够辅助评估患者预后。
HIF-1α是细胞在缺氧环境中表达的一种细胞因子,其活性不稳定、半衰期短,常氧环境中HIF-1α能够很快被降解,故而难以检测到[9]。缺氧是实体瘤的重要特征,肿瘤组织细胞增殖活跃,肿瘤内血管供血不足,导致肿瘤病灶内缺氧[10]。在缺氧环境中,HIF-1α的降解途径被阻断,导致其大量聚集,增强肿瘤细胞的缺氧耐受性,也会提高肿瘤细胞转移和侵袭能力;同时,HIF-1α能增强血管内皮因子在缺氧状态下的转录活性,促进血管内皮因子表达,参与瘤体内新血管的生成,降低缺氧微环境对肿瘤组织的干扰[11]。本研究发现,与正常组织相比,结直肠癌组织中HIF-1α阳性率明显升高,且其阳性率与肿瘤组织分化程度、TNM分期以及有无淋巴结转移有关,提示HIF-1α在结直肠癌发生及发展过程中发挥关键作用,可作为判断肿瘤侵袭性、转移风险的参考指标。另外,对比不同HIF-1α表达患者生存预后发现,HIF-1α阳性组生存率明显低于阴性组,提示HIF-1α表达与结直肠癌患者预后密切相关,对早期评估患者预后具有一定帮助。
肿瘤的发生及发展受多种因素共同调节,肿瘤细胞生长导致局部微环境缺氧,刺激HIF-1α的产生和聚集,而HIF-1α又会激活血管内皮因子,促进瘤体内血管新生,为肿瘤生长所需的营养供给提供基础[12]。TGF-β1是独立于缺氧外的一种促血管生长调节因子,能够影响内皮细胞基因表达,促使内皮细胞分化为腔管结构,诱导肿瘤血管生成[13]。本研究分析80例恶性组织标本发现,47例标本TGFβ1和HIF-1α的表达均为阳性,15例表达均为阴性,结直肠癌组织中TGF-β1与HIF-1α的表达呈显著正相关(r=0.475,P<0.05)。提示TGF-β1和HIF-1α在结直肠癌中表达存在相关性,两者之间发挥协同作用,共同促进肿瘤血管生成,从而参与结直肠癌的发生、发展以及转移过程。
综上所述,结直肠癌组织中TGF-β1、HIF-1α表达与肿瘤生物学特征及预后有关,两者之间可能存在相互作用,共同介导结直肠癌的发生与发展。本研究结直肠癌的早期诊治提供了一定参考,但研究的样本量较小,可能导致结果存在一定统计误差,今后需增加样本量,验证研究结果的准确性。
