成龄转基因银中杨试验林外源基因水平转移及土壤微生物连年监测*
2022-03-23张伟溪王颜波丁昌俊朱文旭苏晓华
张伟溪 王颜波,2 丁昌俊 朱文旭,3 苏晓华
(1.林木遗传育种国家重点实验室 国家林业和草原局林木培育重点实验室 中国林业科学研究院林业研究所 北京 100091;2.南昌工程学院 南昌 330099; 3.沈阳农业大学 沈阳 110866)
自从Parsons等(1986)证实杨树(Populus)可以进行遗传转化、外源基因可在林木细胞中表达以来,林木基因工程研究已经取得长足发展。据统计,全球至少有35个国家对百余个树种进行了遗传转化研究,其中杨树、番木瓜(Carica)、松树(Pinus)、柳树(Salix)、核桃(Juglans)、苹果(Malus)、樱桃(Cerasus)、樟树(CinnamomumSect.Camphora)、悬铃木(Platanus)、桉树(Eucalyptus)、云杉(Picea)、美国栗(Castaneadentata)、美国榆(Ulmusamericana)等200多个转基因林木已进入田间试验阶段或已批准商品化(FAO,2004;Straussetal.,2011;Sedjo,2005;Klockoetal.,2018;Muhretal.,2018;Changetal.,2018;康向阳,2020)。转基因林木的改良性状主要集中在抗病、抗虫等抗生物胁迫,抗除草剂,抗旱、耐盐等抗非生物胁迫,降低木质素合成、增加纤维素合成等材性改良以及发育调控等方面(Londoetal.,2010)。由此可见,转基因林木主要应用于木材生产或在生态景观建设等方面,并不像转基因作物一样直接或间接涉及人类生命安全相关问题。但是,转基因林木的环境释放及推广应用的潜在生态风险仍不容忽视,其生态安全性监测仍需持续跟踪进行,以便有效地规避其生态安全问题,从而加速转基因林木的商业化应用和推广。因此,加强转基因生物安全的基础研究,提高对转基因生物安全性评价水平,制定有效的生态风险监测和管理策略尤为重要。
目前,转基因植物生态安全评估主要集中在转基因植物外源基因逃逸以及对生态系统的影响方面(Londoetal.,2010;Richardsonetal.,2011),如外源基因可能存在通过花粉、种子以及无性繁殖器官等媒介向其近缘种或其他生物群体进行基因漂移和水平转移的风险(Wangetal.,2018;Klockoetal.,2018)。土壤微生物是土壤生态系统的一个重要组成部分,参与土壤结构形成、分解有机质和矿物质,与植物根部营养吸收密切相关。因此,转基因植物的外源基因可能通过水平转移整合到土壤微生物的基因组中,从而改变其遗传特性与功能(Luetal.,2018)。例如,转基因西瓜(Citrulluslanatus)中35S启动子基因存在向土壤微生物转移的可能(Keese,2008),在转Bt玉米(Zeamays)、棉花(Gossypium)等作物的土壤中检测到了不同水平的Bt 蛋白(Stotzky,2005;Icozetal.,2008)。但也有研究发现,外源基因发生水平转移的频率低于自然转化的频率,从而给环境带来的风险可以忽略(Keese,2008),如对成熟期雄性转Bt基因欧洲黑杨(Populusnigra)人工林基因流频率和距离研究发现,距转Bt杨树人工林0 m处产生Bt种子的频率为0~0.15%,500 m处产生Bt种子的频率为0~0.02%,在自然条件下,转Bt杨树人工林通过花粉或种子产生的基因流水平极低(Huetal.,2017)。另外,外源基因表达对转基因植物目标性状改变有可能影响相关代谢途径产物的积累,从而通过植物落叶、根系等对根际土壤微生物及其群落的多样性产生潜在影响(Dauduetal.,2009;Gaoetal.,2014)。如转基因水稻(Oryzasativa)生长旺盛时期土壤中细菌数量显著增加(陈晓雯等,2011);转MdSOS2L1基因苹果(Malusdomestica)植株根际微生物多样性研究表明,转基因与野生型植株根际微生物群落丰富度和多样性存在较大差异,转MdSOS2L1植株根际酸杆菌门(Acidobacteria)丰度增加较多,蓝藻门(Cyanophyta)、放线菌门(Actinobacteria)丰度略有下降,同时,转基因植株根际土壤的苹果酸、柠檬酸、草酸含量明显升高,转基因植株根际微生物的差异极有可能与MdSOS2L1基因介导的有机酸分泌有关(王晓娜等,2018)。因此,土壤微生物的种类和数量通常可作为转基因植物生态安全性检测的重要指标。目前有关转基因植物系统生态安全性监测研究多集中在大豆(Glycinemax)、玉米、棉花、水稻等农作物方面(Icozetal.,2008;Keetal.,2014;Lietal.,2017)。转基因林木虽有研究,但多以苗期或幼龄的转Bt、Cry1A、Cry3A等基因林木为主,并未发现外源基因向土壤微生物转移的现象(胡建军等,2004;侯英杰等,2009;魏冰等,2009;张雁等,2012;李霞等,2011;Tranetal.,2018;Zuoetal.,2018;孙伟博等,2020),对成龄期转基因林木监测研究较少(Zhuetal.,2016;朱文旭等,2017;Huetal.,2017;吕威等,2018)。与集约化程度较高的农作物相比,转基因林木栽培环境复杂、生长周期长、经营管理相对粗放,且多为风媒传粉,因此,对成龄期转基因林木试验林的土壤微生物进行长期持续性监测非常必要。
1 材料与方法
1.1 试验材料
选取转抗逆转录因子基因(JERF36)银中杨(Populusalba×P.berolinensis)——抗逆1号杨(ABJ01)及非转基因银中杨(9#,对照)为研究材料,抗逆1号杨(ABJ01)是本实验室早期通过农杆菌介导法将连有35S启动子和NOS终止子的JERF36基因导入银中杨中,并且通过PCR、RT-PCR、Southern 杂交等分子检测获得外源基因成功整合并稳定表达的转基因银中杨,其中JERF36基因是从番茄(Lycopersiconesculentum)中克隆获得的茉莉酸乙烯应答元件基因,编码AP2/EREBP类植物转录因子,能专一结合GCC-box,在植物中能够激活下游抗逆相关基因表达,提高抗逆性。报告基因nptⅡ来自于细菌,编码新霉素磷酸转移酶,能赋予细胞抗卡那霉素能力(Lietal.,2009)。抗逆1号杨已获得环境释放及生产性试验行政许可,与非转基因对照相比,其形态未发生明显变化,抗旱耐盐性显著提高,于2015年获得国家植物新品种保护权。
1.2 试验地概况及样品采集
试验林位于北京市房山区韩村河东营苗圃(115°58′E,39°37′N),2006年春季造林,转基因株系及其对照均按随机区组,正方形种植100株(行10 株、列10 株),株行距为2 m × 2 m,造林总面积为0.66 hm2。试验地的地势、地貌、气温、降雨、植被、栽培管理等自然条件和人为管理均一致,整个试验阶段林地不进行任何肥水及喷施农药管理。
分别于2015年5—8月、2016年5—10月及2017年5—10月每月中旬取样1次,选择连续3天以上晴天的上午在试验林地内使用土钻钻取非根际土壤。随机选取抗逆1号杨(ABJ01)和非转基因对照(9#)各3株进行取样,以植株为中心,每株选取与主干50 cm距离的东南西北4个点进行取土,去除表层腐殖质层,留取 10~20 cm土柱,将土样中的石块和植物的根残体等杂物去掉,装入无菌的封口袋中混合均匀,放在冰盒内带回实验室,4 ℃冰箱内保存备用。该土壤样品用于研究微生物数量变化。2017年7月分别随机选取抗逆1号杨(ABJ01)和非转基因对照(9#)各10株采集幼嫩叶片,并按非根际土壤取样方法采集林下杂草,每种杂草取2~3片叶子混合;同时采集试验林地旁(约10 m)行道树毛白杨(Populustomentosa)、欧美杨(Populus×euramericana)雌株树下自然生长的实生杨树幼苗叶片,延路每隔10 m取1次样品,取样10次,每株杨树幼苗取3~5片叶子混合。样品用冰盒带回实验室,置于-80 ℃ 低温冰箱内保存备用。
1.3 试验方法
1.3.1 植物及土壤基因组DNA的提取 采用 DNeasy Plant Mini Kit (Qiagen,Germany)提取抗逆1号杨(ABJ01)、非转基因对照(9#)、林下杂草以及试验林旁行道树下杨树幼苗叶片基因组DNA;使用 PowerSoil® DNA Isolation Kit(Mobio,America)提取2017年7月非根际土壤中微生物的总DNA,具体操作参照试剂盒使用手册。
1.3.2 细菌基因组DNA的提取 选取2017年7月采集的抗逆1号杨(ABJ01)、非转基因对照(9#)土壤样本的10-1土壤悬浊液涂布在含卡那霉素浓度50 mg·L-1的细菌选择培养基平板中筛选抗性菌株,共获得2株。分别挑取其单菌落使用牛肉膏蛋白胨液体培养基培养,吸取5 mL处于对数生长期的菌液5 000 r·min-1离心1 min,弃上清。采用细菌基因组DNA提取试剂盒(TIANGEN,China)提取2个菌株的基因组DNA。
1.3.3 土壤及细菌DNA质量检测 以土壤微生物总DNA和细菌DNA为模板,去离子水为阴性对照。以细菌16S rRNA通用引物(上游引物:5′-ACTCCTACGGGAGGCAGCAG-3′;下游引物:5′-GGACTACHVGGGTWTCTAAT-3′)进行PCR扩增,反应条件为94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环;最后72 ℃延伸10 min,预期扩增片段长度为468 bp。
1.3.4 外源基因水平转移情况检测 以上述提取的所有DNA为模板,质粒DNA为阳性对照,去离子水为阴性对照。根据JERF36序列设计特异引物(上游引物:5′-CTCCCTTGAACATTGCTTG-3′;下游引物:5′-TGATTGCCCGTCAACATAC-3′)进行PCR扩增,反应条件为95 ℃ 5 min;95 ℃ 1 min,58 ℃ 1 min,72 ℃ 1 min,共30个循环;最后72 ℃ 延伸10 min,预期扩增片段长度为278 bp。
1.3.5 土壤微生物数量测定 采用稀释平板法培养土样中的细菌、真菌、放线菌。称取 10 g 土壤样品倒入装有90 mL无菌水和无菌小玻璃珠(10粒)的三角瓶中,置于摇床上(200 r·min-1)室温振荡30 min,随后用无菌水稀释土壤悬浊液(使用移液枪准确吸取0.1 mL土壤悬浮液注入0.9 mL的无菌水中即得到终浓度为10-1土壤悬浊液),其中,细菌稀释液终浓度分别为10-3、10-4、10-5的土壤悬浊液,放线菌稀释液终浓度分别为10-2、10-3、10-4的土壤悬浊液,真菌稀释液终浓度分别为10-1、10-2、10-3的土壤悬浊液。吸取50 μL稀释悬浊液均匀涂在牛肉膏蛋白胨培养基(培养细菌)、马丁(Martin)孟加拉红-链霉素培养基(培养真菌)、改良淀粉铵盐培养基(培养放线菌)上,放线菌置于28 ℃的培养箱内进行培养,细菌和真菌置于35 ℃的培养箱内进行培养。2天后统计真菌的菌落数,2~4天后统计细菌的菌落数,5天左右统计放线菌菌落数。每个菌种每个浓度培养3次。同时称取50 g的待测土样,用牛皮纸信封装好,放于烘箱中,105 ℃烘烤,烘至恒质量后称质量,计算土壤含水量,从而计算出每克干土中土壤微生物的菌落数,菌落数=(菌落平均数×稀释倍数)/[接种量毫升数×(1-含水量)]。采用SPSS 17.0 软件进行方差分析和多重比较。
2 结果与分析
2.1 外源基因JERF36的水平转移
采用外源基因JERF36的特异性引物分别对抗逆1号杨(ABJ01)、非转基因对照(9#)、林下杂草、林下土壤、试验林旁行道树下杨树实生苗叶片、土壤中筛选出的抗性菌株基因组DNA进行PCR检测(图1A),采用细菌16S rRNA通用引物对林下土壤、土壤中筛选出的抗性菌株基因组DNA进行PCR检测(图1B)。结果显示,在抗逆1号杨(ABJ01)的基因组DNA中能扩增出JERF36目的片段(278 bp),而非转基因对照(9#)、林下杂草、林下土壤、试验林旁行道树下杨树实生苗叶片以及2个抗性菌株基因组DNA均没得到扩增产物,且在土壤及菌株DNA,均能检测到微生物DNA,说明土壤及抗性菌株基因组DNA质量合格。以上说明种植11年后,JERF36基因仍稳定存在于转基因植株基因组中,并未发现向林地土壤、周边杂草等发生水平转移。

图1 外源基因JERF36 PCR检测Fig.1 PCR detection of exogenous gene JERF36A:外源基因JERF36 PCR检测(1:非转基因对照9#;2:林下杂草;3:林下土壤总DNA;4:试验林旁行道树下杨树实生苗叶片;5:抗性菌株1;6:抗性菌株2;7:转基因植株ABJ01;CK+:质粒阳性对照;CK-:去离子水阴性对照);B:16S rRNA PCR检测(H:去离子水阴性对照;1:林下土壤总DNA 1;2:林下土壤总DNA 2;3:抗性菌株1;4:抗性菌株2;M:DNA marker)。A:PCR detection of exogenous gene JERF36 (1:Non-transgenic control 9#;2:Understory weed;3:Total DNA in soil;4:Seedling leaves of roadside poplar beside the test field;5:Kanamycin-resistant strain 1;6:Kanamycin-resistant strain 2;7:Transgenic poplar ABJ01;CK+:Plasmid positive control;CK-:Deionized water negative control);B:PCR detection of 16S rRNA(M:DNA marker;H:Deionized water negative control;1:Total DNA in soil 1;2:Total DNA in soil 2;3:Kanamycin-resistant strain 1;4:Kanamycin-resistant strain 2).
2.2 林下土壤微生物的数量
分别对9年生(2015年)、10年生(2016年)、11年生(2017年)抗逆1号杨(ABJ01)及非转基因对照(9#)林下土壤中微生物总数量进行检测并统计分析(图2A)。3年连续性观测显示,各年份成龄抗逆1号杨与非转基因对照间林下土壤中微生物总数量均无显著差异;不同年份间的抗逆1号杨和非转基因对照的林下土壤微生物数量均略有差异,但无明显变化规律。其中6—8月是土壤中微生物快速增长期,其总量呈现2015年>2016年>2017年;而3个年份间6—8月气温并无显著差异(图2B),但降雨天数差异明显且呈现2015年(44天)>2016年(37天)>2017年(31天)(图2B)。在2016年和2017年的9—10月土壤中微生物总量、气温迅速下降,但在2016年9—10月的降雨天数维持稳定,2017年降雨天数先下降后上升,2017年9—10月试验林中土壤微生物总数量显著高于2016年。由此推测可能由于降雨差异导致土壤湿度变化,进而造成不同年份间抗逆1号杨和非转基因对照的林地土壤微生物数量差异,而抗逆1号杨未对林地土壤微生物总量造成影响。

图2 9~11年生(2015—2017年)杨树林地土壤微生物总数量以及不同月份气温和降雨天数Fig.2 Total number of microorganisms of 9-11 year-old(2015-2017)poplar test field and the temperature and raining days in different months9#:非转基因对照;ABJ01:转基因植株。下同。不同小写字母表示不同月份微生物数量在0.05水平上存在显著性差异;“*”表示不同年份间微生物数量在0.05水平上存在显著性差异。9#:Non-transgenic plants;ABJ01:Transgenic plants.The same below.Different lowercase letters indicate significant differences in the number of microorganisms in different months at the 0.05 level;“*”means significant differences in the number of microorganisms in different years at the 0.05 level.
分别对9年、10年、11年生抗逆1号杨(ABJ01)及非转基因对照(9#)林地土壤中细菌、真菌和放线菌数量进行检测并统计分析(图3)。结果表明:9年、10年、11年生抗逆1号杨和非转基因对照林地土壤3大类微生物数量在树木生长季呈现先上升后下降的变化趋势,其中在生长旺季的7月和8月林地土壤微生物数量最高,显著高于开始生长阶段(5月和6月)和停止生长阶段(9月和11月)。3个年份中,细菌和放线菌的数量均在每年的8月达到最高值;9年生、10年生抗逆1号杨和非转基因对照林地土壤中真菌数量也在8月达到最高值,11年生的林地土壤中真菌数量在7月峰值最高。抗逆1号杨与非转基因对照间林地土壤中3大类微生物数量均无显著差异,变化趋势一致。表明抗逆1号杨未对林地土壤中细菌、真菌和放线菌数量造成影响,而其中的微小差异可能是由气候等其他因素造成的。

图3 9~11年生(2015—2017年)林地土壤细菌、真菌和放线菌数量Fig.3 Total numbers of bacteria,actinomycetes,and fungi in soil of 9-11 years old (2015—2017)poplar test fieldA:9年生杨树5—8月土壤微生物数量;B:10年生杨树5—10月土壤微生物数量;C:11年生杨树5—10月土壤微生物数量。不同小写字母表示不同月份微生物数量在0.05水平上存在显著性差异。A:Total number of soil microorganisms in 9-year-old poplar plantation from May to August;B:Total number of soil microorganisms in 10-year-old poplar plantation from May to October;C:Total number of soil microorganisms in 11-year-old poplar plantation from May to October.Different lowercase letters indicate significant differences in the number of microorganisms in different months at the 0.05 level.
通过对不同年份间细菌、真菌和放线菌的比例分析(图4)发现,3个年份中,抗逆1号杨和非转基因对照林地土壤中3类微生物的比例相似,从高到低依次是细菌、放线菌和真菌;不同年份间3类微生物所占比例略有差异,但并没有出现某一类微生物急速增加或降低的现象。说明抗逆1号杨并没有破坏主要微生物种类之间的平衡。
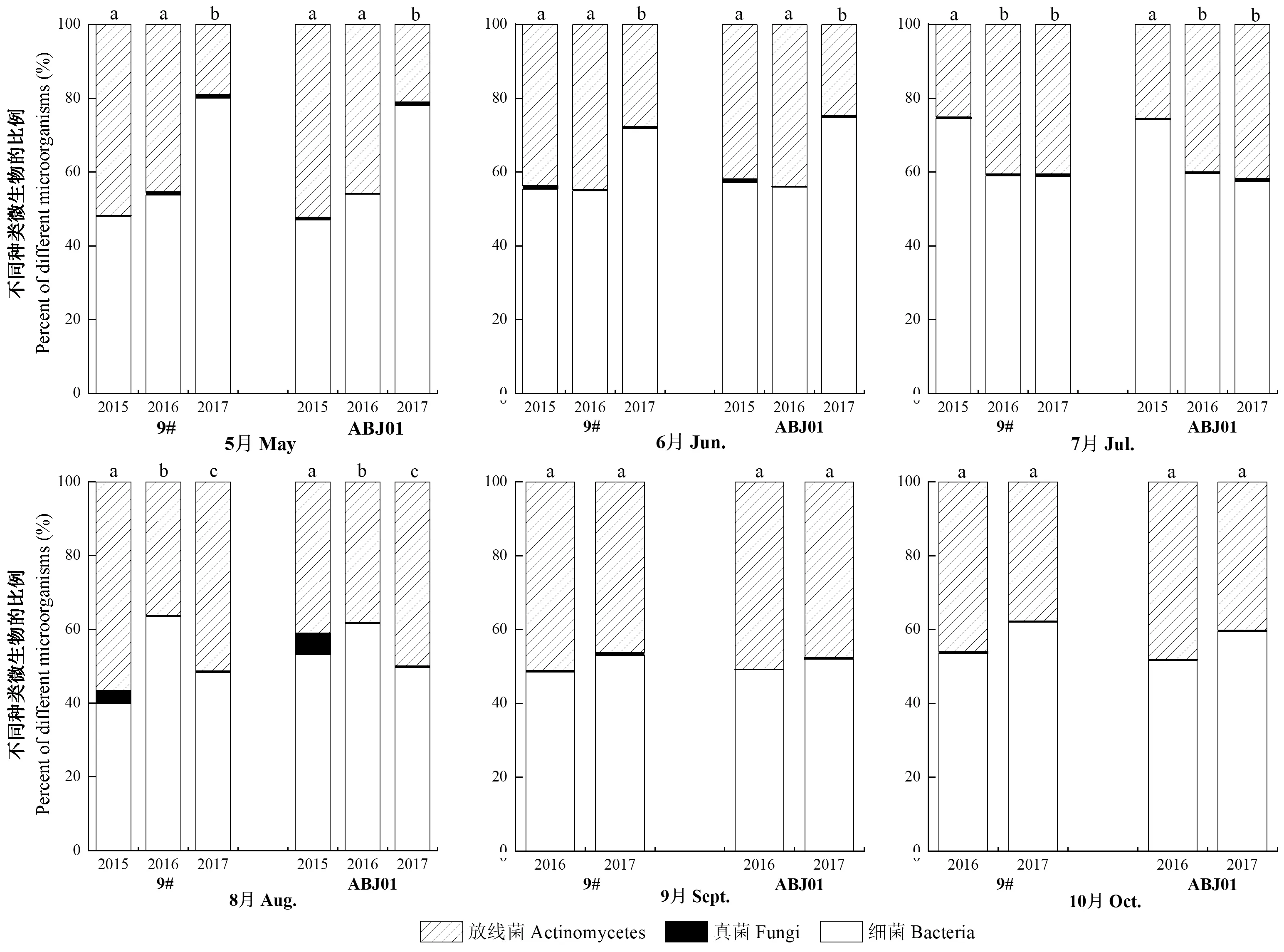
图4 不同年份(2015—2017年)林地土壤中微生物比例Fig.4 Proportions of microorganisms in plantation soil in different years(2015—2017)不同小写字母表示不同年份间微生物比例在0.05水平上存在显著性差异。The different lowercase letters mean significant deference of the microbial proportion in different years at the 0.05 level.
综上所述,对试验林内抗逆1号杨与非转基因对照在成龄期后的连续监测显示,试验林地土壤微生物的数量和种类平衡并未发现显著变化,而环境变化如降雨差异可能是不同年份微生物数量差异的主要原因,抗逆1号杨与非转基因对照林地微生物数量略微差异需要结合环境因素做进一步研究分析。
3 讨论
随着越来越多转基因植物的大面积田间种植,其对生态环境的影响一直备受瞩目。而外源基因在转基因受体植物中,特别是多年生林木中是否会发生逃逸现象是检测转基因植物安全性的首要问题(Frankenhuyzenetal.,2004)。尽管早期研究发现一些转基因林木中存在外源基因沉默现象(Jouaninetal.,2000;Kumaretal.,2001),但众多研究表明外源基因能在转基因林木中稳定存在并表达。例如,对5年生转基因741杨[Populusalba×(P.davidiana+P.simonii)×P.tomentosa]田间检测发现,外源基因Cry1Ac、Cry3A仍能稳定表达,未发现丢失和沉默现象(Zuoetal.,2018);转基因杂种山杨(Populustremula×P.tremuloides)在温室生长18年后,外源基因rolC依然稳定表达,并未出现外源基因丢失和沉默现象(Fladungetal.,2013);经过7年田间试验的转Bt基因欧洲黑杨(Populusnigra)的外源基因仍存在于转基因杨的基因组中(胡建军等,2004);转基因长春花(Catharanthusroseus)在5年后依然检测到外源基因rolA、rolB、rolC的存在和稳定表达(Vermaetal.,2015)。本试验使用外源基因特异引物对转基因银中杨(抗逆1号杨)和非转基因对照(银中杨)的基因组DNA进行PCR检测结果表明,抗逆1号杨在田间种植11年后,外源基因仍稳定存在于转基因杨树的基因组中,未发生外源基因丢失现象。
基因水平转移现象在原核生物中广泛存在,在真核生物中也有一些相关报道(Kyndtetal.,2015;Quispe-Huamanquispeetal.,2019;Matveevaetal.,2019)。林木生长周期长,转基因树木种植大田后,每年试验林中产生大量根茬、落叶、花粉、果实等,经过多年累积,外源基因可能通过根际分泌物、土壤微生物降解和吸收有机物的过程进入土壤体内,影响周围土壤环境中的微生物群落结构及其多样性等(Gaoetal.,2014;Aslametal.,2017;Figueredoetal.,2018)。因此外源基因是否发生水平转移,土壤中微生物的种类、群落数量等是否发生变化是对转基因林木进行安全性评价的重要方面。对包含3 种编码不同抗性蛋白的外源基因(PeTLP、Cry1Ac、AtGols)的转基因南林895杨试验林进行安全性评估,未发现外源基因向土壤微生物中转移的现象(孙伟博等,2020)。5年生转基因741杨的生态安全性评价表明,在土壤和林下杂草中未检测到外源基因,外源基因没有发生基因转移,多年生转基因杨树对土壤理化性质和土壤微生物群落结构没有产生影响,微生物群落结构主要受地理位置和季节变化的影响(Zuoetal.,2018)。大田种植12年后转基因毛白杨暂未对土壤可培养微生物数量造成显著影响(吕威等,2018)。转Bt基因棉花根际土壤微生物的活性并不受Bt蛋白的影响,其主要的影响因素是土壤的盐分(Luoetal.,2017)。本实验室早期研究显示,8年生转多基因欧美杨 (Populus×euramericana‘Guariento’)未发现外源基因转移,其与非转基因对照之间林地土壤细菌多样性和群落结构无显著差异,其对土壤微生物系统没有明显的影响,转基因杨树的土壤微生物数量主要受季节变化影响(朱文旭等,2015;2017;Zhuetal.,2016)。对不同区域抗逆1号杨及非转基因对照内生菌多样性研究表明,外源基因导入并未对抗逆1号杨根、茎中内生菌(细菌和真菌)群落结构及多样性产生影响,微生物的群落结构主要取决于土壤pH值和有机质含量(Wangetal.,2019)。本试验也未在抗逆1号杨试验林内的杂草和林地土壤微生物基因组中检测到外源基因。由于本试验材料在转JERF36基因的同时引进了报告基因nptⅡ,为了进一步验证土壤中抗卡那霉素的细菌是否被整合上外源基因,本试验筛选出2个抗性菌株,但均未得到外源基因的扩增产物,充分表明外源基因未发生水平转移。此外,抗逆1号杨与非转基因对照林地土壤中的细菌和真菌数量无显著差异;放线菌仅在2015年(杨树9年生)的7月份略有差异,可能是环境变化引起,随后的2年中均无显著差异。也进一步证实11年生抗逆1号杨并未对土壤微生物的种类、数量造成显著影响。
此外,还有通过检测试验林内根际土壤微生物群落结构、表层土凋落物、花粉中外源基因表达等方面对多年生转基因杨树对土壤环境的安全性进行检测,但均未发现显著影响。如在内蒙古地区转基因试验林地内的转基因银中杨安全性检测显示,转基因银中杨并未影响其根际土壤微生物的数量及主要类群的数量(吕秀华,2017;2018);种植13年的转基因三倍体毛白杨枯落物中的外源基因暂未水平转移到根际土壤可培养细菌基因组中(吕威等,2019)。虽然上述研究并未发现转基因杨树对根际土壤等产生显著影响,但本研究中并未进行相关方面安全性检测,因此在今后的研究中可加强本试验林在该方面的相关检测内容,以期更加全面地进行转基因杨树试验林的安全性检测,为转基因林木安全性评价提供依据。
4 结论
转基因林木对生态的影响是一个长期而复杂的过程,目前尚没有公认的评估转基因植物生态安全性的方法和标准。本试验对转JERF36基因银中杨生态安全性的初步分析表明,外源基因在转基因银中杨中稳定存在,没有发现向周边环境水平转移,并未发现外源基因导入对林地土壤微生物的数量和群落结构造成影响。森林中土壤微生物的组成和结构非常复杂,关于转基因林木生态及生物安全性监测需要进行更加系统、全面和长期的研究。
