梨形环棱螺11个地理种群遗传多样性和遗传分化
2022-03-23曹静越马学艳吕国华闻海波1顾若波1
金 武,曹静越,马 骋,马学艳,吕国华,闻海波1,,3,顾若波1,,3
(1.中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业与种质资源利用重点实验室,江苏无锡 214081;2.南京农业大学无锡渔业学院,江苏无锡 214128;3.中国水产科学研究院淡水渔业研究中心,中美淡水贝类种质资源保护及利用国际联合实验室,江苏无锡214081;4.上海海洋大学,农业农村部淡水水产种质资源重点实验室,上海 201306)
梨形环棱螺()是腹足纲(Gastropoda)田螺科(Viviparidae)环棱螺属()中个体最大的种,该种分布广、产量大、用途多,是青鱼()、宽体金线蛭(Whitman)、中华绒螯蟹()和中华鳖()等水产经济动物及部分水禽的饵料之一,同时也是广大居民“菜篮子”的重要组成部分。以中华绒螯蟹需求为例,全国每年平均约需100~150万吨梨形环棱螺,但2019年全国养殖产量仅为9.289万吨,市场缺口巨大。对梨形环棱螺的研究集中在形态特征、生长性状遗传参数、壳色、水体修复等方面,对梨形环棱螺种群遗传多样性和遗传分化的研究仍较少。
微卫星(microsatellite)即短串联重复序列(short tandem repeats,STRs)或简单重复序列(simple sequence repeats,SSR),它广泛应用在三角帆蚌()、钉螺(Gredler)、橄榄蛏蚌()等淡水贝类种群遗传多样性和群体结构方面的研究。与传统分子标记相比,它具有分辨率高,可以检测共显性遗传的显著优点。已有对梨形环棱螺种群遗传多样性的研究集中于少数几个群体,为了进一步对更大范围内梨形环棱螺遗传多样性进行系统背景研究,采用微卫星分子标记分析目前我国梨形环棱螺群体的遗传资源多态性并筛选最适合养殖和育种的群体,从而为资源实现有序合理开发、开展苗种规模化培育提供支撑。
1 材料与方法
1.1 样本采集
2021年3-4月,梨形环棱螺样本采集于山东微山湖(SDWS)、江苏高邮湖(JSTZ)、上海明珠湖(SHCM)、浙江淳安(ZJCA)、安徽黄陂湖(AHLJ)、湖北长湖(HBQJ)、江西仙女湖(JXYC)、湖南耒水(HNHY)、贵州夜郎湖(GZAS)、广西千亩湖(GXLZ)、广东榕江(GDJY)11个不同水域,每个群体30个个体。根据采集时间不同,在贝类养殖系统中暂养至所有群体采集完成。具体采集地点如图1所示。
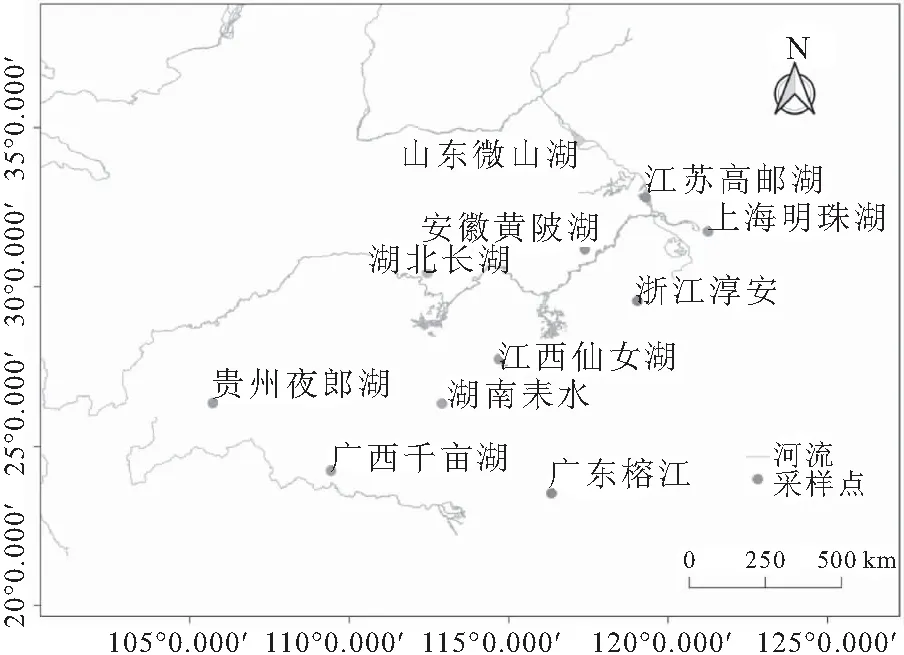
图1 梨形环棱螺采样点分布图
1.2 基因组DNA提取、PCR扩增与测序
剪取约50 mg新鲜腹足肌肉,利用动物组织基因组DNA提取试剂盒(上海翼和应用生物技术有限公司)提取DNA。聚合酶链式反应总体积为10 μL:模板1.5 μL,Buffer 1 μL,DNA聚合酶0.3 μL,dNTP 0.8 μL,ddHO 5.4 μL,引物1 μL。引物序列来自文献[20],上游引物5′端进行荧光修饰,详细信息如表1所示。PCR扩增程序为:95 ℃ 预变性2 min,94 ℃变性30 s,退火90 s(退火温度见表1),72 ℃延伸60 s,共40循环,72 ℃补齐延伸10 min,4 ℃保存。PCR产物用3%的琼脂糖凝胶电泳检测后,将目的片段送上海翼和应用生物技术有限公司,用ABI Prism 3730 XI测序仪进行毛细管电泳,采用Genemapper V3.0分析各个位点的基因型。

表1 梨形环棱螺7对微卫星引物序列
1.3 数据分析
利用Popgene32软件分析各个微卫星位点在11个地理种群的等位基因数()、有效等位基因数()、观测杂合度()、期望杂合度()、Shannon信息指数(),并计算群体间的Nei′s遗传距离。Hardy-Weinberg平衡偏离指数()按照以下公式计算:
=(-)/
用Cervus 3.2 软件计算各位点的多态信息含量()。基于群体间的Nei′s遗传距离用Mega X软件绘制NJ聚类图。用Arlequin3.1软件计算两两群体间的遗传分化指数(),采用分子方差分析(AMOVA)计算群体的遗传结构,通过1 000次模拟重复抽样检验群体间的显著性。
2 结果
2.1 微卫星位点的多态性
7对微卫星引物在11个群体中检测到96个等位基因(表2),11个群体的介于8~20,为5.882~9.783,平均和为13.714和6.809。其中ATG146位点最多(20个),CAG41最少(8个)。Shannon信息指数介于1.895~2.614。7个位点的介于0.4~0.8,介于0.844~0.913,7个位点全部偏离Hardy-weinberg平衡(<0)。多态信息含量为0.848~0.980,平均是0.915。7个位点均为高度多态位点(>0.5)。
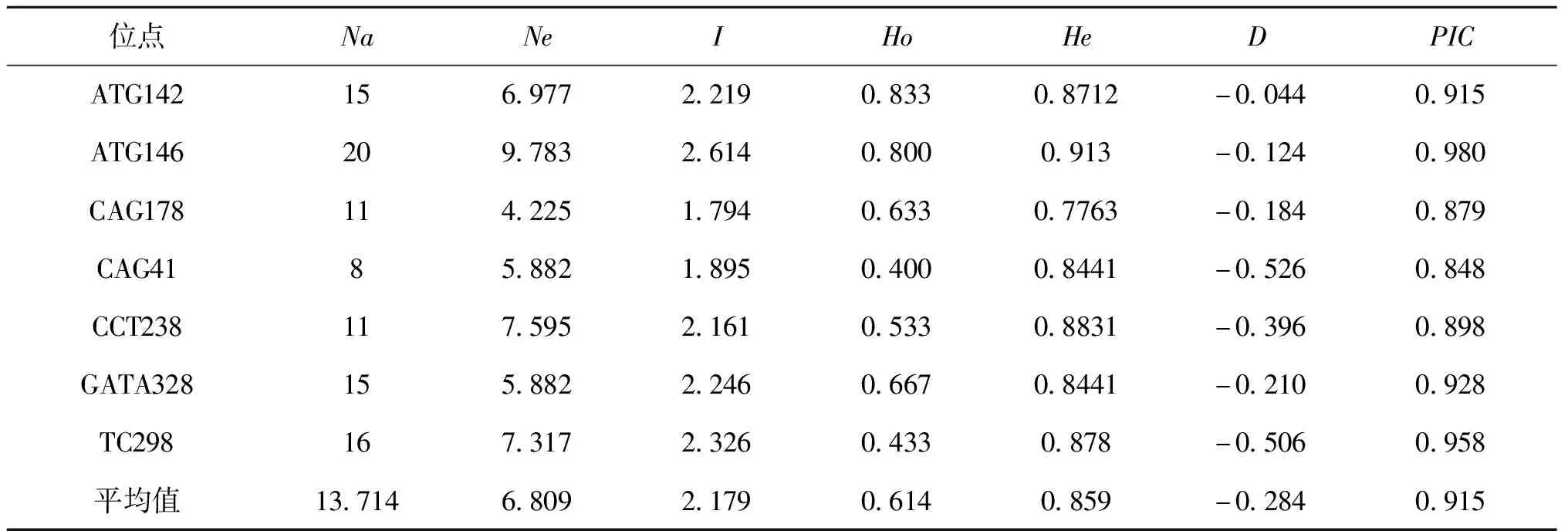
表2 梨形环棱螺7个微卫星标记的遗传多态性
2.2 梨形环棱螺11个群体的遗传多样性
梨形环棱螺11个群体的遗传多样性见表3。11个群体的平均为9.286~20.429,为4.766~11.175。为1.723~2.606。平均和平均分别为0.510~0.535和0.772~0.905。从看,11个群体的均较高(>0.5),遗传多样性均较丰富。
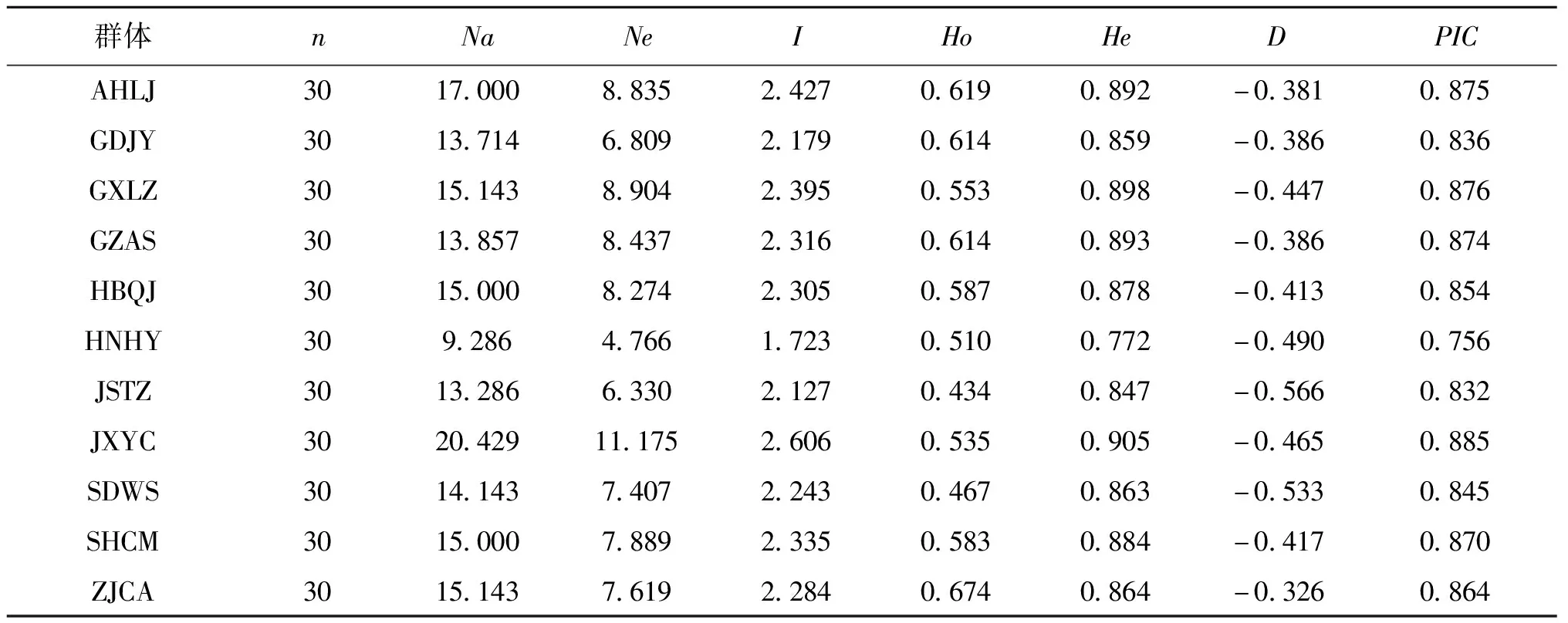
表3 梨形环棱螺11个群体的遗传多样性
2.3 遗传分化
梨形环棱螺11个群体间的Nei′s遗传相似度和遗传距离见表4。11个群体间的遗传距离介于0.143~0.937,Nei′s遗传相似度介于0.392~0.867之间。HBQJ和JXYC之间遗传距离最短,GZAS和HNHY之间的遗传距离最长。基于群体间Nei′s遗传距离的NJ聚类树结果如图2所示。AMOVA分析结果显示(表5),11个群体内的遗传变异占总体变异的94.84%。群体间的遗传变异占5.16%,11个群体的遗传分化指数为0.052,说明这11个群体之间遗传分化较小,且变异的来源主要是各个群体内的个体之间。
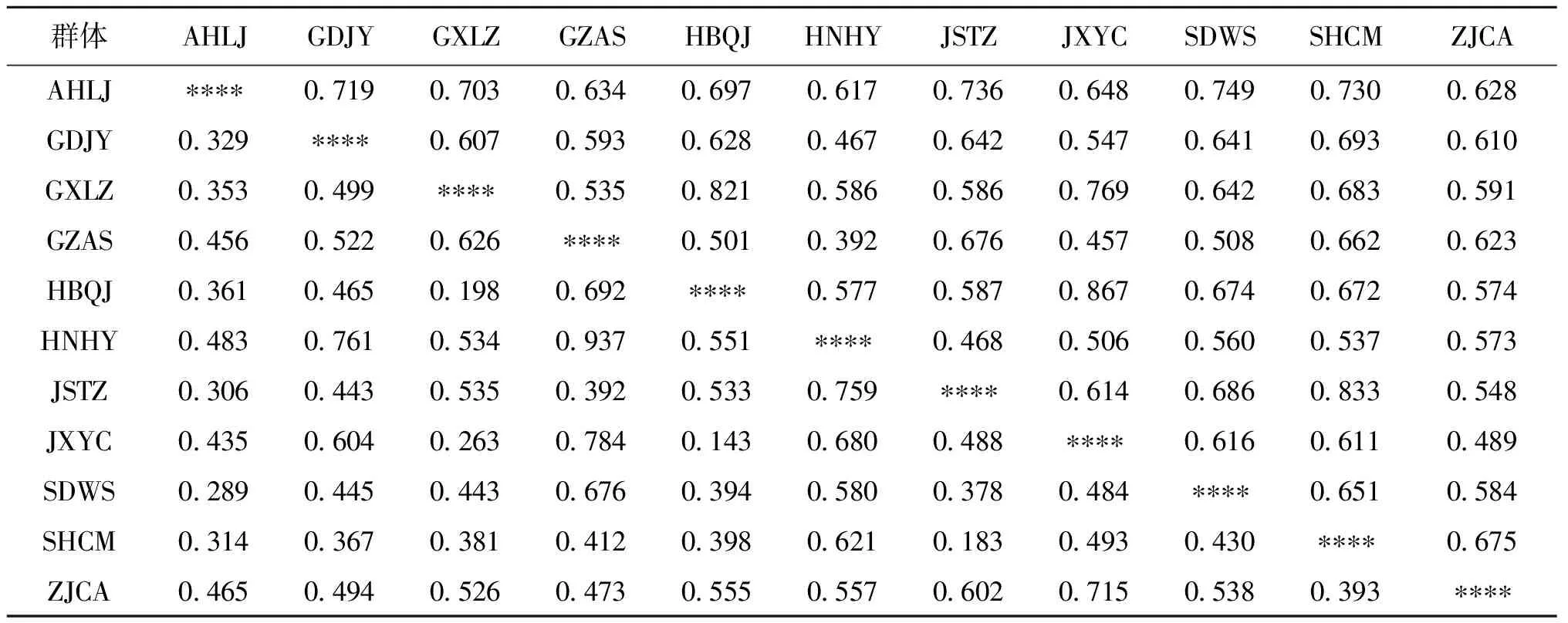
表4 梨形环棱螺11个群体的遗传距离(下三角)和群体间遗传相似度(上三角)
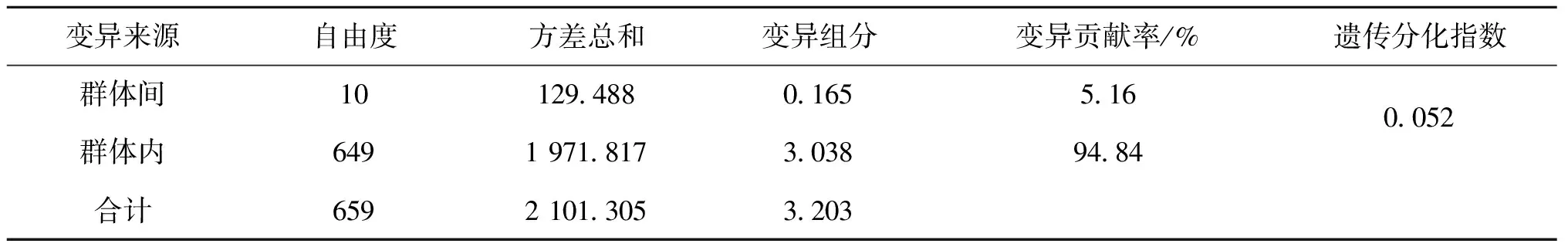
表5 梨形环棱螺11个群体的AMOVA分析

图2 基于Nei′s遗传距离构建的梨形环棱螺11个群体的NJ聚类树
3 讨论
3.1 梨形环棱螺的遗传多样性
山东微山湖为南四湖水域的组成之一,本研究中发现SDWS群体的7个位点的平均多态信息含量(=0.845)和文献[19]中NS群体同样7个位点的平均多态信息含量(=0.832)无显著差异。对洞庭湖(DT)、鄱阳湖(PY)、梁子湖(LZ)等8地的梨形环棱螺的遗传多样性分析发现平均遗传多样性在0.832~0.888之间,且各个种群内部表现出明显的遗传变异,但是种群间的遗传变异差别不大。此外,各个群体显著偏离Hardy-weinberg平衡,这和本研究中11个地理种群的分析结论一致,且杂合体缺失和无效等位基因的存在是各个群体显著偏离Hardy-weinberg平衡的原因。截至目前,对全国梨形环棱螺的19个群体进行了遗传多样性分析,说明梨形环棱螺种群虽然分布广,但其遗传多样性仍处于较高水平,且不同地理种群之间的遗传变异不大。长江水系在很长一段时间与两岸湖泊相互连通,湖泊水系连通性好,以及长江流域频发的洪水可能促进了长江流域梨形环棱螺的扩散和种群之间的交流。根据BOTSTEIN等提出的衡量基因变异程度高低的指标可见,表明这7个微卫星位点均具有高度多态性,能确切提供遗传信息,可以应用于梨形环棱螺的遗传多样性、遗传结构、种质鉴定等分析。对铜锈环棱螺的微卫星标记进行种间扩增也表现出较高的多态性,为我国环棱螺遗传多样性研究提供依据。
遗传分化指数是衡量群体间遗传分化的重要指标,群体间遗传距离越小,遗传分化程度越低,群体间的亲缘关系越近。一般而言,当<0.05时,群体间遗传分化较小;0.05<<0.15时群体间有中等程度的遗传分化;当0.15<<0.25时,群体间遗传分化程度较大;当>0.25时,群体间遗传分化显著。以长江为界,大尺度范围内对长江以北、长江流域、长江以南三大区域进行AMOVA分析也发现,种群间的遗传变异比例很低,主要的遗传变异(91.57%)来自群体内,与本研究结论一致。
3.2 梨形环棱螺繁殖方式
螺类的一些种具有孤雌生殖的繁殖方式,这有利于种群快速扩散,即使只有一个个体也能快速占领特定的生态位并形成种群,孤雌生殖的同一世代个体绝大多数都是雌性个体,少数是雄性个体。梨形环棱螺幼体能够倒吸在水体表面下进行漂浮,也能吸附在漂浮物上进行水平移动,从而促进了梨形环棱螺的扩散和交流,可能是不同地理种群遗传多样性得以保持的原因之一。尽管孤雌生殖会导致群体遗传多样性降低,但营孤雌生殖的生物(包括部分螺类)进化出了两套生殖方式,即有性生殖和孤雌生殖并存,但有性生殖和孤雌生殖在何种条件下进行转换的机制仍未能得到完全解释,梨形环棱螺是否也存在类似系统以及这两套系统在何种条件下进行转化仍需进一步深入研究。
