匹诺塞林调控miR-486-5p表达对LPS致心肌细胞氧化应激和细胞凋亡的影响
2022-03-22张庆军王辉张苗苗毛雯吴迪
张庆军 王辉 张苗苗 毛雯 吴迪
脓毒症是由感染引起的全身性炎性反应综合征,若未得到有效治疗,将导致脓毒症休克和多器官功能障碍。心脏是脓毒症最常见受累器官,有研究显示重症监护病房(ICU)60%以上脓毒症患者表现为心功能障碍,其死亡率高达70%[1]。匹诺塞林(又称为5,7-二羟基黄酮)是从蜂胶和一些植物中提取的黄酮类化合物,具有抗氧化、抗炎、血脑屏障保护、神经保护等生物学作用[2-4]。此外,匹诺塞林还可减少缺血再灌注大鼠室性心律失常,减少心肌梗死面积,改善心脏功能[5,6]。然而关于匹诺塞林心肌保护的潜在机制并未完全阐明,匹诺塞林能否用于治疗脓毒症心肌损伤也尚未可知。微小RNA(miRNA)是一类蛋白编码能力缺失的多功能短链RNA,其抑制靶mRNA的翻译或转录参与广泛的心脏病理生理和血管功能。研究显示紫绀型心脏病患者心肌组织中miR-486-5p表达增加,抑制miR-486-5p表达可保护心肌细胞免受缺氧诱导的细胞损伤[7]。然miR-486-5p在脓毒症心肌损伤中的作用并未报道。本研究采用脂多糖(LPS)刺激大鼠心肌细胞H9C2建立细胞损伤模型[8],观察匹诺塞林对LPS致心肌细胞损伤以及对miR-486-5p表达的影响,旨在揭示匹诺塞林的心肌保护作用机制。
1 材料与方法
1.1 材料与试剂 大鼠胚胎心肌细胞H9C2购自美国典型培养物保藏中心;LPS、羟丙基-β环糊精购于美国Sigma-Aldrich公司;匹诺塞林(纯度大于99%)购于中国医学科学院药物研究院;脂质体Lipofectamine 2000、TRIzol试剂购于美国Invitrogen公司;miR-486-5p抑制物(anti-miR-486-5p)及其阴性对照(anti-miR-NC)、miR-486-5p模拟物(mimics)及其阴性对照(miR-NC)、miRNA反转录PCR试剂购于广州锐博生物公司;丙二醛(MDA)检测试剂盒、谷胱甘肽过氧化物酶(GSH-Px)活性检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒购于上海泽叶生物公司;膜联蛋白V-异硫氰酸荧光素(Annexin-V-FITC)凋亡检测试剂盒购于北京宝赛生物公司;兔抗大鼠cleaved-caspase3单克隆抗体、兔抗大鼠GAPDH抗体单克隆购于上海碧云天生物公司;兔抗大鼠cleaved-caspase9抗体购于上海艾博抗生物公司;miRNA荧光定量PCR试剂盒购于上海生工生物工程公司。
1.2 细胞培养、转染和分组 将匹诺塞林溶于20%羟丙基-β环糊精配置成母液,保存于-20℃冰箱。使用时用DMEM培养基将其稀释到实验所需浓度,其中羟丙基-β环糊精含量低于0.1%。H9C2细胞接种含有10%胎牛血清的DMEM培养基,放入37℃、含95%空气和5%CO2、湿度97%的培养箱中培养,当细胞生长汇合度为80%时,胰酶消化按照1∶4比例传代。
1.2.1 细胞转染:将第5代对数期H9C2接种6孔板,每孔2×105个细胞,按照Lipofectamine 2000说明书步骤将anti-miR-NC、anti-miR-486-5p、miR-NC、miR-486-5p mimics分别转染生长汇合度为60%细胞,培养48 h后收集细胞进行后续实验。
1.2.2 实验分组:对照(Con)组:只出培养的H9C2细胞;LPS组:采用含5 mg/L LPS的培养液孵育H9C2细胞6 h[8];LPS+匹诺塞林(PIN-)-低剂量(L)组、LPS+PIN-中剂量(M)组、LPS+PIN-高剂量(H)组:用不同剂量匹诺塞林[9](0.1 μmol/L、1 μmol/L、10 μmol/L)预处理H9C2细胞6 h,PBS洗涤细胞3次,然后用含5 mg/L LPS的培养液继续培养6 h;LPS+anti-miR-NC组、LPS+anti-miR-486-5p组:用含5 mg/L LPS的培养液孵育转染anti-miR-NC、转染anti-miR-486-5p细胞6 h;LPS+PIN+miR-NC组、LPS+PIN+miR-486-5p组:用含10 μmol/L匹诺塞林的培养液预处理转染miR-NC或转染miR-486-5p mimics的H9C2细胞6 h,PBS洗涤后,再进行LPS处理。
1.3 试剂盒检测H9C2细胞中MDA含量、SOD和GSH-Px活性 H9C2细胞处理完毕后,收集细胞至反应管,加入提取液超声破碎细胞,收集上清液。参照试剂盒说明书步骤检测H9C2细胞中MDA水平以及SOD、GSH-Px活性。
1.4 流式细胞术检测H9C2细胞凋亡 H9C2细胞处理完毕后,重悬于500 μl 1×结合缓冲液中,随后加入10 μl Annexin V-FITC和5 μl碘化丙啶(PI),37℃暗箱孵育15 min。孵育后用流式细胞仪检测凋亡细胞比例。
1.5 蛋白质印迹法检测H9C2细胞cleaved-caspase3和cleaved-caspase9蛋白 RIPA裂解液提取H9C2细胞总蛋白,二喹啉甲酸试剂盒测定蛋白浓度。每泳道上样30 μg蛋白经120 V的SDS-PAGE分离后,用250 mA恒流将分离蛋白转移到聚偏二氟乙烯膜。用5%脱脂乳在室温下封闭膜1 h,随后分别加入兔抗大鼠cleaved-caspase3抗体(1∶1 000)、兔抗大鼠cleaved-caspase9抗体(1∶1 000)、兔抗大鼠GAPDH抗体(1∶2 000)在4℃孵育过夜。Tween-20-Tris缓冲盐水(TBST)洗膜后,用对应的酶标二抗室温下孵育膜1 h。最后将膜置于塑料盒,滴加化学发光试剂暗箱内显影、定影。采用Image-Pro Plus 6.0软件分析各条带灰度值。
1.6 实时定量PCR(RT-qPCR)检测H9C2细胞中miR-486-5p表达量 TRIzol法提取H9C2细胞中总RNA,用miRNA反转录PCR试剂盒合成miR-486-5p的cDNA,再用miRNA荧光定量PCR试剂盒进行RT-qPCR反应。2-△△Ct法计算H9C2细胞中miR-486-5p表达量。引物序列如下:miR-486-5p上游5’-ACACTCCAGCTGGGTCCTGTACT GAGCTGCCC-3’,miR-486-5p下游5’-CTCAACTGGTGTCGTGGA-3’;内参U6上游5’-CGCT TCACGAATTTGCGTGTCAT-3’,U6下游5’-AACGCTTCACGAATTTGCGT-3’。

2 结果
2.1 匹诺塞林对LPS致心肌细胞氧化应激的影响 与Con组比较,LPS组H9C2细胞中MDA含量显著升高(P<0.05),SOD和GSH-Px活性显著降低(P<0.05);与LPS组比较,LPS+PIN-L组、LPS+PIN-M组、LPS+PIN-H组H9C2细胞中MDA含量显著降低(P<0.05),SOD和GSH-Px活性显著升高(P<0.05)。LPS+PIN-L组、LPS+PIN-M组、LPS+PIN-H组3组间MDA含量、SOD和GSH-Px活性差异均有统计学意义(P<0.05)。见表1。

表1 匹诺塞林对LPS致心肌细胞氧化应激的影响
2.2 匹诺塞林对LPS致心肌细胞凋亡的影响 与Con组比较,LPS组H9C2细胞凋亡率、cleaved-caspase3和cleaved-caspase9蛋白表达量显著升高(P<0.05);与LPS组比较,LPS+PIN-L组、LPS+PIN-M组、LPS+PIN-H组H9C2细胞凋亡率、cleaved-caspase3和cleaved-caspase9蛋白表达量显著降低(P<0.05)。LPS+PIN-L组、LPS+PIN-M组、LPS+PIN-H组3组间细胞凋亡率、cleaved-caspase3和cleaved-caspase9蛋白表达量差异均有统计学意义(P<0.05)。见图1,表2。

图1 匹诺塞林对LPS致心肌细胞凋亡的影响;A 凋亡相关蛋白表达;B 细胞凋亡流式图

表2 匹诺塞林对LPS致心肌细胞凋亡的影响
2.3 匹诺塞林对LPS致心肌细胞miR-486-5p表达的影响 与Con组比较,LPS组H9C2细胞miR-486-5p表达量显著升高(P<0.05);与LPS组比较,LPS+PIN-L组、LPS+PIN-M组、LPS+PIN-H组H9C2细胞miR-486-5p表达量显著降低(P<0.05)。LPS+PIN-L组、LPS+PIN-M组、LPS+PIN-H组3组间miR-486-5p表达量差异均有统计学意义(P<0.05)。见表3。

表3 匹诺塞林对LPS致心肌细胞miR-486-5p表达的影响
2.4 干扰miR-486-5p表达对LPS致心肌细胞氧化应激和细胞凋亡的影响 与LPS+anti-miR-NC组比较,LPS+anti-miR-486-5p组H9C2细胞miR-486-5p表达量显著降低(P<0.05),MDA含量、细胞凋亡率、cleaved-caspase3和cleaved-caspase9蛋白的表达量显著降低(P<0.05),SOD和GSH-Px活性显著升高(P<0.05)。见图2,表4。

图2 干扰miR-486-5p表达对LPS致心肌细胞凋亡的影响;A 凋亡相关蛋白表达;B 细胞凋亡流式图

表4 干扰miR-486-5p表达对LPS致心肌细胞氧化应激和细胞凋亡的影响
2.5 过表达miR-486-5p逆转了匹诺塞林(10 μmol/L)对LPS致心肌细胞氧化应激和细胞凋亡的作用 与LPS+PIN+miR-NC组比较,LPS+PIN+miR-486-5p组H9C2细胞miR-486-5p表达量显著升高(P<0.05),MDA含量、细胞凋亡率、cleaved-caspase3和cleaved-caspase9蛋白的表达量显著升高(P<0.05),SOD和GSH-Px活性显著降低(P<0.05)。见图3,表5。
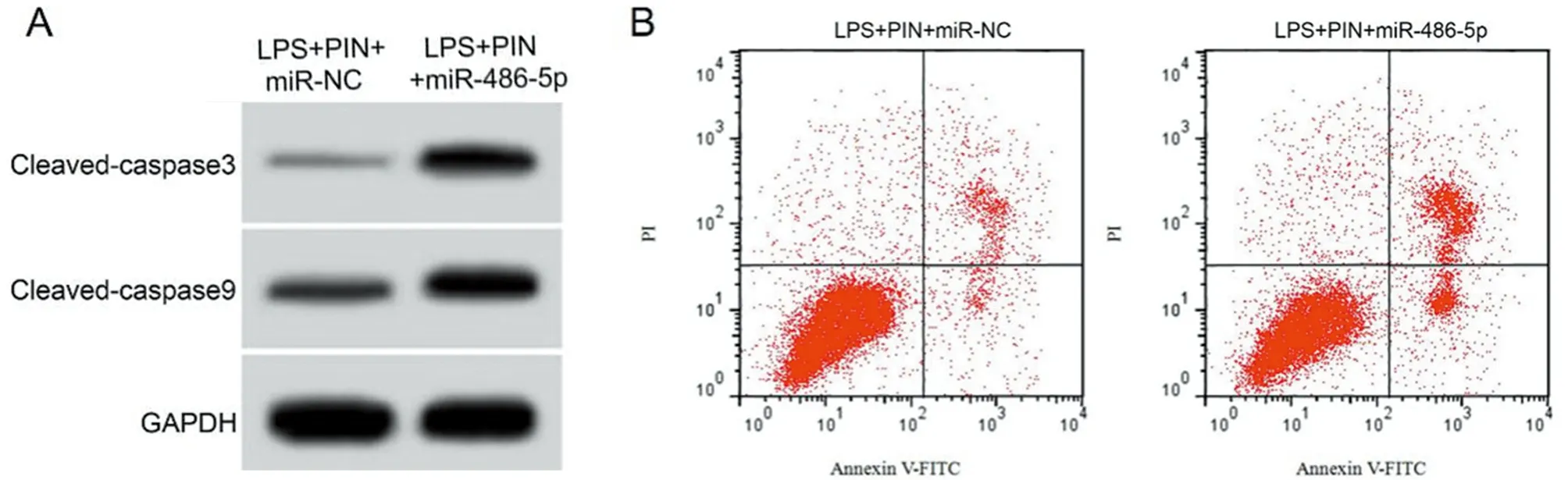
图3 miR-486-5p过表达逆转了匹诺塞林对LPS致心肌细胞凋亡的作用;A 凋亡相关蛋白表达;B 细胞凋亡流式图

表5 miR-486-5p过表达逆转了匹诺塞林对LPS致心肌细胞氧化应激和细胞凋亡的作用
3 讨论
匹诺塞林的抗氧化作用是其治疗多种疾病的基础。在脑缺血再灌注细胞模型中,匹诺塞林可抑制活性氧、一氧化氮和一氧化氮合酶产生,增加抗氧化酶活性,增加糖氧剥夺复氧后神经元细胞存活率,减少细胞凋亡[10]。在庆大霉素诱导的急性肾损伤中,匹诺塞林可降低氧化应激和凋亡状态,改善肾脏功能[11]。匹诺塞林还能保护人主动脉内皮细胞免受氧化低密度脂蛋白诱导的损伤[12]。脓毒症诱导心肌损伤后氧自由基的过量产生和抗氧化剂耗竭导致机体氧化和抗氧化的失衡,MDA是脂质过氧化终产物,其水平可反应生物体内的脂质过氧化程度,间接反应细胞损伤程度[13]。SOD和GSH-Px是重要的心肌抗氧化酶,能够清除氧自由基,是评价自由基代谢的重要指标[14]。本研究中匹诺塞林以剂量依赖方式抑制LPS诱导的MDA水平增加和H9C2细胞凋亡,增加GSH-Px和SOD活性,降低促凋亡蛋白cleaved-caspase3和cleaved-caspase9表达水平。Zheng等[15]研究证实匹诺塞林通过促进糖酵解可减轻急性缺血性心肌损伤,与本研究发现的心肌保护作用一致。以上结果表明,匹诺塞林通过其抗氧化和抗凋亡特性对LPS所致心肌细胞损伤具有保护作用。
miR-486-5p是一种功能性miRNA,研究报道在LPS诱导的软骨细胞中miR-486-5p表达增加,下调miR-486-5p明显促进软骨细胞增殖,减少炎性细胞因子的产生,提高抗氧化酶活性,对LPS诱导的软骨细胞炎症损伤、氧化应激和凋亡具有保护作用[16]。在LPS诱导的肺泡上皮细胞中miR-486-5p通过靶向去泛素化酶OTUD7B可促进炎性反应和细胞凋亡,介导急性肺损伤[17]。本研究发现LPS刺激后H9C2细胞中miR-486-5p表达明显上调,而匹诺塞林以剂量依赖方式削弱LPS对miR-486-5p表达的促进作用,提示匹诺塞林对LPS所致心肌细胞损伤的保护作用可能是通过抑制miR-486-5p表达实现的。转染anti-miR-486-5p进行功能分析发现,抑制表达可减弱LPS诱导的细胞凋亡,抑制cleaved-caspase3和cleaved-caspase9表达,降低MDA水平,并增加GSH-Px和SOD活性,与匹诺塞林的心肌保护作用相似。深入分析发现,转染miR-486-5p mimics过表达miR-486-5p还可减弱匹诺塞林对LPS诱导的H9C2细胞凋亡、cleaved-caspase3和cleaved-caspase9蛋白表达以及氧化应激损伤的影响,提示匹诺塞林通过下调miR-486-5p表达进而对LPS致心肌细胞氧化应激和细胞凋亡具有保护作用。
综上所述,匹诺塞林通过下调miR-486-5p表达对LPS致心肌细胞氧化应激和细胞凋亡具有保护作用,初步揭示了匹诺塞林的心肌保护作用机制,为匹诺塞林用于用于脓毒症心肌损伤治疗提供强有力的理论基础。
