非洲猪瘟疫苗及其诱导的免疫保护应答研究进展
2022-03-22袁梦淇马玉腾李永锋仇华吉
袁梦淇,马玉腾,王 涛,孙 元,李永锋,仇华吉
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
非洲猪瘟(African swine fever,ASF)是由ASF 病毒(ASFV)感染家猪和野猪引起的一种高度接触性传染病,不同日龄的猪均易感。急性型ASF 临床表现为高热、皮肤发绀和各脏器出血,病死率可高达100%,对全球养猪业造成重大的经济损失[1]。世界动物卫生组织(OIE)将ASF 列为法定报告动物疫病,我国将其列为一类动物疫病[2]。2018 年8 月,辽宁省沈阳市暴发了我国首例ASF 疫情,随后蔓延至我国各省[3]。由于目前尚无商品化的疫苗及治疗药物,所以ASF 的防控主要依靠检疫、扑杀以及严格的生物安全等措施。
ASFV 是非洲猪瘟相关病毒科(Asfarviridae)非洲猪瘟病毒属(Asfivirus)的成员,是一种基因组庞大、结构复杂的双股线状DNA 病毒。病毒粒子直径约为260 nm~300 nm[4],具有二十面体立体对称结构,由基因组、内核心壳、双层内膜、衣壳和外层囊膜构成。其基因组全长170 kb~194 kb,中央为长约125 kb的保守区,左端48 kb和右端22 kb为可变区,左右可变区主要是多基因家族(Multigene families,MGFs)100、MGF110、MGF300、MGF360、MGF505/530 以及p22 家族组成(图1),这也是不同分离株基因组长度存在差异的主要原因[5]。根据ASFV p72(B646L)基因末端的差异,可以分为24 个基因型。根据红细胞吸附抑制试验,可分为8 个血清群,其中我国流行的ASFV 属基因II 型,血清群8,且不同的基因型和血清群之间差异很大,增加了ASF 疫苗研发的难度[6-7]。ASFV 主要感染单核-巨噬细胞系统,通过肌动蛋白介导的内吞作用和巨胞饮作用侵入巨噬细胞,在巨噬细胞内完成复制、组装以及子代病毒颗粒的释放。ASFV 与其它大型DNA 病毒一样,具有逃避或抑制宿主免疫反应的机制[8-12]。由于病毒可以依赖于特定基因表达的机制专门操纵宿主的免疫应答致其发病机制变得更加复杂[13-14],比如ASFV 基因组编码了许多参与病毒组装、DNA 复制和修复及免疫调节的蛋白,如调控I 型干扰素(Interferon I,IFN-I)和细胞凋亡相关蛋白[15]。ASFV 编码超过165种蛋白,虽然目前已鉴定出68种结构蛋白,但仍有将近半数的ASFV 基因组编码的蛋白功能未知[16]。ASFV因其基因类型多,数量庞大,大多数蛋白质功能未知,免疫逃逸机制复杂多样,可逃避宿主免疫细胞的清除,所以一直未研制出有效的ASF 疫苗。但一些正在研究的ASF 疫苗在动物实验中却表现出一定的保护效力(表1),因此本综述总结了ASF 各类疫苗的最新研究进展及其诱导的免疫保护反应,以期为研制出安全有效的ASF商品化疫苗提供借鉴。
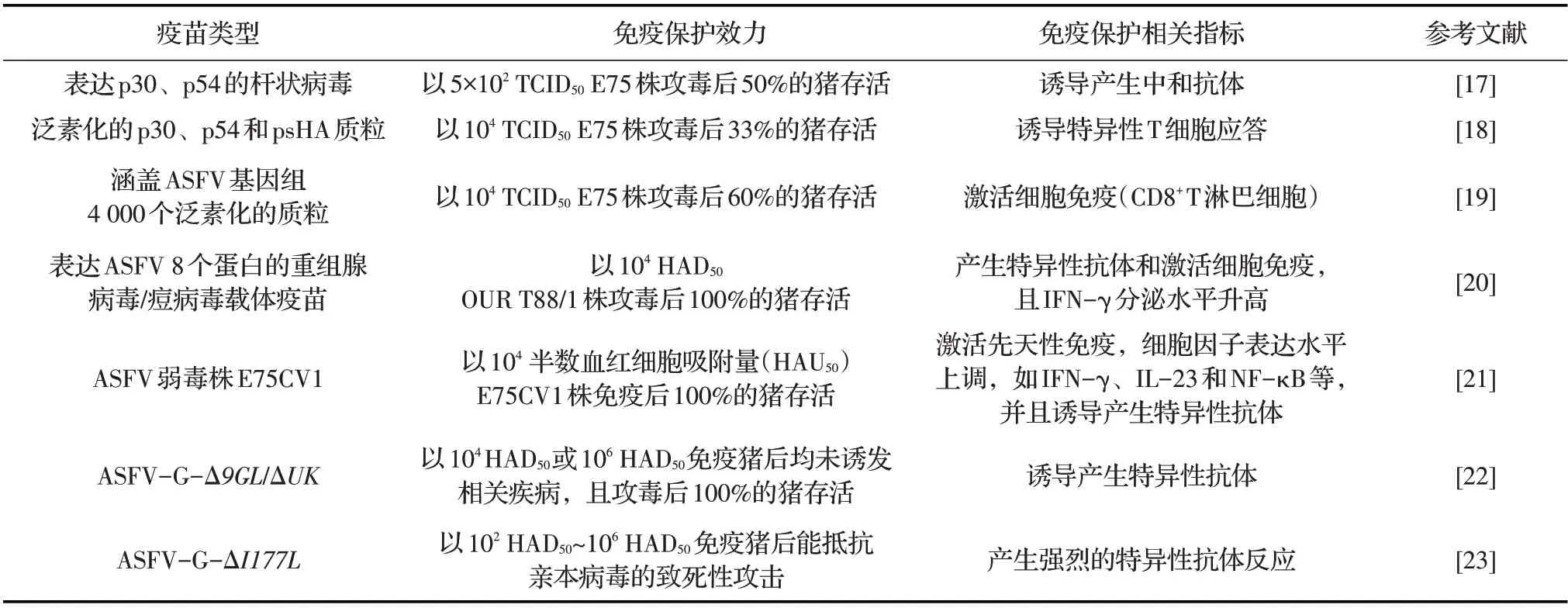
表1 不同类型ASF疫苗及免疫保护相关指标
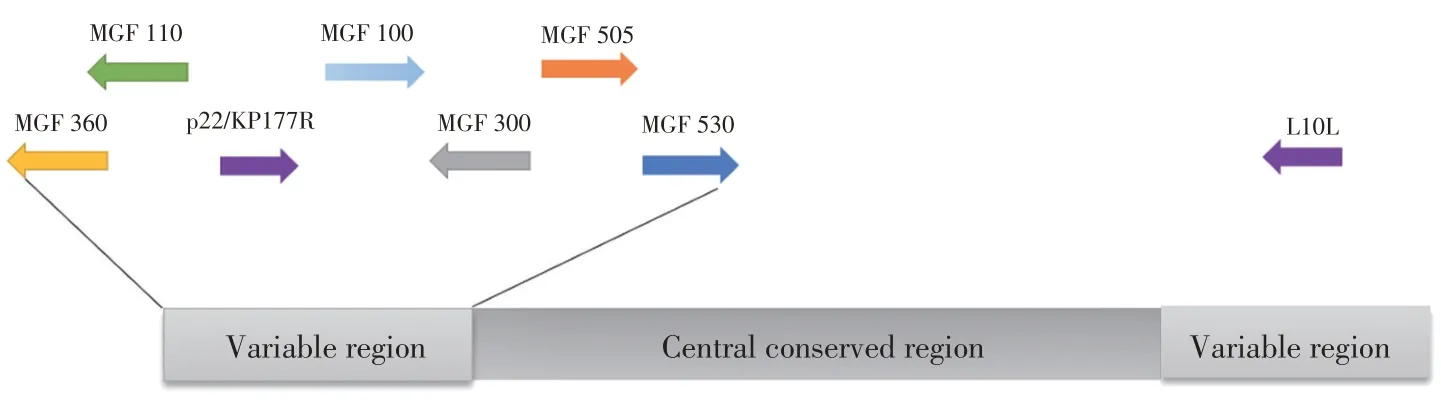
图1 ASFV基因组结构示意图
1 ASF 疫苗最新研究进展
1.1 灭活疫苗灭活疫苗是最经典的疫苗,免疫后可使机体产生基于体液免疫的免疫保护反应,且诱导产生的抗体具有中和、清除病原微生物的作用。早期ASF 疫苗的研究主要聚焦于灭活疫苗,通过加热、结晶紫、复方碘溶液、甲苯或甲醛等理化方式对ASFV 灭活[24]。但即使分别辅以新型佐剂PolygenTM或Emulsigen®-D 佐剂与疫苗乳化后接种的猪也不能抵御同源强毒株Armenia 08 的攻击[25]。在诱导对清除病毒感染的细胞至关重要的特异性细胞毒性CD8+T淋巴细胞方面,灭活疫苗也未显示出明显的效果[26]。因此,灭活疫苗不适用于ASF 的防控。但研制新的佐剂、采用新的或更无害的灭活程序则有助于提高灭活疫苗的效力。
1.2 亚单位疫苗和病毒活载体疫苗亚单位疫苗具有抗原蛋白高表达、低成本和高安全性等优点,ASF 亚单位疫苗的研究策略主要是在原核或真核细胞中表达ASFV 抗原基因,然后将表达的蛋白或多肽递呈到抗原递呈细胞(APCs)中,诱导机体产生针对ASFV 的抗体。病毒活载体疫苗由于缺失毒力基因或者复制必需基因,致使病毒无法复制,安全性较高,且病毒载体具有高转导效率和高表达水平等特点,可以高效表达病毒的免疫原性蛋白,一般而言,该类型疫苗的保护效力较高。因此,研制表达ASFV 免疫原性良好基因的病毒活载体疫苗也是ASF 疫苗的一个研究方向。目前常用的病毒载体主要有腺病毒(Adenovirus)、痘病毒(Poxvirus)以及甲病毒(Alphavirus)等。此外,病毒活载体疫苗还具有区分病毒感染动物和疫苗接种动物(Differentiating infected from vaccinated animals,DIVA)的优势。最近的研究表明,用单独表达ASFV 8 个蛋白(B602L、B646L、CP204L、E183L、E199L、EP153R、F317L 和MGF505-5R)的重组腺病毒混合后首免、再用重组痘病毒(单独表达上述8 个ASFV 蛋白)加强免疫的策略免疫猪,经ASFV 强毒株OUR T88/1 攻毒后可以为猪提供100%的免疫保护[20]。将表达ASFV 7 个蛋白(A151R、B119L、B602L、K205R、B438L、A104R和EP402RΔPRR)的重组腺病毒通过“鸡尾酒”式混合后免疫猪,可诱导其产生强烈的特异性IgG免疫应答[27],同时还产生了强烈的细胞免疫应答。表明该新型方式免疫能够诱导猪产生较全面的免疫应答。利用杆状病毒分别表达免疫原性良好的ASFV p30 和p54 蛋白,混合免疫后可在猪体内检测到中和抗体,且经ASFV 强毒株E75 攻毒后免疫猪能够全部存活[28]。但利用杆状病毒系统分别表达p54、p30、p72 和p22 蛋白,混合后免疫猪,虽然产生了中和抗体,却不能完全抵抗强毒株Pretoriuskop/96/4的攻击[17]。疫苗的免疫效果不一致推测可能是由于疫苗类型、疫苗接种策略、使用的抗原和诱导的免疫反应不同等所致。
1.3 天然或人工弱毒疫苗弱毒疫苗是一类将病毒的致病力减弱但仍具有免疫原性的疫苗,可分为天然或人工弱毒疫苗。因其具有与病原最接近的生物学特征,所以可以诱导机体完全的免疫反应。疫苗接种宿主后,可以诱导机体内B 细胞产生体液免疫反应,清除血液中的病原颗粒,阻止病原进入宿主细胞;除此之外,接种的疫苗还能够进入宿主细胞,激活机体T 细胞产生细胞免疫反应,从而识别、杀灭被病原侵入的宿主细胞。但是部分ASFV 弱毒疫苗,还需解决有效性及安全性等问题才有望成为安全高效的ASF 弱毒疫苗。
1.4 基因缺失疫苗研究表明,同时缺失ASFV 弱毒株OUR T88/3 中的NL(DP71L)与UK(DP96R)基因后免疫猪,再分别利用同源OUR T88/3 和同源强毒株OUR T88/1 攻毒,结果免疫猪的存活率分别为100%和66%,表明基因缺失疫苗可对免疫猪提供良好的保护[29]。早期研究也表明,接种低毒力ASFV的猪可以抵抗同源强毒株的致死性攻击,但面对异源病毒株的攻击,即使免疫猪产生了抗体也不能对其提供完全的保护[30-31]。通过使用同时缺失9GL(B119L)和UK 基因的致弱株免疫猪,再利用亲本病毒攻毒,结果在攻毒2 周后便可对猪提供免疫保护[22]。将缺失9GL 基因的ASFV Georgia 2007 株,以低剂量(102HAD50/mL~103HAD50/mL)免疫猪后能够完全抵抗亲本病毒的攻击[32]。最近报道,以ASFV Pig/HLJ/2018 株为骨架构建缺失MGF505-1R、MGF505-2R、MGF505-3R、MGF360-12L、MGF360-13L、MGF360-14L 和CD2v 7个基因的ASFV 基因缺失疫苗(HLJ/18-7GD),以高剂量(107.7TCID50/mL)接种猪后可对其提供抵抗ASFV 强毒株致死性攻击的能力[33]。将缺失I177L 基因的Georgia 2007 株以102HAD50/mL~106HAD50/mL 的剂量免疫猪后未出现明显的临床症状和排毒现象,且能抵抗亲本病毒的致死性攻击[23],上述结果表明缺失某个或数个毒力基因的ASF 基因缺失疫苗可以用于ASF 的防控。
2 ASF 疫苗诱导的天然免疫应答
2.1 免疫细胞B 细胞和T 细胞是机体中最为主要的免疫细胞,B 细胞不仅能通过产生抗体来发挥特异性体液免疫功能,也是重要的抗原递呈细胞; T细胞可介导适应性细胞免疫应答,且在胸腺依赖抗原(TD-Ag)诱导的体液免疫应答中发挥重要的辅助作用。使用表达ASFV p72 蛋白的重组新城疫病毒免疫小鼠,不仅产生了高滴度的特异性IgG 抗体,还促进了T 细胞的增殖和细胞因子的分泌(如IFN-γ、IL-4)[34]。而成熟的T 细胞一般只表达CD4 或CD8 分子,如CD4+T 淋巴细胞或CD8+T 淋巴细胞。CD4 和CD8 分子的主要功能是辅助T 细胞受体(TCR)识别抗原和参与T 细胞活化信号的转导。ASFV 主要靶向骨髓细胞和巨噬细胞,尤其靶向在免疫系统中起关键作用的抗原递呈细胞(APCs),如单核-巨噬细胞和树突状细胞(DC)等。
DC 可大量表达MHC-I 和MHC-II 类分子,分泌IL-12 等细胞因子。感染ASFV 猪的外周血单个核细胞(PBMC)可产生高水平的IFN-I,结果表明浆细胞样DC(pDC)可能是猪感染急性ASFV 后产生IFN-I 的来源,另外,一些ASFV 在感染猪的PBMC 中还可以诱导某些B 细胞激活因子的释放[35]。
自然杀伤(NK)细胞可以直接杀死病毒感染的细胞,还可产生细胞因子(如IFN)和趋化因子,在机体免疫监视和早期抗感染免疫中发挥重要作用。大多数IFN 是由NK 细胞分泌的,而研究证明IFN-γ 和IFN-α 可以抑制体外单核-巨噬细胞以及一些支持ASFV 复制的细胞系中ASFV 的复制,说明NK 细胞的活性与ASFV 的致病性之间呈负相关[36-37]。
2.2 细胞因子研究表明,ASF 弱毒疫苗诱导的免疫保护与ASFV诱导的细胞因子有关。如ASFV弱毒株E75CV1在感染猪1 d后即可有效激活先天性免疫,研究细胞因子CD163、IL-1β、IFN-γ、IL-5、IL-6、IL-12 p40(IL-12 的一个亚基)、肿瘤坏死因子-α(TNF-α)、IL-10和转化生长因子-β受体1(TGF-βR1)的表达水平均显著上调;且在感染7 d后,IFN-γ、IL-5、TNF-α、TGF-βR1、IL-21和IL-23的表达水平均显著上调,而防御素β1(DEFB1)、CD163、IL-13和IL-18的表达水平均显著下调;感染ASFV E75CV1 株后幸存猪体内的IL-23、IFN-γ 和NF-κB 的表达水平均上调,而IL-1β 和IL-4 的表达水平显著下调[21]。以上数据表明细胞因子在抵御ASFV 的感染过程中发挥关键作用,然而具体哪些细胞因子可以作为评价ASF 疫苗诱导的免疫保护指标尚需进一步研究。
IFN 是天然免疫的重要组成部分,在机体抗病毒方面发挥重要作用。IFN 诱导的抗病毒分子可以抑制病毒在细胞内的复制和细胞间的扩散,从而抑制病毒在感染细胞以及周围非感染细胞中的复制[38]。此外,IFN 介导的信号通路不仅能够诱导宿主抗病毒蛋白的表达,还能通过增强MHC 分子的表达促进抗原的递呈。已有研究表明,猪IFN-I 和IFN-II 可以有效抑制ASFV 的复制,且将二者高剂量联合使用后,该抑制效果更为显著[37]。虽然细胞中IFN 的产生受到信号通路中各因子的层层调控,但ASFV 已经进化出多种策略逃逸IFN 的抗病毒反应,且能够作用于IFN 信号通路的不同靶点进而抑制IFN 的分泌、抑制IFN 介导的信号通路,以及拮抗IFN 诱导的具有抗病毒活性酶的作用等。如ASFV MGF360 家族的A276R 基因通过靶向Toll 样受体3(TLR3)抑制IFN-β 的产生;TLR3 的同源物I329L 可在Toll 样受体(TRIF)水平抑制IFN 的分泌等[10]。有研究表明,ASFV 编码蛋白I226L、A151R、NP419L和QP383R 可以抑制由ASFV 感染而引发的炎症反应[39]。据此可以从ASFV 中筛选出能够抑制IFN 分泌的某个基因并对其进行敲除,或者开发能够促进IFN 分泌的疫苗或药物用于促进宿主的IFN 分泌水平,进而发挥其抗病毒作用。
3 ASF 疫苗诱导的特异性免疫应答
3.1 ASFV 特异性抗体与免疫保护在抵御病毒感染的过程中发挥重要作用的抗体是体液免疫中的主要效应分子,尤其是中和抗体,在清除病毒方面尤为重要,所以探寻诱导机体产生针对ASFV 中和抗体的蛋白或表位势在必行。虽然早在几十年前就有报道制备出了识别ASFV 主要衣壳蛋白p72 的中和性单克隆抗体(MAb)[40],不过却没有进一步的研究。而后就有学者提出,ASFV 并不能诱导机体产生中和抗体,其原因主要在于免疫组织损伤、病毒遗传变异、抗原竞争、免疫抑制、免疫逃避或“木马”机制等[41]。不过后来的研究表明ASFV 的p72、CD2v、p12、p54、D117L 和p30 等蛋白均可诱导机体产生中和抗体,其中针对p72 和p30 蛋白的中和抗体可以分别抑制ASFV 的吸附和内化,并且均可激活机体的CTL 应答;而机体产生的针对膜蛋白CD2v、p12 和D117L 的抗体则可以参与抑制ASFV 的侵入和子代病毒粒子的释放等。尽管p54、p72 和p30 抗体能够分别抑制ASFV 的吸附和内化,但在猪体内存在上述相应抗体时并不能对其提供一定的免疫保护,因此,它们并不是典型的中和抗体[17,28]。将重组CD2v 蛋白接种3 次后,再用基因I 型ASFV E75 株攻毒,发现免疫猪产生了针对CD2v 蛋白的特异性抗体,虽然免疫猪在攻毒后均能够存活,但却存在排毒现象,这表明CD2v 的免疫原性可能并不强,可能需要高剂量才可诱导良好的免疫保护[42]。也有研究表明,B119L 和DP96R 双基因缺失的弱毒株可以在免疫后2 周对猪提供免疫保护,其诱导的免疫保护与野生型病毒诱导产生的特异性抗体有关,与病毒特异性激活的能够分泌IFN-γ 的细胞无关[22]。这说明虽然传统灭活疫苗抗ASFV 感染的效果不佳,但其产生的抗体在延迟发病、降低病毒血症方面却有一定的作用。仅诱导高水平的细胞免疫却无法诱导抗体产生的人工修饰的DNA 疫苗(与泛素基因融合表达的HA、p54 和p30),可对猪提供33%的免疫保护[18]。进一步研究表明,使用仅激活特异性细胞免疫应答的DNA 疫苗(表达涵盖ASFV 基因组的4 000 个泛素化修饰的质粒)免疫猪可获得60%的免疫保护[19]。因此, 能否诱导猪体产生针对ASFV 的抗体仍是ASF 疫苗免疫保护评价的重要指标。
3.2 ASF 疫苗诱导的CTL 与免疫保护多项研究表明机体接种疫苗后产生的特异性细胞(CD8+T、CD4+T 细胞)在免疫保护中发挥重要作用[18,43-46]。研究发现猪接种疫苗后可以诱导体内产生大量特异性的CD8+T 淋巴细胞,而这些特异性淋巴细胞则可以帮助机体抵御ASFV 的致死性攻击;还有研究发现异源ASFV 的感染同样可以激活猪体内的特异性CD8+T 淋巴细胞,而且产生的免疫保护机制与同源ASFV的类似。例如,使用ASFV低毒力BA7N-ΔCD2v株免疫猪,免疫后再使用异源强毒株E75 OUR T88/1 攻毒,结果发现猪体内也可以诱导产生并激活CD8+T 淋巴细胞,被激活的CD8+T 淋巴细胞可以裂解ASFV 感染后的巨噬细胞,且CD8+T 淋巴细胞会随着ASFV 的减少而减少,直至完全消除ASFV[29,47-48]。这表明CD8+T 淋巴细胞在杀灭ASFV 时中起到了关键的作用。反之,将CD8(IgG2a)MAb 注射到已经接种过ASFV 弱毒株OUR/T88/3 的猪体内,消耗一部分CD8+T 淋巴细胞后,则会抑制猪体的保护性免疫应答,致使猪不能完全抵御ASFV 同源强毒株OUR/T88/1 的致死性攻击[44]。这进一步证明了ASF疫苗诱导的免疫保护与其诱导的特异性细胞免疫反应密切相关,且特异性T 淋巴细胞的活化是ASF 疫苗诱导的免疫保护中极为重要的指标。所以说未来疫苗的研究方向应该侧重于研发能够激活机体细胞免疫的相关疫苗。
由于激发有效CTL 免疫应答的并不是一个完整抗原分子,而是抗原分子中的一个或多个特异性的CTL 表位,所以对ASFV 保护性抗原、相关细胞表位及其表位多样性的解析将有助于促进ASF 亚单位疫苗的设计和研发。自从于ASFV p30 蛋白鉴定到第一个CTL 表位后,陆续又从其衣壳蛋白p72 和G1340L鉴定到了CTL 表位。Burmakina 等通过酶联免疫斑点吸附试验(ELISpot)对IFN-γ 的分泌水平进行测定,然后又分离免疫ASFV 动物的PBMCs,鉴定了存在于CD2v 和C 型凝集素(EP153R)的6 个离散T 细胞表位,且分别鉴定了在ASFV 免疫后和感染后这些蛋白诱导机体产生的细胞免疫保护的相关指标,结果表明CD2v 还可以通过刺激特异性CD8+T 淋巴细胞的增殖来增强其杀灭ASFV 的能力,进而对机体产生保护作用[49]。
4 小结与展望
因ASFV 基因组结构复杂、免疫逃避机制多样、侵入机制不明确以及缺乏合适的细胞系等难点,使得对ASF 的认知和防控尤为困难,以至于抗衡ASF 之路艰难而漫长[50-51]。为了防控ASF,首先要注重加强传统的防控措施,如实施严格的生物安全措施、执行精准清除方案以及开展有效的流行病学调查等。此外,还要拓展新型养殖模式,如发展特色新型养殖新模式(实现机器自动给水送料、设备自动温控、建立可循环利用的生态发酵床等)。基于目前对ASFV 的分子免疫学和疫苗研究现状,还要加快对ASFV 毒力相关基因的免疫原性筛选和功能解析,以此构建出更高安全性并且可以诱导持久免疫力的疫苗候选株。目前利用天然分离或敲除毒力相关基因的ASFV 致弱株制备ASF 弱毒活疫苗是一个热点,但要充分评价其安全性,比如是否存在不良反应、垂直传播、毒力返强等安全风险。此外,ASF 亚单位疫苗、核酸疫苗、病毒活载体疫苗等基因工程疫苗因其较高的安全性,以及这些疫苗在有效性和鉴别诊断等方面的优势明显,所以也可以作为研究方向。但是由于ASFV 基因组庞大以及免疫逃逸机制复杂,因此需要充分解析ASFV 主要蛋白的结构功能,筛选保护性抗原,寻找最佳的ASFV 蛋白组合和免疫递送策略,例如以感染ASFV存活猪的阳性血清筛选诱导产生ASFV 保护性抗体的蛋白,以感染ASFV 存活猪的PBMCs 筛选诱导产生ASFV 保护性细胞免疫的蛋白,将有效筛选出诱导ASFV 保护性免疫反应的蛋白,继而开展基因工程疫苗的研究。然而限制ASF 疫苗研究的因素除了ASFV 结构复杂、编码蛋白多样以及不能诱导产生中和抗体外,还有一个经常被忽略的潜在的限制因素一抗体依赖性增强(Antibody-dependent enhancement,ADE)效应。多项研究表明,机体经灭活病毒免疫后,甚至是经安全性较高的亚单位疫苗免疫后,均可观察到临床症状加重的现象[25,52-53]。这表明ADE 效应在ASFV 发病机制中发挥着一定的作用,该效应也可能是现有疫苗不能提供长期保护力的一个原因,因此在今后的研究中需要鉴定出能够诱导机体产生ADE 效应的ASFV 蛋白并在疫苗研发过程中避开使用编码这些蛋白的基因。
总之,ASF 疫苗的创制之路仍任重而道远,新的研发策略如在开发复制缺陷型疫苗、mRNA 疫苗以及新型佐剂和新型载体等方面均可尝试,但无论哪种类型的候选疫苗均需要在保证生物安全的前提下,兼顾其可以诱导机体产生保护性抗体和细胞免疫应答,这样才能加快ASF 疫苗的研发进程,有望研制出安全有效的商品化ASF 疫苗。
