基于单核细胞增生李斯特菌actA 基因的环介导等温扩增技术快速检测方法的建立
2022-03-22胡仲皓单兴根何晓花吴金节胡青海
胡仲皓,单兴根,何晓花,吴金节*,胡青海*
(1.安徽农业大学动物科技学院,安徽 合肥 230036;2.中国农业科学院上海兽医研究所,上海 200241)
单核细胞增生李斯特菌(Listeria monocytogenes,Lm),是一种主要且常见的食源性致病菌,也是一种重要的人畜共患病原菌。土壤、地表水、污水、废水、植物、烂菜中均有该菌存在,所以动物很容易食入该菌,并通过口腔-粪便等途径传播[1]。Lm是胞内寄生菌,且能够穿越家畜体内的肠道屏障、血脑屏障、血胎屏障[2],从而引发脑膜炎、败血症、流产等特征症状的家畜李氏杆菌病,严重制约动物养殖业的发展,因此建立一种快速、灵敏、特异的Lm 检测方法对人畜公共卫生安全尤为重要。
建立快速精准检测Lm 的技术,对及时掌握Lm的感染和流行情况具有重要意义,也有助于及时发现Lm 感染疫情,增强对重大Lm 感染疫情的预警预报能力,确保动物及其产品安全。目前我国Lm 的国家标准检测方法是将选择培养基中分离培养后的疑似菌落进行生化试验、血清学试验等,但该方法耗费时间较长,无法做到高通量检测。近年来越来越多Lm 的检测方法被研究出来,其中分子生物学方法因其特异性强、敏感性高、操作简单快速等特点应用较为广泛,如多重PCR 技术、荧光定量PCR 技术、环介导等温扩增技术(LAMP)、重组酶聚合酶扩增技术(Recombinase polymerase amplification,RPA)、CRISPR 技术等。Notomi 等在2000 年发明了LAMP 技术[3],该技术不需要高端昂贵的仪器设备、结果可视且检测成本低,目前LAMP 检测方法已被广泛应用于细菌、病毒以及寄生虫等病原体的快速检测[4-7]。
基于此,本研究以Lm 中核苷酸序列较为保守的毒力基因actA作为靶基因来建立LAMP 的检测体系,该技术适用于基层实验室和现场快速检测,是人畜公共卫生安全监测的重要手段,为建立和完善食源性病原菌的监测网络提供技术手段。
1 材料与方法
1.1 主要实验材料10×Isothermal Amp Buffer Ⅱ、MgSO4和Bst DNA 3.0 Polymerase 购自NEB 公司;dNTP Mix 购自Vazyme 公司;TIANamp Bacteria DNA Kit购自天根生化科技(北京)有限公司;SYBR Green I(10 000×)购自北京索莱宝科技有限公司;DS2000 DNA Marker 购自东盛生物科技有限公司。
本研究使用的Lm LMF2365 和金黄色葡萄球菌(Staphyloccocus aureus)ATCC 29213 由上海农业科学院索玉娟博士惠赠;肠出血性大肠杆菌(Enterohemorrhagic E. coli)O157:H7 ATCC43889、鼠伤寒沙门氏菌(Salmonella typhimurium)SL7207、小肠结肠炎耶尔森菌(Yersinia enterocolitica)ATCC23715、产气荚膜梭菌(Clostridium perfringens)SH01、空肠弯曲菌(Campylobacter jejuni)CJFX01、胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae)Aha01、副猪嗜血杆菌(Haemophilus suis)Ahh01、多杀性巴氏杆菌(Pasteutella multocida)Ahm03、 猪链球菌(Streptococcus suis)Ahs02、 猪丹毒丝菌(Erysipelothrix rhusiopathiae)Ahe01 和支气管败血波氏杆菌(Bordetella bronchiseptica)Ahb01 由本实验室保存。
1.2 引物的设计与合成采用BLAST(http://blast.ncbi.nlm.nih.gov/)对LM19860 株actA基因序列(DQ309 883.2)进行分析,并采用MSA Viewer 程序将actA基因(DQ309883.2)与BLAST 搜索到的其他菌株的同源序列进行同源比对分析后,根据GenBank 中Lm 的actA基因序列(DQ309883.2),利用Primer Explorer V5 软件(http://primerexplorer.jp/e/)在线设计多套LAMP 引物(表1)。同时利用Primer3 软件(https://bioinfo.ut.ee/primer3-0.4.0/)设计常规PCR 扩增引物(表1)。引物由英潍捷基贸易有限公司合成。

表1 LAMP和常规PCR扩增引物Table 1 The primers used for LAMP and conventional PCR
1.3 LAMP 引物的筛选为评估设计的3 套引物用于LAMP 检测的可行性,本研究以细菌基因组DNA 提取试剂盒提取Lm 的基因组DNA 作为阳性模板,以肠出血性大肠杆菌O157:H7、鼠伤寒沙门氏菌、金黄色葡萄球菌、小肠结肠炎耶尔森菌、产气荚膜梭菌、空肠弯曲菌基因组DNA 为阴性模板进行LAMP 检测。反应体系如下:10×Isothermal Amp Buffer Ⅱ2.5 μL,MgSO4(100 mmol/L)1.5 μL,dNTP Mix(10 mmol/L)3.5 μL,引物FIP 和BIP 各4 μL,引物F3 和B3 各0.5 μL(actA-1 至actA-3 的加样体积均如此),Bst 3.0 DNA Ploymerase 1 μL,模板DNA 1 μL,加超纯水至25 μL。65 ℃恒温孵育1 h,85 ℃5 min。取10 μL 反应产物经2%琼脂糖凝胶电泳检测。
1.4 LAMP 反应体系的优化与可视化检测以方法1.3 所述LAMP 体系建立基础反应体系,采用方阵法[7]分别优化退火温度(61 ℃、62 ℃、63 ℃、64 ℃、65 ℃)、MgSO4浓度(2 mmol/L、4 mmol/L、6 mmol/L、8 mmol/L)、内引物FIP/BIP 和外引物(F3/B3)比例(4∶1、6∶1、8∶1),从而确定LAMP 最佳反应条件。同时,以最优反应条件进行实验,扩增结束后取10 μL反应产物和上样缓冲液混合后,经2%琼脂糖凝胶电泳检测。剩余15 μL 反应产物中加入1 μL SYBR Green I,肉眼或在365 nm 的紫外光下观察结果。
1.5 特异性试验利用细菌基因组DNA 提取试剂盒提取Lm、肠出血性大肠杆菌O157:H7、鼠伤寒沙门氏菌、金黄色葡萄球菌、小肠结肠炎耶尔森菌、产气荚膜梭菌、空肠弯曲菌、胸膜肺炎放线杆菌、副猪嗜血杆菌、多杀性巴氏杆菌、猪链球菌、猪丹毒丝菌和支气管败血波氏杆菌的基因组作为模板,按优化后的LAMP 方法扩增,并进行可视化检测,评估本实验建立的Lm LAMP 方法的特异性。
1.6 敏感性试验将浓度为4.7×109cfu/mL 的Lm 菌液采用0.9% NaCl 10 倍倍比稀释(4.7×109cfu/mL~4.7×100cfu/mL)后,分别提取DNA 并按上述优化后的LAMP 体系进行检测,同时利用PCR 引物F/R 进行常规PCR 检测,比较两种方法的敏感性,评估本研究建立的LAMP 敏感性。
1.7 临床样品检测将2020 年7 月~2021 年1 月从上海市18 个菜市场中采集11 个批次118 个猪肉样品在低温条件下快速运输至实验室后-20 ℃保存备用。取5 g 猪肉样品浸入TSA 液体培养基,37 ℃培养10 h 后,取1 mL 菌液提取细菌基因组DNA,分别采用本研究建立的LAMP 反应体系和常规PCR 方法进行检测,同时对样品按照现行食品国家安全标准(GB4789.30-2016)中的检测方法,先用PALCAM 培养基初筛,再进行生化实验等鉴定Lm。比较3 种方法的检测结果,并计算总体符合率。
2 结 果
2.1 靶基因选择及特异性和保守性分析选取LM19860 株actA基因序列(DQ309883.2)进行BLAST 分析,结果显示采用Highly similar sequences(Megablast)程序时,有1 078 条核苷酸序列与其有同源性,且全部来自Lm。其中有actA基因完整ORF 的有611条,LM19860 株与其他610 株LmactA基因的同源性为94%~100%;当采用More dissimilar sequences(Discontiguous megablast)程序BLAST 时,有1 085 条核苷酸序列与actA基因有同源性,除了1 078 条来自Lm外,有6 条长度为115 bp~117 bp 的核苷酸序列来自西尔李斯特菌(Listeria seeligeri),与LM19860株actA基因片段同源性均为75%;另一条长度为66 bp 的核苷酸序列来自绵羊李斯特菌(Listeria ivanovii),与LM19860 株actA基因片段同源性为73%。但这两种菌株的同源性片段并不在本研究中LAMP 扩增的核苷酸区域内。上述结果表明actA基因作为检测靶基因具有良好的特异性。
采用MSA Viewer 进行多序列对比分析结果显示,不同Lm 菌株的actA基因前300 bp 同源性高,因此应选择actA基因5'端300 bp 内设计LAMP 引物。本研究设计的actA-3 引物组的扩增片段位于actA基因(DQ309883.2)第59 nt~262 nt,在不同的Lm 菌株间仅存在极少数的碱基替代,其主要的碱基替代出现在第88 nt(内引物FIP)、第245 nt(外引物B3)、在第153 nt、217 nt 和219 nt(内引物BIP)。引物中少数碱基替代对LAMP 的扩增反应影响很小。
2.2 引物筛选结果以Lm 基因组作为阳性模板,其他病原菌的基因组和水作为阴性及空白对照,分别评估3 套引物的LAMP 扩增结果。结果显示,引物组actA-1 对各食源性致病菌模板无明显扩增条带(图1A);引物组actA-2对肠出血性大肠杆菌O157:H7、鼠伤寒沙门氏菌的基因组产生扩增,对剩余菌株模板无明显扩增条带(图1B);引物组actA-3 作为检测引物时,只有阳性模板Lm 基因组出现典型的梯形扩增条带,其他非Lm 菌株和水均无扩增条带(图1C)。以上结果表明,所设计的actA-1 引物组不能实现扩增actA基因的目的;actA-2 引物组特异性差,无法用于Lm 的LAMP 检测,而actA-3 引物组的特异性强,因此本研究选取actA-3 引物组作为Lm LAMP 检测体系的引物。
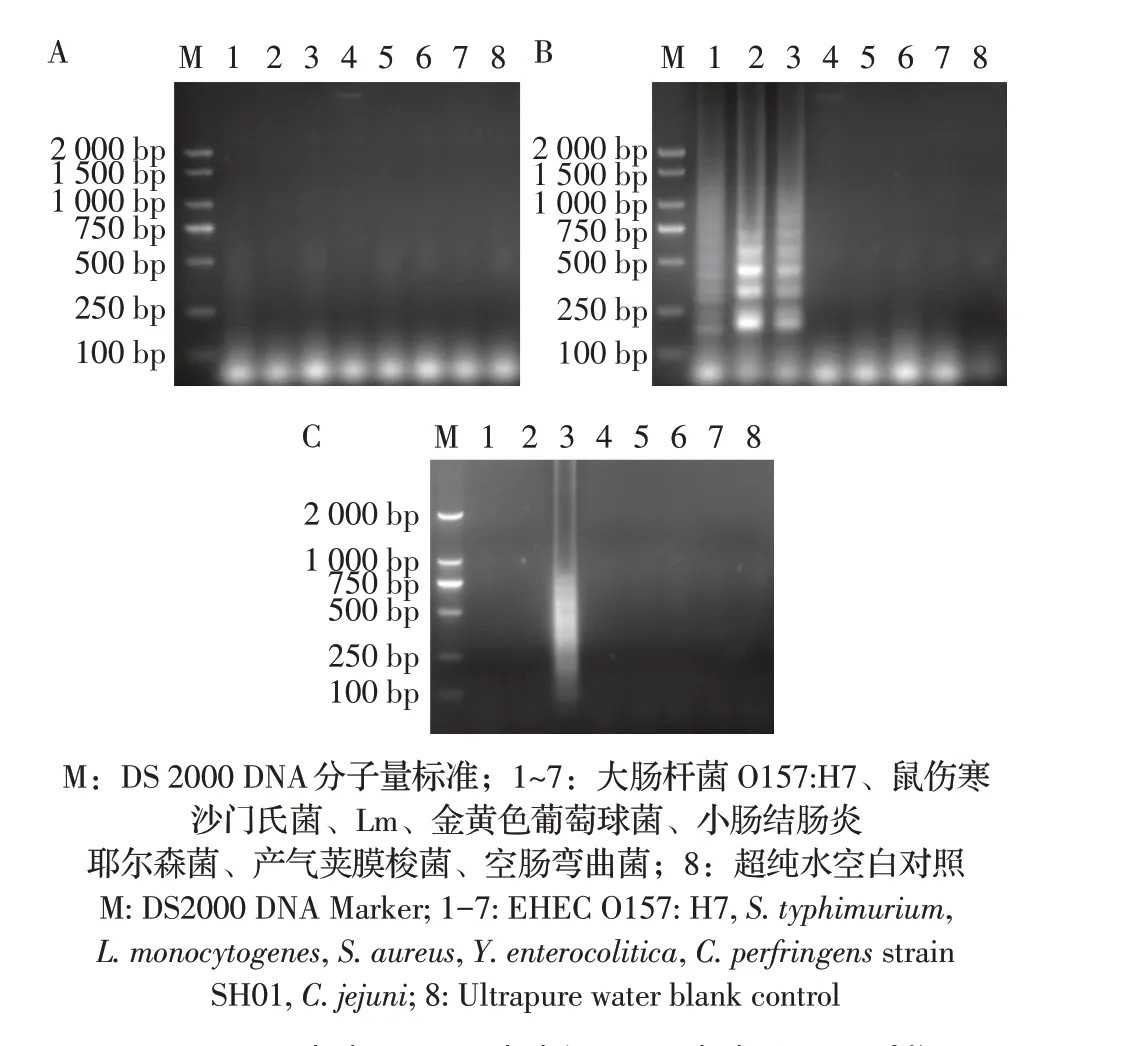
图1 actA-1(A)、actA-2(B)和actA-3(C)3组不同引物进行LAMP反应的结果Fig.1 Results of LAMP reaction with three different primers actA-1(A),actA-2(B)and actA-3(C)
2.3 LAMP 反应体系优化结果在LAMP 反应体系中,经过对反应温度、MgSO4浓度、内外引物比例的筛选优化,确定最佳反应温度为64 ℃、最佳MgSO4浓度为6 mmol/L、最佳内外引物比例为8∶1。在反应体系中(等温扩增之前)或在反应结束后加入1 μL SYBR Green I,均能进行LAMP 扩增结果的可视活检测。
2.4 特异性试验结果分别以Lm、肠出血性大肠杆菌O157:H7、鼠伤寒沙门氏菌、金黄色葡萄球菌、小肠结肠炎耶尔森菌、产气荚膜梭菌、空肠弯曲菌、胸膜肺炎放线杆菌、副猪嗜血杆菌、多杀性巴氏杆菌、猪链球菌、猪丹毒丝菌和支气管败血波氏杆菌的DNA 以及ddH2O 为模板,按优化后的LAMP 方法扩增,并进行可视化检测。结果显示,仅Lm 出现扩增条带,dd H2O 和其他12 个菌株均无明显扩增条带(图2A);在肉眼观察下只有Lm 对应的反应管呈现黄绿色(图2B);在365 nm 的紫外光观察下只有Lm 对应的反应管发出绿色荧光(图2C),ddH2O 和其他细菌反应管无明显的绿色荧光。结果表明,本研究建立的LAMP 检测方法特异性较强。

图2 LAMP的特异性试验结果Fig.2 The specificity results of LAMP
2.5 敏感性试验结果提取10倍倍比稀释后的Lm菌液基因组DNA(浓度为4.7×109cfu/mL~4.7×100cfu/mL),按优化后的LAMP 方法进行扩增。结果显示,LAMP法检测Lm 的下限为4.7×101cfu/mL(图3A),而常规PCR 检测Lm 的下限为4.7×103cfu/mL(图3B)。LAMP方法比PCR 方法的敏感性高100 倍。结果表明,本研究建立的LAMP 方法敏感性较高。
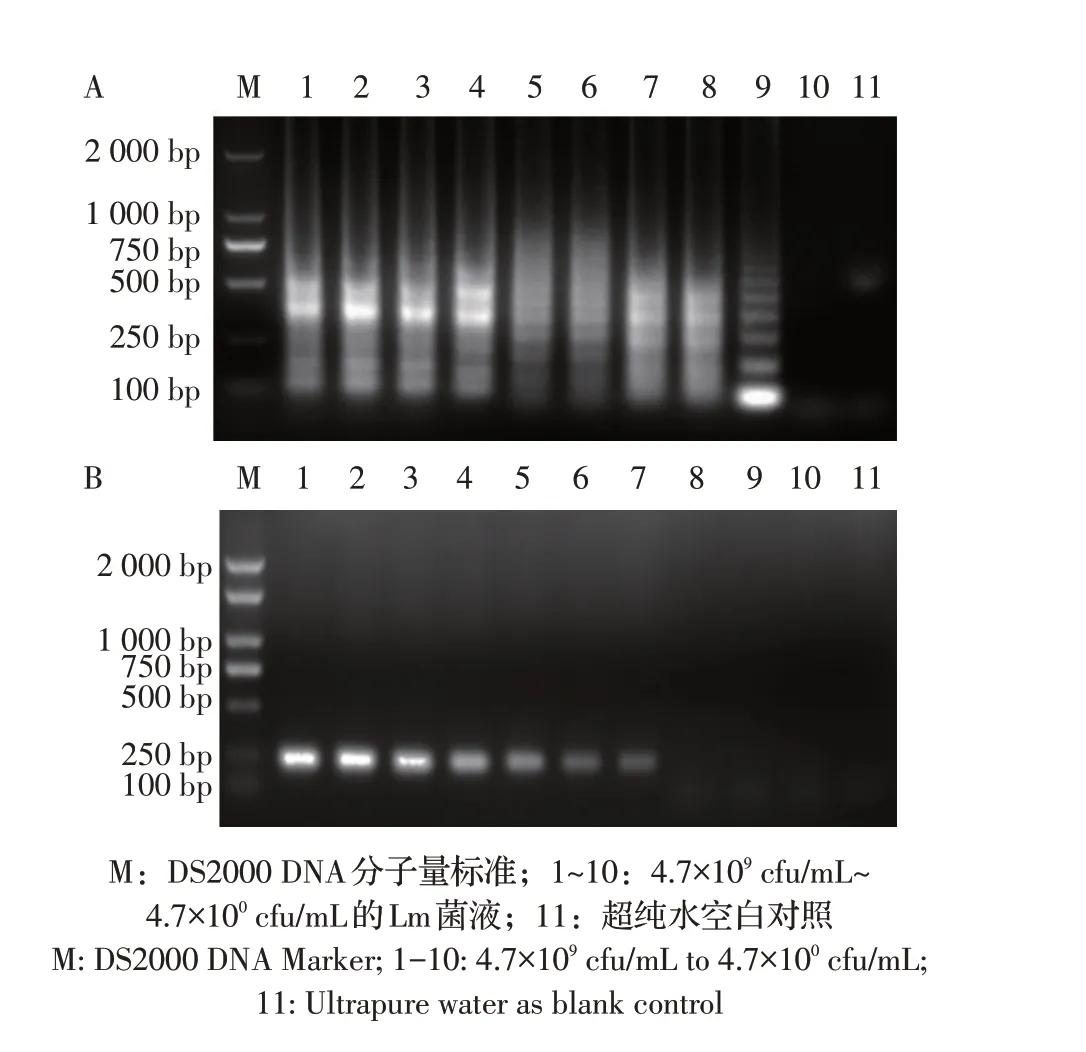
图3 LAMP(A)和常规PCR(B)敏感性试验结果的比较Fig.3 Comparison of the sensitivity of LAMP(A)and conventional PCR(B)
2.6 临床样品检测结果利用优化后的LAMP 方法、常规PCR 方法和国标检测方法对采集的118 份猪肉临床样品进行检测。LAMP 方法检测结果显示,除了Lm LMF2365 基因组DNA 阳性对照外,仅有9、12、43 样品为阳性,即9、12、43 号的猪肉临床样品检测到Lm,阳性率为2.54%(3/118),该结果与常规PCR 检测结果、国标检测结果均一致,二者的总体符合率达100%。表明本研究建立的Lm LAMP 方法可以用于临床样品的检测。
3 讨 论
本研究曾尝试采用hly基因作为靶基因来建立LAMP检测方法,共设计了3套引物,但建立的LAMP方法均出现了非特异性扩增。随后本研究选择核苷酸序列比hly基因要保守些的(作者采用BLAST 和MSA viewer 分析的结果)actA基因作为检测靶基因,共设计了3套引物,结果基于actA-3引物组成功建立了Lm的LAMP检测方法。这提示建立LAMP检测方法过程中,靶基因的选择和引物的设计同样重要。
特异性和敏感性是评价食源性致病菌检测方法的重要指标。本研究使用其他常见的食源性致病菌和猪肉中常见的致病菌来进行特异性分析,结果表明本研究建立的LAMP 检测体系具有高度特异性。在敏感性方面,本研究建立的LAMP 检测方法检测下限为4.7×101cfu/mL。许龙岩等针对编码溶血素的hly基因及内化素InlA基因分别设计引物和TaqMan 探针,建立了Lm的荧光定量PCR检测方法,对Lm最低检测限为2.5×102cfu/mL,但检测时间较长约为20 h[8]。Garrido 等将RPA 技术与qPCR 结合,针对Lm 编码溶血素的hly基因建立的检测方法[9],该方法25 g 样品中对Lm的最低检测限达到了6.3 cfu/mL,但该检测方法需要昂贵的荧光定量PCR 检测仪器和专业的操作人员,不便于现场快速检测。贾甜甜针对Lmhly基因建立了最低检测限为9.47×101cfu/mL 的LAMP 检测体系[10]。Nathaniel 等针对Lm 编码内化素蛋白的lmo0753 基因建立了检测下限为38 cfu/mL 的LAMP 检测方法,其敏感性与本研究的检测方法相近,但该方法未做到可视化检测[11]。
随着LAMP 扩增的进行,dNTP 会释放焦磷酸根离子,与体系中的Mg2+离子形成焦磷酸镁沉淀。一般情况下,白色沉淀与反应液中的双链DNA 含量成正比,因此有报道通过浊度仪检测焦磷酸镁的沉淀量来定性反应程度[12]。但在实际实验操作中,一般焦磷酸镁沉淀量产生较少,在检测低浓度模板时难以观察到。有研究者在反应体系中加入钙黄绿素,该指示剂能在Mg2+离子与焦磷酸根离子结合时发出荧光[12]。但有学者发现,体系中加入钙黄绿素会导致LAMP 检测的敏感性降低。本研究通过在反应中加入SYBR Green I 核酸染料实现了可视化检测,当反应为阳性结果时呈绿色伴有荧光,阴性结果时为橙色,且可减小开盖时造成的气溶胶污染。但使用SYBR Green I 对引物设计的要求较高,引物二聚体也会和染料产生少量荧光,影响实验结果[13]。
建立Lm 快速检测体系,是有效预防和控制食源性病原菌感染的重要基础,有利于建立和完善食源性病原菌的监测网络,为国家制定食品安全政策、法规、标准提供重要依据。
