白细胞介素-6基因敲除对创伤失血性休克小鼠肺组织Syndecan-1的影响及机制
2022-03-22范颖楠冯筑生于超平谢建刚王倩梅刘善收
范颖楠,冯筑生,于超平,谢建刚,王倩梅,刘善收,尹 文
空军军医大学西京医院急诊科,西安 710032
近年来,对于创伤失血性休克(traumatic hemorrhagic shock,THS)的病理生理学机制认识持续深入,相关的诊治指南继续更新发展。在2019版的《严重创伤出血和凝血病出血欧洲指南(第五版)》[1]中,系统性内皮病(systemic endotheliopathy,SE)作为创伤性凝血病(traumatic coagulopathy,TC)发生发展中的一个阶段被正式提出。SE主要相关因素包括交感肾上腺素激活、炎症、多糖蛋白复合物脱落、血小板激活与失活、内源性肝素化、凝血因子活性降低、纤溶功能异常等[2-3]。
多配体蛋白聚糖家族(Syndecans)是一类广泛存在于内皮和上皮细胞表面的跨膜糖蛋白,已知的四个Syndecan蛋白具有相似的结构,大致都分为胞外区、跨膜区和胞内区[4-5]。Syndecan-1(SDC1)是该家族中的主要成员,当前对于SDC1的研究最为广泛和深入,最近研究[6-8]显示肺血管内皮损伤在THS后急性肺损伤(acute lung injury,ALI)发病过程中扮演重要角色,而SDC1是血管内皮表面多糖蛋白的核心成分。
白细胞介素-6(IL-6)是创伤/休克后主要的炎症指标之一,而脱落的SDC1被认为是创伤/休克严重程度和预后判断的重要指标。多项创伤/休克相关研究[9-11]都显示创伤或休克后组织和血清中的IL-6与SDC1存在一定的相关性,但其具体的作用机制尚不清楚,而炎症和多糖蛋白复合物脱落是SE研究领域重要的构成部分,本研究拟探索IL-6基因敲除(knockout,KO)对THS小鼠肺组织SDC1的影响及机制。
材料与方法
1材料
1.1主要试剂与仪器 小鼠SDC1抗体、小鼠基质金属蛋白酶-9(matrix metalloproteinase-9,MMP9)抗体(美国Novus Biologicals公司),小鼠磷酸化蛋白激酶B(phospho-AKT,p-AKT)抗体、小鼠AKT抗体、二抗(美国Cell Signaling Technology公司),小鼠β-actin抗体、小鼠磷酸化核因子-κB(phospho- nuclear factor kappa-B,p-NF-κB)抗体、小鼠NF-κB抗体、CY3试剂、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)试剂、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗原修复液、自发荧光淬灭剂、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)、抗荧光淬灭封片剂(武汉赛维尔生物科技有限公司),正置光学显微镜、成像系统(日本尼康公司),电泳仪(美国Bio-Rad公司),TRIzol试剂(美国Therrno Fisher公司),mRNA反转录试剂盒(美国TaKaRa 公司),SYBR@Green荧光定量试剂(上海生工生物工程股份有限公司),实时定量PCR 引物(广州锐博生物技术有限公司),实时定量PCR 仪(美国Agilent公司)。
1.2实验动物 IL-6 KO小鼠由空军军医大学免疫学教研室惠赠,无特定病原体(specific pathogen free,SPF)级C57BL/6购自空军军医大学实验动物中心,IL-6 KO小鼠与C57BL/6小鼠回交后,经小鼠基因鉴定(PCR扩增法)后最终获得野生型(wild type,WT)和IL-6 KO小鼠,饲养条件为光照模拟12h/12h昼夜循环,室温(24±2)℃,相对湿度40%~80%,自由摄食和饮水,本实验已由空军军医大学伦理委员会批准(20190906)。
2方法
2.1实验分组 取8~12周雄性同窝野生型和IL-6 KO小鼠,体重23~28g,随机分为正常组与THS组:野生型组(WT组)、基因敲除组(KO组)、野生型创伤失血性休克组(WT THS组)和基因敲除创伤失血性休克组(KO THS组),各6只。
2.2THS模型制备 取1%戊巴比妥纳注射液对小鼠进行腹腔注射 (50mg/kg) ,待小鼠麻醉后将其四肢进行固定,使用止血钳横向钳夹小鼠左侧股骨干中段,致其股骨干骨折,当骨折远端有明显的离断感时,提示骨折制备成功。之后再使用1mL注射器针头紧贴小鼠剑突下边缘,针头以30°的角度斜向前略偏右插入心脏。当观察到注射器前段有血液流入时,固定注射器位置,缓慢回抽注射器,抽血量按照小鼠总血量的30%进行计算[抽血量(mL)=30%×7.7%×体重(g)][12-13],整个抽血过程在1min之内完成。模型建立2h后,采用颈椎脱臼法处死小鼠进行后续实验操作。
2.3HE染色观察小鼠肺组织病理变化 (1)取右肺组织置于4%多聚甲醛中固定24h;(2)乙醇脱水;(3)制备石蜡切片;(4)石蜡切片脱蜡至水;(5)苏木素染色;(6)伊红染色;(7)脱水封片;(8)显微镜镜检,图像采集,根据病变严重程度进行半定量分析。
2.4免疫荧光观察小鼠肺组织SDC1变化 (1)石蜡切片脱蜡至水;(2)抗原修复;(3)组化笔在组织周围画圈;(4)血清封闭;(5)加入一抗(SDC1);(6)加入辣根过氧化物酶(HRP)标记山羊抗兔二抗;(7)加FITC试剂;(8)微波处理;(9)加CY3试剂;(10)自发荧光淬灭;(11)DAPI复染细胞核;(12)封片;(13)镜检拍照,使用Image J软件进行荧光强度分析。
2.5定量实时荧光聚合酶链式反应(qRT-PCR)检测小鼠肺组织mRNA相对表达量变化 取左上肺组织,使用TRIzol提总RNA,定量后取1μg反转录成cDNA,之后进行qRT-PCR检测。使用10μL扩增体系,SYBR@Green Master Mix(2×)5μL,上下游引物各0.5μL,ddH20 4μL。扩增程序设置如下:(1)预变性95℃ 10min;(2)变性95℃ 15s;(3)退火/延伸55℃ 1min,共40个循环;(4)融解曲线阶段采用仪器默认设置。以β-肌动蛋白(β-actin)作为内参,进行目的基因归一化处理获得相对表达量。各引物序列如下:(1)β-actin上游引物:5′-GTGACGTTGACATCCGTAAAGA-3′,下游引物:5′-GCCGGACTCATCGTACTCC-3′;(2)AKT上游引物:5′-ATGAACGACGTAGCCATTGTG-3′,下游引物:5′-TTGTAGCCAATAAAGGTGCCAT-3′;(3)NF-κB上游引物:5′-TGCGATTCCGCTATAAATGCG-3′,下游引物:5′-ACAAGTTCATGTGGATGAGGC-3′;(4)MMP9上游引物:5′-GCAGAGGCATACTTGTACCG-3′,下游引物:5′-TGATGTTATGATGGTCCCACTTG-3′;(5)SDC1上游引物:5′-AGCAACACCGAGACTGCTTTT-3′,下游引物:5′-GTGCGGATGAGATGTGACAG-3′。
2.6Western blotting检测小鼠肺组织蛋白相对表达量变化 取左下肺组织,使用RIPA裂解液提总蛋白,蛋白浓度测定和加热变性后进行上样、电泳、转膜、孵育抗体[一抗(SDC1为1∶500,MMP9、p-AKT、p-NF-κB和NF-κB为1∶1000,AKT为1∶2000,β-actin为1∶5000)孵育置于4℃冰箱摇床过夜,HRP标记的二抗(1∶5000)室温震荡孵育1h、高效化学发光法(ECL)显影。
3统计学分析
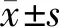
结 果
1HE染色观察小鼠肺组织病理变化
WT组与KO组肺泡大小形态均匀,结构清晰,肺泡腔内无白细胞浸润和出血,两组肺组织病理损伤评分[(0.3±0.5)分vs.(0.5±0.5)分]差异无统计学意义(P>0.05)。WT THS组明显可见较多肺泡壁增厚和肺泡腔狭窄,伴有较多淋巴细胞与中性粒细胞浸润。KO THS组局部可见部分肺泡壁增厚,肺泡腔狭窄,淋巴细胞与中性粒细胞浸润,但病变程度较WT THS组减轻[(2.3±0.8)分vs.(3.7±0.5)分],差异有统计学意义(P<0.05)。见图1。
2免疫荧光观察小鼠肺组织SDC1表达变化
WT组与KO组SDC1主要沿肺血管内皮和肺泡上皮分布,SDC1表达比较丰富,两组肺组织SDC1荧光强度[(148.2±3.6)AUvs.(147.8±3.5)AU]差异无统计学意义(P>0.05)。WT THS组大部分肺血管内皮和肺泡上皮SDC1表达显著下降。KO THS组肺血管内皮和肺泡上皮SDC1荧光强度与WT THS组相比较高[(137.2±3.7)AUvs.(129.8±2.6)AU],差异有统计学意义(P<0.05)。见图2。
3qRT-PCR检测肺组织mRNA相对表达量变化
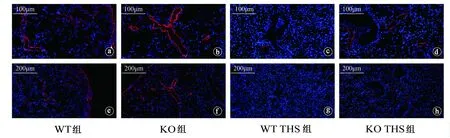
WT组与KO组的肺组织AKT、NF-κB、MMP9和SDC1的mRNA相对表达量差异无统计学意义(P>0.05)。KO THS组AKT、NF-κB和MMP9的mRNA相对表达量低于WT THS组,差异有统计学意义(P<0.05)。WT THS组与KO THS组SDC1的mRNA相对表达量差异无统计学意义(P>0.05)。见图3。
4Western blotting检测肺组织蛋白相对表达量变化
WT组与KO组的肺组织p-AKT、p-NF-κB、MMP9和SDC1的蛋白相对表达量差异无统计学意义(P>0.05)。KO THS组p-AKT、p-NF-κB和MMP9的蛋白相对表达量低于WT THS组,差异有统计学意义(P<0.05)。KO THS组SDC1的蛋白相对表达量高于WT THS组,差异有统计学意义(P<0.05)。见图4。

WT:野生型;KO:基因敲除;THS:创伤失血性休克
WT:野生型;KO:基因敲除;THS:创伤失血性休克
AKT:蛋白激酶B;NF-κB:核因子-κB;MMP9:基质金属蛋白酶-9;SDC1:Syndecan-1;WT:野生型;KO:基因敲除;THS:创伤失血性休克;ns:差异无统计学意义;ns:P>0.05,*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.0001
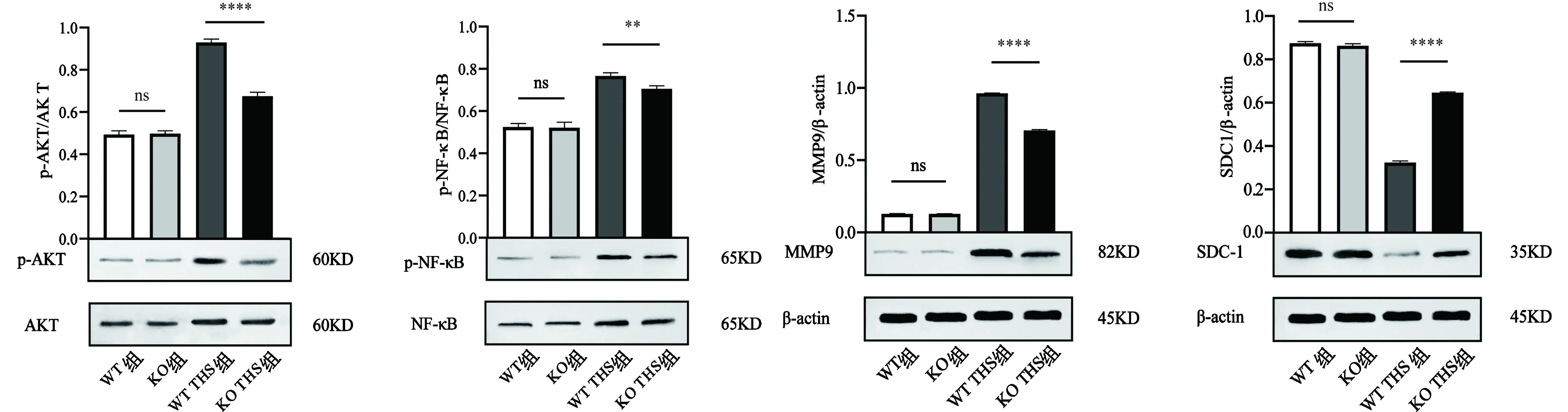
p-AKT:磷酸化蛋白激酶B;AKT:蛋白激酶B;p-NF-κB:磷酸化核因子-κB;NF-κB:核因子-κB;MMP9:基质金属蛋白酶-9;β-actin:β-肌动蛋白;SDC1:Syndecan-1;WT:野生型;KO:基因敲除;THS:创伤失血性休克;ns:差异无统计学意义,KD:千道尔顿;ns:P>0.05,*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.0001
讨 论
严重创伤失血后会引发SE,持续发展则会进展成为TC,TC是指多因素参与的系统性凝血功能障碍,凝血功能检测可表现为高凝、低凝和纤溶亢进等不同状态,约1/3非控制性出血的创伤患者在入院时会并发凝血病,其多器官衰竭发生率和病死率明显增高,而阻断SE向TC进一步发展成为创伤领域最新研究的热点[14-16]。
肺是THS较早和较易累及的器官之一,相关研究[12]显示,失血性休克小鼠的失血量达到30%并持续2h就会造成小鼠肺组织的明显损伤,在此条件下小鼠的病死率约为10%,笔者团队研究也发现,随着失血量升高和创伤因素加入,THS小鼠的病死率会显著上升,而采用30%失血量并持续2h建立THS小鼠模型既有利于观察小鼠的肺组织损伤情况,也有利于控制THS小鼠的总体病死率完成后续实验操作。本研究显示THS小鼠模型建立后,HE染色肺组织可见肺泡壁增厚和肺泡腔狭窄,伴有淋巴细胞与中性粒细胞浸润,KO THS组肺泡壁增厚,肺泡腔狭窄,淋巴细胞与中性粒细胞浸润的病变程度比WT THS组明显减轻,提示IL-6 KO有助于缓解小鼠THS后的ALI。
既往研究[17-19]显示SDC1在ALI中发挥重要作用并可以作为ALI的损伤标志物,SDC1胞内区序列高度保守,人、大鼠和小鼠等种属此段序列都相同,胞外区连接糖胺聚糖(glycosaminoglycan,GAG)侧链结构,包括3条硫酸乙酰肝素(heparan sulfate,HS)侧链和2条硫酸软骨素(chondroitin sulfate,CS)侧链[20-21]。通过限制蛋白和可溶性物质通过细胞连接缝隙,调节内皮表面白细胞和血小板与细胞黏附分子的相互作用,依托HS侧链调节局部细胞表面的凝血功能,SDC1对于维持血管的完整性和渗透性方面具有重要意义[22- 23]。本研究显示THS小鼠模型建立后,肺血管内皮和肺泡上皮SDC1表达明显下降,KO THS组肺血管内皮和肺泡上皮SDC1表达比WT THS组较高,各组免疫荧光显示肺组织SDC1表达与HE染色显示肺组织损伤严重程度呈负相关,提示SDC1可以作为小鼠THS后ALI的损伤标志物,这与既往研究保持一致。
有研究[24-25]提示在ALI过程中,IL-6可以通过AKT/NF-κB信号通路对MMP产生影响,本研究中qRT-PCR结果显示THS所引起的ALI会导致AKT、NF-κB和MMP9的mRNA相对表达量上升,而KO THS组与WT THS组相比,AKT、NF-κB和MMP9的mRNA相对表达量较低,表明IL-6 KO可以下调AKT、NF-κB和MMP9的mRNA表达;本研究中Western blotting检测结果显示THS所引起的ALI会导致p-AKT、p-NF-κB和MMP9的蛋白相对表达量上升,而KO THS组与WT THS组相比p-AKT、p-NF-κB和MMP9的蛋白相对表达量较低,表明IL-6 KO可以下调AKT和NF-κB的蛋白磷酸化和下调MMP9的蛋白表达。
在SDC1靠近跨膜区结构域有一个蛋白水解酶作用的部位,用于从细胞表面释放SDC1分子的胞外区,已知有多种MMP都可以作用此位点[26- 27]。本研究Western blotting检测结果显示THS所引起的ALI会导致SDC1蛋白相对表达量下降,KO THS组与WT THS组相比SDC1蛋白相对表达量较高,与免疫荧光显示SDC1表达情况一致,而qRT-PCR检测则显示THS所引起的ALI会导致SDC1的mRNA相对表达量上升,KO THS组与WT THS组SDC1的mRNA相对表达量差异无统计学意义,表明IL-6 KO通过下调MMP9,可以在蛋白水平减少其对于SDC1的切割,从而减轻SDC1蛋白的脱落,而对于SDC1的mRNA水平则无明显影响。
综上所述,在小鼠THS模型中,IL-6 KO可抑制AKT/NF-κB信号通路激活,下调MMP9,减少SDC1蛋白的脱落,进而减轻ALI损伤程度,而炎症和多糖蛋白复合物脱落在SE和TC发生发展过程中的彼此作用和相互影响值得进一步探索和发现。
作者贡献声明:范颖楠:研究设计、数据收集整理、论文撰写;冯筑生:数据统计分析、论文撰写;于超平、谢建刚:数据收集整理;王倩梅:论文修改;刘善收:经费支持;尹文:论文审定、经费支持