茶多酚添加量对发酵型豆乳中蛋白质消化特性的影响
2022-03-21韩志文顾林宇邢广良
韩志文,刘 义,吴 昊,顾林宇,邢广良
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
大豆(Glycinemax)又名黄豆,其营养价值很高,是日常饮食中蛋白质、碳水化合物、油脂、维生素、矿物质的良好来源.将大豆泡发打浆滤渣后得到的豆浆含有丰富的蛋白质且不含胆固醇和乳糖,可作为一种健康的牛奶替代品.研究表明,食用大豆蛋白有助于降低患心血管疾病的风险,以及防止骨质流失[1].近年来,对人体健康具有促进作用的食品配料或微生物发酵类食品越来越受到人们的关注.其中,茶多酚(Tea polyphenols,TP)和乳酸菌(Lactic acid bacteria,LAB)组合制备的发酵型豆乳具有多重保健功效[2].研究发现,长期摄入茶多酚和豆制品可以降低慢性炎症及癌症的发生[3].然而,TP可与蛋白质形成复合物,导致两种化合物的结构、功能和营养特性发生变化.有研究指出,在牛奶制品中添加茶多酚会影响蛋白质的水解和消化[4].但是,影响蛋白质-多酚相互作用的参数有很多,如温度、pH、多酚的量、蛋白质类型和浓度等,其中多酚的量是一个重要因素.
体外胃肠道消化模型是模拟人体胃肠道生理条件下研究食物摄入后其结构变化及消化率的有效途径,运用体外模拟消化方法测定的结果与体内实验结果有很好的相关性[5].因此,体外胃肠道消化模型在蛋白质消化特性的研究中得到了广泛应用.
本文采用体外模拟人体胃肠道消化模型来研究茶多酚的添加量对发酵型酸豆乳中蛋白质消化特性的影响.从乳酸菌活菌数、可溶性蛋白含量测定、10 kDa以下小肽含量测定、聚丙烯酰胺凝胶电泳(SDS-PAGE)等方面进行分析,以确定茶多酚的最佳添加量,为改善人们的健康饮食提供依据.
1 材料与方法
1.1 实验材料与试剂
黄豆(购于超市);含量为30%(w/w),从绿茶中提取的茶多酚提取物购于陕西信瑞生物科技有限公司;酸奶发酵剂2菌型(保加利亚乳杆菌、嗜热链球菌,湖北安琪酵母股份有限公司);MRS琼脂培养基购于青岛海博生物技术有限公司;磷酸、盐酸、乙酸、甲醇、无水乙醇、磷酸二氢钠、磷酸氢二钠、甘油(均为分析纯)购于江苏强盛功能化学股份有限公司;溴酚蓝、牛血清白蛋白、考马斯亮蓝R250、G250均购于福州飞净生物科技有限公司;十二烷基硫酸钠、甘氨酸、十水合四硼酸钠、邻苯二甲醛(OPA)购于上海罗恩化学技术有限公司;α- 淀粉酶(α-Amylase,A1031,来源于人类唾液,300~1 500 units/mg)、胃蛋白酶(Pepsin,P7000,来源于猪胃黏膜,≥250 units/mg)、胰蛋白酶(Pancreatin,P3292,来源于猪胰腺,4×USP specifications)、猪胆盐(Bile extract porcine,B8631)均购自美国Sigma-Aldrich公司.β-巯基乙醇购于北京索莱宝科技有限公司;彩色蛋白Marker(15~150 kDa)、SDS-PAGE凝胶快速制备试剂盒均购于北京兰杰柯科技有限公司;超滤离心管10 kDa(Millipore 密理博).
1.2 主要仪器与设备
九阳破壁机(九阳股份有限公司);恒温振荡器(上海一恒科技有限公司);数显恒温水浴锅(上海叶拓科技有限公司);旋涡混匀仪 Vortex-2(上海叶拓科技有限公司);海尔电冰箱 BCD-539WT(青岛海尔股份有限公司);微型高速离心机 MC-15 K(杭州佑宁仪器有限公司);紫外分光光度计 UV-1800(上海美谱达仪器有限公司);美的电冰箱 BCD-536WKM(合肥美的电冰箱有限公司);实验室 pH计 FE20(上海梅特勒-托利多仪器有限公司);电磁炉(合肥美的电磁炉有限公司);Mini-protean型电泳仪(美国Bio-Rad公司)
1.3 实验方法
1.3.1 添加茶多酚的发酵型豆乳制备
挑选200 g颗粒饱满无虫眼的优质大豆清洗干净,加入600 mL蒸馏水在室温下浸泡12 h.泡好后捞出沥干水分称重(440 g),再加入1 560 mL蒸馏水打浆,使用200目纱布过滤除去豆渣.将过滤后的豆浆在电磁炉上煮沸(保持沸腾5 min)后,放置于无菌超净工作台内冷却至40 ℃时分装至若干无菌锥形瓶中,每瓶豆浆体积为100 mL.分别称取0.1,0.3,0.5 g茶多酚提取物进行紫外辐射杀菌处理(约20 min).将其分别预溶解于2 mL无菌蒸馏水中,随后分别添加到100 mL熟豆浆(约40 ℃)中,搅拌混匀后接种乳酸菌,接种量为0.1 g乳酸菌菌粉/100 mL豆浆,之后置于42 ℃恒温培养箱发酵6 h至凝乳,此时pH约为5.4.
1.3.2 茶多酚添加量对乳酸菌生长的影响
在无菌超净工作台中进行操作,分别取25 g发酵后的各豆乳样品,用灭菌的匀浆器磨碎匀浆,先后共用225 mL灭菌生理盐水将匀浆后的豆乳倒入灭菌后的锥形瓶中,摇匀.取1 mL混合液,用灭菌生理盐水梯度稀释,选取合适的稀释度,采用灭菌后的MRS琼脂培养基,倾注平板法菌落计数,37 ℃倒置培养48 h,检验乳酸菌活菌数.具体操作方法参照国标方法GB/T 4789.35—2016执行[6].以不添加茶多酚并发酵6 h后的豆乳作为对照.
1.3.3 发酵型豆乳的体外胃肠道消化
采用 SHIM等[7]的体外胃肠道消化模型进行实验,整个消化过程均在恒温振荡器内(37 ℃)完成.发酵型豆乳与各消化酶溶液的添加比例为豆乳︰唾液淀粉酶溶液︰胃蛋白酶溶液︰胰蛋白酶溶液:胆液=2.5:1.0:1.5:1.0:1.0(v/v).具体操作流程如图1所示.取样时间点为:消化前(编号P0);口腔消化结束(P1);胃消化阶段的第 1,5,30,60 min(编号 P2-1,P2-5,P2-30,P2-60);肠消化的第 1,5,30,120 min(编号P3-1,P3-5,P3-30,P3-120).消化结束后,各消化阶段的样品均用去离子水定容至14 mL,以确保所有消化阶段样品中的蛋白质含量一致,并将定容后的样品置于沸水中水浴5 min,使酶失活.然后吸取2 mL置于离心管中离心(10 000 r/min,5 min),结束后吸取上清液于4 ℃冰箱保存.

图1 发酵型豆乳样品的体外胃肠道模拟消化过程
1.3.4 可溶性蛋白含量测定
采用考马斯亮蓝法(Bradford法)测定各样品上清液中可溶性蛋白的含量[8].取1 mL上清液与5 mL考马斯亮蓝染色液混匀,设置3组平行对照,室温反应5 min后,在紫外可见光分光光度计上测定595 nm波长处的吸光值.可溶性蛋白含量用牛血清白蛋白当量表示,以蒸馏水代替样品反应作为空白对照.牛血清白蛋白标准溶液(0~100 μg/mL)的线性回归方程为y= 0.003 9x+ 0.013 7(R2= 0.995 7).
1.3.5 小肽含量测定
小肽含量测定采用RUI等[9]提出的方法:使用移液枪吸取2 mL各消化阶段样品到截留分子质量为10 kDa的Millipore超滤管中,进行超滤离心,离心后收集管内蛋白渗透液.吸取50 μL渗透液与2 mL 反应液混匀,设置3组平行对照,室温下精确反应2 min,于340 nm波长处测定吸光度.反应液的配置方法为:100 mL 100 mmol/L 的硼砂、10 mL 20%(w/w)SDS、160 mg 邻苯二甲醛(溶解于 4 mL 甲醇)和 400 μL β- 巯基乙醇混匀后定容至200 mL.小肽含量用胰酪蛋白胨当量表示,用去离子水替代样品反应作为空白对照,反应2 min后放入紫外可见分光光度计,在340 nm条件下测量吸光值,得到胰酪蛋白胨溶液(0~4.0 mg/mL)的标准曲线为y=0.245 9x-0.043 8,R2=0.992 1.
1.3.6 聚丙烯酰胺凝胶电泳(SDS-PAGE)
采用SDS-PAGE对胃、肠不同消化阶段样品中蛋白质分子量的变化情况进行检测.实验采用美国伯乐公司Mini-protean 型电泳仪进行电泳,SDS-PAGE 凝胶制备试剂盒进行凝胶制备.具体步骤为:将100 μL胃、肠各消化阶段样品的上清液和100 μL上样缓冲液混合均匀,沸水浴加热5 min后,静置冷却,取10 μL上样.上样缓冲液配方为:1.6% SDS, 12%甘油,4% β-巯基乙醇,0.025%溴酚蓝,2%蔗糖和62.5 mmol/L Tris-HCL,Ph 6.8.用凝胶快速试剂制备盒制备12%的分离胶和4%的浓缩胶.Mini-protean型电泳仪接通电源后保持60 V恒压,当上样孔中的样品进入分离胶区域后改变电压(120 V).溴酚蓝移动离底部约0.5 cm时切断电源,停止电泳,染色2 h后脱色24 h.使用Quantity One软件(Version 4.6.2, 美国Bio-Rad公司)进行蛋白条带的数量及灰度值分析.
1.3.7 数据处理与分析
本实验采用 Microsoft Office 2013处理数据,Origin 9.0软件作图,采用IBMSPSS 16.0 对各组变量的测试结果进行显著性差异分析,显著性水平P<0.05.
2 结果与分析
2.1 茶多酚添加量对乳酸菌生长的影响
在我国现有的食品法规中还未出现发酵型酸豆乳这类产品的乳酸菌活菌数最小限定值.参考GB19302—2010中规定的发酵乳中的乳酸菌数应大于1×106CFU/mL的标准[10],本研究中接种乳酸菌后的初始活菌数为7.6 log CFU/g,大于上述最低标准.对发酵6 h后各样品中乳酸菌活菌数进行测定,结果如图2所示,发酵结束后各样品中的乳酸菌活菌数相比于发酵前均呈现增长趋势.当不添加茶多酚时(添加量为0%),活菌数可达8.1 log CFU/g,当茶多酚添加量为0.3%(m/v)时,乳酸菌活菌数最高,为8.2 log CFU/g.添加茶多酚的3组豆乳中活菌数与不添加茶多酚组相比均无显著性差异(P>0.05),因此茶多酚的添加不会影响豆乳中乳酸菌的生长.

图2 茶多酚添加量对乳酸菌生长的影响
2.2 可溶性蛋白含量分析
在不同的消化阶段,发酵型豆乳中可溶性蛋白含量的变化如图3所示.在消化前(P0阶段),对照组(不添加茶多酚的发酵型豆乳)及实验组豆乳中可溶性含量均较低(0.37~0.44 mg/mL).这是因为发酵过程中乳酸菌逐渐产生乳酸,其中的氢离子会缓慢中和大豆蛋白表面的负电荷,使蛋白质之间斥力消失进而发生聚集,在高速离心时聚集后的蛋白质沉淀至离心管底部而上清液中含量较少,因此在消化前各样品中可溶性蛋白含量均较低.经过口腔消化后(P1阶段),各样品的可溶性蛋白含量并没有发生明显变化且依然较低,表明唾液淀粉酶和口腔咀嚼作用无法使蛋白质发生水解.在胃消化阶段(P2阶段),与口腔消化阶段相比,对照组及实验组的可溶性蛋白含量均明显升高.这一结果的产生和胃部很多因素有关,如消化期间的强酸环境、胃蛋白酶的存在以及长时间的机械震荡(55 r/min)等.这与 RINALDI 等人[11]研究添加不同增稠剂对酸奶体外消化阶段可溶性蛋白含量变化的结果一致.由图3可知,在胃消化结束时(P2-60),茶多酚添加量为0.5%(m/v)的发酵型豆乳中可溶性蛋白含量最高,为4.42 mg/mL.值得注意的是,胃消化阶段实验组的可溶性蛋白含量(3.71~3.95 mg/mL)均高于对照组(2.45~2.87 mg/mL).由此说明添加较低量的茶多酚利于发酵型豆乳中可溶性蛋白的释放.相比于胃消化阶段,肠消化过程中(P3阶段)各样品的可溶性蛋白含量呈现继续上升的趋势,说明在胰蛋白酶和胆液的作用下,原保留在发酵型豆乳凝胶基质中的蛋白质进一步水解释放.
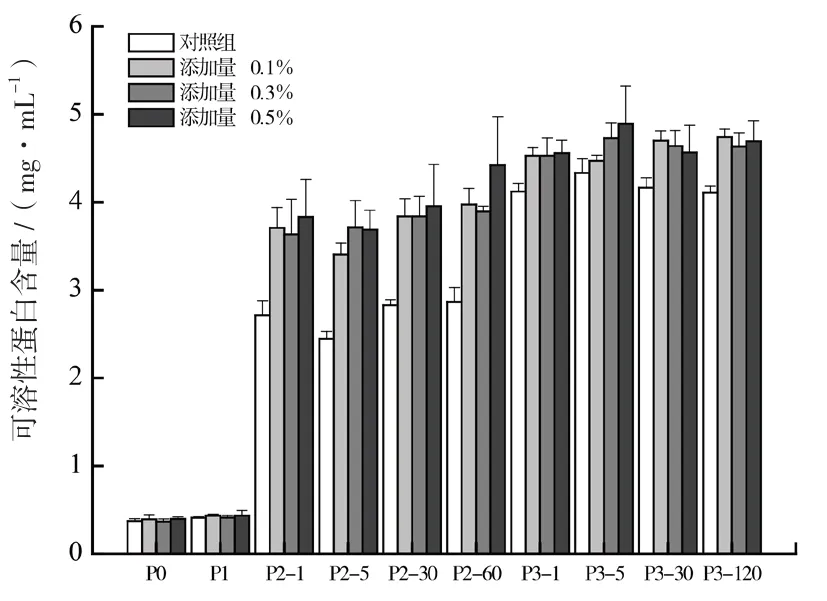
图3 体外消化过程中各样品中可溶性蛋白含量变化图
总之,体外消化期间对照组和实验组可溶性蛋白的含量变化主要是由于蛋白酶的水解作用.在添加茶多酚制备的发酵型豆乳凝胶中,较低含量的茶多酚可以提高大豆蛋白的消化率,从而使更多的可溶性蛋白质在胃肠道中得以释放,进而更有利于人体的吸收.
2.3 小肽含量分析
不同消化阶段样品中分子量低于10 kDa的小肽含量测定结果如图4所示.整体而言,无论是对照组还是添加茶多酚的实验组,随着体外消化的进行,小肽含量均呈上升趋势且与可溶性蛋白含量变化相对应.消化前(P0)和经口腔消化后(P1),添加0.3%和0.5%茶多酚的实验组中小肽含量均显著高于对照组(P<0.05).在胃消化末期(P2-60),小肽含量呈上升趋势,各样品之间差异显著(P<0.05),且随着茶多酚添加量的增加差异越来越大.由此可知,因胃部诸多因素的影响,添加茶多酚的发酵型豆乳更利于分子量在10 kDa以下小肽的释放.在肠消化阶段末期(P3-120),在胰蛋白酶和胆液的作用下,发酵型豆乳中的蛋白质进一步水解成小分子量的多肽和氨基酸,使得小肽含量进一步增加(2.01~2.18 mg/mL)且添加茶多酚的实验组间小肽含量无显著差异(P>0.05),而添加量为0.5%茶多酚的豆乳中小肽含量最高,为2.18 mg/mL.

图4 体外消化过程中各样品中小肽含量变化图
总之,在消化初期(P0和P1阶段),对照组和实验组的小肽含量均较低(< 1.5 mg/mL).在消化中期和末期(P2和P3阶段),由于胃蛋白酶和胰蛋白酶的水解作用,小肽含量显著增高,而肠消化结束后(P3-120)小肽含量达到最大且茶多酚的添加利于分子量低于10 kDa小肽的释放.
2.4 SDS-PAGE电泳分析
通过SDS-PAGE测定每个样品在胃、肠道消化期间的蛋白质图谱,结果如图5所示.β-伴大豆球蛋白(7S)和大豆球蛋白(11S)是大豆蛋白中最主要的两种蛋白.β-伴大豆球蛋白包括 α'、α和β 3个亚基,大豆球蛋白是一种由二硫键连接酸性亚基和碱性亚基而组成的六聚体蛋白质[12].如图5(a)所示,豆浆中包含数条分子量在20~100 kDa之间的蛋白条带,主要的6个条带分子量分别为83.4,74.5,50.9,39.6,35.6和20.1 kDa.据已有的研究推测它们分别对应于7S α’亚基,7S α亚基,7S β 亚基,11S A3 亚基,11S 酸性亚基(11S A)和 11S 碱性亚基(11S B)[13].
从图5(a)中可以看出,各发酵型豆乳消化前(P0)清晰可见的蛋白条带较少.经过口腔消化后(P1),对照组、茶多酚添加量为0.1%的发酵型豆乳中蛋白条带有所增加.这是因为在口腔消化阶段,样品经匀浆操作来模拟口腔咀嚼过程,使原包裹在豆乳凝胶基质中的蛋白质在机械作用下得到释放,从而在蛋白图谱上出现部分条带.但整体而言,各样品在P0和P1阶段可观察到的蛋白条带均较少,这与该阶段测得较低的可溶性蛋白含量相一致(图3).胃消化阶段刚开始1 min时(P2-1),在胃蛋白酶的作用下,各发酵型豆乳凝胶基质中的蛋白质即发生水解,出现了相似的蛋白质图谱,形成分子量在15~50 kDa范围内的诸多蛋白条带,其中条带1(分子量约为24.8 kDa)在对照组及实验组中均可观察到,见图5 (b)~图5(e).且随着胃、肠道消化时间的延长其光密度值逐渐减弱,表明在胃蛋白酶及胰蛋白酶作用下该蛋白条带被逐渐水解.在肠消化阶段,图5(b)对照组出现另外两条清晰的蛋白条带2(分子量约为38.6 kDa)和条带3(分子量约为28.8 kDa),在肠消化前30 min均可观察到.但随着肠消化过程的进行,在肠消化结束时(P3-120),条带2 和3均发生水解,同时出现两条新的蛋白条带4(分子量约为34.3 kDa)和5(分子量约为31.2 kDa).在茶多酚添加量为0.1%的发酵型豆乳中发现了相同的现象,见图5(c).图5(d)和图5(e)中,当茶多酚添加量为0.3%和0.5%时,其肠消化阶段的蛋白图谱上未发现条带4和5,且条带2和3 也随着胃肠消化的进行逐渐被水解消失.由此说明:添加0.3%和0.5%的茶多酚有利于高分子量蛋白条带(条带4和5)的水解;随着肠消化阶段的进行,除了条带1以外,近乎无法观测出清晰的条带;水解后的蛋白质大多数分子量在25 kDa以下.
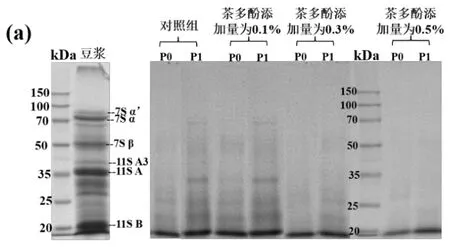
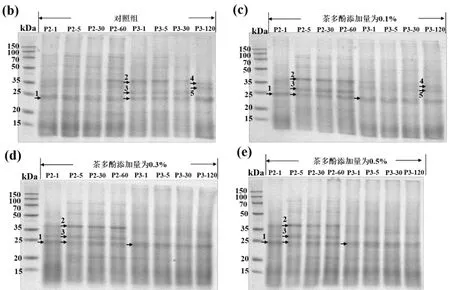
图5 各样品消化期间的蛋白电泳图谱:P0 指消化前,P1指口腔消化结束,P2-1, P2-5, P2-30, P2-60指胃消化的第1, 5, 30, 60 min (P2阶段);P3-1, P3-5, P3-30, P3-120指肠消化的第1, 5, 30, 120 min(P3阶段)
综上所述,随着消化过程的进行,各样品中可观察的条带越来越模糊,消化效果进一步增强,可以得到的可溶性蛋白含量升高,小肽含量增加,这与上述实验结果相对应.
3 结论
本研究中添加茶多酚和乳酸菌制备发酵型豆乳,通过模拟体外消化实验来探究茶多酚的添加量对发酵型豆乳中大豆蛋白消化率的影响.通过乳酸菌活菌数、可溶性蛋白含量、小肽含量、SDS-PAGE 4组参数的测定结果综合分析得出:茶多酚的添加不会影响发酵期间乳酸菌的生长;随着胃肠道消化的进行,可溶性蛋白含量逐渐升高,且随着茶多酚添加量的增加更有利于可溶性蛋白的释放;在小肽含量测试中可以看出,肠消化过程是分子量在10 kDa以下小肽类物质被大量释放的阶段,此时的小肽含量为实验中最高.通过SDSPAGE图谱得出添加茶多酚的发酵型豆乳其胃肠道消化期间蛋白降解情况相似,但添加量为0.3%和0.5%的豆乳中蛋白质的降解速率更快.综上说明,添加茶多酚有利于发酵型酸豆乳中大豆蛋白的消化吸收.
