紫茎泽兰入侵前后根部蜡样芽孢杆菌含量比较及其对化感物质处理的响应
2022-03-21赵云鹏杨子豪EstebanRodrguezLeyva杨国庆
赵云鹏, 杨子豪, 徐 刚, Esteban Rodríguez-Leyva, 杨国庆*
1扬州大学园艺与植物保护学院,江苏 扬州 225009; 2Posgrado en Fitosanidad, Entomología y Acarología, Colegio de Postgraduados, Texcoco, Mexico
入侵生物如何适应新生境建立种群并持续扩张,是入侵生物学研究的核心问题之一(Sax & Brown,2000)。生物地理比较是揭示外来植物入侵扩张机制的常用方法,一般指以外来植物原产地和入侵地种群为材料,在同质园试验条件下,比较揭示外来植物在繁殖特性、化感作用、土壤微生物互作等有利扩张的特征变化(Dattaetal.,2019);一些知名假说,如天敌逃逸假说(Keane & Crawley,2002)、新式武器假说(Callaway & Ridenour,2004)、入侵植物-土壤反馈假说(Vanetal.,2013)等对这些变化进行了诠释。外来有害植物在入侵地新生境中,将对根际土壤微生物群落产生影响,这种影响常正反馈作用于外来植物;“入侵植物-土壤微生物”互益作用在入侵前后是否被放大/缩小,是揭示“入侵植物-土壤微生物”互作助推外来植物成功入侵机制的重要依据(柳旭等,2019; 宋洁蕾等,2019; Dawkins & Esiobu,2018)。此外,化感作用是推动一些外来植物入侵后逐渐扩张的重要因子(Callaway & Ridenour,2004),这其中的化感物质有着“双重效应”,即经过土壤介质作用于本地植物的直接效应和作用于土壤微生态环境后产生偏利于入侵植物的间接效应,后者的作用更持续(Inderjitetal.,2011b)。已有研究证实,外来植物入侵对伴生植物的化感作用会不同程度地增强(Callaway & Ridenour,2004),而对根际有益菌的作用还需进一步研究。
紫茎泽兰Ageratinaadenophora(Spreng.)作为一种世界恶性入侵杂草,其入侵扩张机制受到国内外众多学者的关注(Dattaetal.,2019; Wanetal.,2010)。和原产地相比,紫茎泽兰在入侵地发生了多方面有利扩张的适应性变化,如资源再分配(孙昂等, 2020)、化感作用增强(Inderjitetal.,2011a)、抗虫性增加(Linetal.,2020)、氮分配平衡变动(Fengetal.,2009)等;在入侵地,紫茎泽兰与其根际微生物互作的内在机制也正被逐渐“解密”,如:紫茎泽兰入侵后,其根际微生物介导加速土壤氮代谢(Zhaoetal.,2019),削弱微生物群落对根际的化感作用(Lietal.,2017),改变微生物群落对自身的偏利效应(Niuetal.,2007),促使根际土壤聚集有益真菌和细菌(如蜡样芽孢杆菌Bacilluscereus等)(Fangetal.,2019a,2019c; Zhangetal.,2020)。Sunetal.(2021)研究证实,紫茎泽兰可通过根系分泌物促进根际有益菌蜡样芽孢杆菌的增加,这种变化又对其自身生长产生正反馈作用,但这种互作效应在入侵前后的差异如何不得而知。为此,本研究通过比较紫茎泽兰入侵地种群根部蜡样芽孢杆菌含量与原产地种群的差异,及其对紫茎泽兰化感物质的响应,为揭示紫茎泽兰与有益菌互作在入侵前后的变化及其机制提供参考。
1 材料与方法
1.1 材料
入侵地3个种群(C1、C2、C3)种子分别取自紫茎泽兰入侵地云南省昆明市盘龙区(25°12′40.1″N, 102°74′53.8″E)、西山区(25°01′98.4″N, 102°66′51.1″E)与临沧市(23°87′47.0″N, 100°16′98.0″E);原产地3个种群(M1、M2、M3)种子由农业部外来入侵生物预防与控制中心提供,采集自墨西哥的San Pablo lxayoc(19°28′00.5″N, 98°47′12.0″W)、Nezahualcoyotl(19°23′11.9″N, 99°03′15.3″W)、Ciudad de Mexico(19°19′07.9″N, 99°10′57.1″W)。在温度(25±1)℃、湿度60%±5%、光周期14L∶10D的人工气候箱内培育原产地与入侵地紫茎泽兰不同种群的种子,种子发芽后培育1个月,挑选各种群长势一致的幼苗150株左右移栽至育苗盆中(刁跃珲等,2019),置于温室内(温度约25 ℃,湿度约45%,自然光照)培养,并定期浇水,保证每个育苗盆浇水量相同。幼苗种植所用土壤均取自云南临沧市紫茎泽兰重度入侵地区,种植密度分别为5、10、15株·m-2。此外,在云南重度入侵地采集紫茎泽兰植株及其根际土壤于一个育苗盆,同时单独取重度入侵地土壤用于后续的叶片淋溶液或根系分泌液处理。
1.2 方法
1.2.1 根系蜡样芽孢杆菌含量测定 取培育的原产地和入侵地各种群的紫茎泽兰2年生植株(种植密度为10株·m-2)各5株,清洗、剪下根部并浸泡于70%乙醇中30 s,再用流水反复冲洗、晾干,然后剪碎置于研钵中并添加液氮研磨成粉状,收集粉状物保存于4 ℃冰箱中待测。使用DNeasy®PowerPlant®Kit(QIAGEN®,德国)试剂盒提取植株根系的DNA,然后通过NanoDrop紫外分光光度仪测定DNA浓度并对其进行qPCR定量(Bio-Rad CFX96) 扩增检测,具体方法参考Sunetal.(2021)的研究方法。
1.2.2 根际土壤蜡样芽孢杆菌含量测定 分别采集紫茎泽兰1年和2年生的原产地和入侵地各种群紫茎泽兰植株不同种植密度下的根际土壤,土壤先用筛子(直径为0.42 mm)除去杂质,随后保存在4 ℃下待测。使用DNeasy®PowerSoil®Kit (QIAGEN®,德国)试剂盒提取土壤DNA,每个处理重复5次,测定方法参考Sunetal.(2021)的研究方法。
1.2.3 叶片淋溶液、根系分泌液处理后土壤蜡样芽孢杆菌含量测定 紫茎泽兰叶片淋溶液制备:分别取原产地与入侵地1年生紫茎泽兰植株(种植密度10株·m-2)叶片10 g,剪碎浸泡于100 mL去离子水中,24 h 后,依次通过4层滤纸及0.45 μm Micro PES膜进行过滤,过滤后的淋溶液保存于4 ℃冰箱备用(杨国庆等,2008)。紫茎泽兰根系分泌液制备:取原产地与入侵地1年生紫茎泽兰植株(种植密度10株·m-2),清洗根部后,整株移至300 mL 蒸馏水中,1周以后收集根系分泌液。根系分泌液通过4层滤纸过滤,再通过 0.45 μm Micro PES 膜过滤,然后保存于4 ℃冰箱备用(Yangetal.,2016)。
处理:在培养皿中添加25 g土壤,随后分别添加紫茎泽兰原产地和入侵地6个种群的叶片淋溶液或根系分泌液(10 mL),对照添加10 mL水,搅拌均匀后加封口膜,置于黑暗环境中。在处理1、5、9 d后测定土壤中蜡样芽孢杆菌含量,每个处理重复5次,蜡样芽孢杆菌含量测定方法同1.2.2。
1.3 数据分析
所有数据均使用软件SPSS 17.0进行分析,采用LSD法 One-Way ANOVA 比较6个种群的均值,做显著性检验;使用GraphPad Prism 7.0软件作图。所有数据表示为平均值±标准误(Mean±SE),处理间用不同的字母表示彼此在5%水平上存在显著差异。
2 结果与分析
2.1 原产地与入侵地种群根系蜡样芽孢杆菌含量比较
紫茎泽兰原产地与入侵地种群根系蜡样芽孢杆菌测定结果(图1)表明,入侵地种群的含量均不同程度地高于原产地种群,其中入侵地种群C1、C2、C3分别比原产地种群M1、M2、M3的含量高911%、25%、170%,1172%、62%、247%,968%、36%、192%(F=39.23,P<0.01)。

图1 原产地与入侵地紫茎泽兰种群植株根系蜡样芽孢杆菌的含量Fig.1 Abundance of B. cereus in the roots of A. adenophora plants from native and invasive populationsM1、M2、M3:原产地种群;C1、C2、C3:入侵地种群;不同小写字母表示不同种群间的差异显著(P<0.05)。M1, M2, M3: Native populations of A. adenophora;C1, C2, C3: Invasive populations of A. adenophora.Different lowercase letters indicate significant difference among different populations (P<0.05).
2.2 原产地与入侵地根际土壤蜡样芽孢杆菌含量比较
由图2可知,3个种植密度下,2年生紫茎泽兰种群根际土壤蜡样芽孢杆菌含量较1年生的均有所增加,入侵地种群不同程度地高于原产地种群,并在2年生的5株·m-2种植密度下表现较为明显。1年生15株·m-2种植密度的入侵地紫茎泽兰各种群的根际土壤蜡样芽孢杆菌含量显著高于原产地种群M2,入侵地种群C1、C2和C3的根际土壤蜡样芽孢杆菌含量分别是M2的2.14倍、1.71倍和1.83倍;2年生的5株·m-2种植密度下入侵地种群C3是原产地种群M2的2.4倍,10株·m-2种植密度下入侵地种群C1是原产地种群M1的2.76倍。
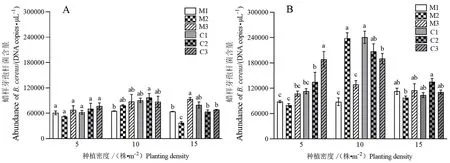
图2 原产地与入侵地紫茎泽兰1年生(A)和2年生(B)植株根际土壤中蜡样芽孢杆菌含量Fig.2 Abundance of B. cereus in rhizosphere soils from one-year plants (A) and two-year plants (B) of native and invasive A. adenophoraM1、M2、M3:原产地种群;C1、C2、C3:入侵地种群;不同小写字母表示不同种群间的差异显著(P<0.05)。M1, M2, M3: Native populations of A. adenophora;C1, C2, C3: Invasive populations of A. adenophora.Different lowercase letters indicate significant difference among different populations (P<0.05).
2.3 紫茎泽兰叶片淋溶液处理对土壤中蜡样芽孢杆菌含量的影响
由图3可知,随着处理时间的延长,土壤中蜡样芽孢杆菌含量增加;和空白对照相比,紫茎泽兰入侵地种群叶片淋溶液处理后土壤中蜡样芽孢杆菌含量的增加幅度不同程度地高于原产地种群处理的。处理1 d后,入侵地种群C2、C3与原产地种群M2、M3淋溶液处理的土壤蜡样芽孢杆菌含量显著高于对照(F=33.20,P<0.01),入侵地种群处理后土壤蜡样芽孢杆菌含量总平均值较对照增加28%,而原产地处理后增加了19%。5 d后,入侵地种群C1、C3与原产地种群M3处理后的含量也显著高于对照(F=47.44,P<0.01),入侵地种群处理后菌含量的总平均值较对照增加56%,而原产地处理后增加了24%。到处理9 d后,入侵地与原产地所有种群处理后菌的含量显著高于对照(F=14.37,P<0.01),处理后菌含量的总平均值较对照增加了79%(入侵地)和43%(原产地)。
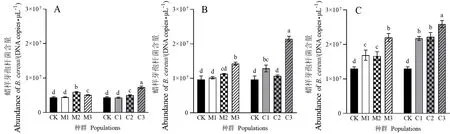
图3 原产地和入侵地紫茎泽兰叶片淋溶液处理1(A)、5(B)和9(C) d后的土壤蜡样芽孢杆菌含量Fig.3 Abundance of B. cereus in soils after treatment with leaves leachates of native and invasive A. adenophora after 1 (A), 5 (B) and 9 (C) d M1、M2、M3:原产地种群;C1、C2、C3:入侵地种群;不同小写字母表示不同种群间的差异显著(P<0.05)。M1, M2, M3: Native populations of A. adenophora; C1, C2, C3: Invasive populations of A. adenophora.Different lowercase letters indicate significant difference among different populations (P<0.05).
2.4 紫茎泽兰植株根系分泌液处理对土壤中蜡样芽孢杆菌含量的影响
由图4可知,紫茎泽兰根系分泌液处理也促进了土壤中蜡样芽孢杆菌的增长。3个不同处理时间的测定结果表明,与空白对照相比,紫茎泽兰入侵地种群根系分泌液处理对土壤蜡样芽孢杆菌增长促进逐渐增加,到了处理9 d后,其增量显著高于原产地种群的。处理1 d后,原产地3个种群根系分泌液处理的土壤蜡样芽孢杆菌含量均显著高于对照(F=19.87,P<0.01)。处理5 d后,入侵地与原产地所有种群处理后的菌含量显著高于对照(F=24.46,P<0.01)。处理9 d后,所有处理的菌含量也显著高于对照(F=4.94,P<0.01),入侵地种群处理后土壤蜡样芽孢杆菌含量的总平均值比对照高70%,而原产地种群在处理后增加了62%。

图4 原产地和入侵地紫茎泽兰根系分泌液处理1(A)、5(B)和9(C)天后的土壤蜡样芽孢杆菌含量Fig.4 Abundance of B. cereus in soils after treatment with root exudates of native and invasive A. adenophora after 1 (A),5 (B) and 9 (C) d M1、M2、M3:原产地种群; C1、C2、C3:入侵地种群;不同小写字母表示不同种群间的差异显著(P<0.05)。M1, M2, M3: Native populations of A. adenophora;C1, C2, C3: Invasive populations of A. adenophora.Different lowercase letters indicate significant difference among different populations (P<0.05).
3 讨论与结论
蜡样芽孢杆菌作为一种根际促生菌,可起到根际固氮作用(Xuetal.,2012),诱导植物对病害的系统抗性(Niuetal.,2012),在土壤中能抑制病原微生物的繁殖(于文清等,2014b),还能通过与菌根真菌互作促进植物生长(于文清等,2014a;Artursson & Jansson,2003)。本研究结果可见,入侵地紫茎泽兰种群根内与根际土壤中的蜡样芽孢杆菌含量高于原产地种群。已有报道证实紫茎泽兰在入侵地云南偏利性聚集根际微生物群落(Chenetal.,2019; Fangetal.,2019b),并且根际蜡样芽孢杆菌对紫茎泽兰存在正反馈效应(Sunetal.,2021)。另外,紫茎泽兰在入侵地生长更好也得益于天敌草食性昆虫与土壤病原体损害的减少(Balami & Thapa,2017),但根际土壤菌落较为复杂,而进入植株根内的细菌群落则较为稳定(Tanetal.,2017; Gronemeyeretal.,2012),因此,内生菌在植株生长过程中起到较大的作用。本研究结果显示,入侵地种群根内蜡样芽孢杆菌含量都显著高于原产地种群,这可能是紫茎泽兰入侵后改变了土壤环境进而促进了根际土壤有益菌的生长所致(Niuetal.,2007)。植株根内聚集更多的蜡样芽孢杆菌可能是有益菌对入侵地紫茎泽兰正反馈的新特质,但这种反馈效应如何由根外作用传导到根内导致有益菌增加还有待于进一步揭示。
化感物质和根部微生物群落互作及其对植物的反馈效应,一直是外来植物适应性机制研究的热点问题之一,这其中植株淋溶物与根系分泌物的作用必不可少。已有研究证实,较原产地种群,紫茎泽兰入侵地种群的化感作用和化感物质有所增加(高鑫等,2018; Inderjietetal.,2011b),这可能会引起自毒负效应,而根际有益菌(Lietal.,2017)如蜡样芽孢杆菌可能承载消减这一不利效应的作用。本研究结果发现,入侵地紫茎泽兰植株根部蜡样芽孢杆菌的含量不同程度地高于原产地的,且入侵地植株淋溶液处理对菌的增加较原产地的更加有利,在根系分泌液处理的后期测定中也有所呈现。可见,紫茎泽兰根部蜡样芽孢杆菌的增加应该是多重因素较长时间累积作用的结果,包括化感物质作用在内。实际上,紫茎泽兰在入侵地中有的化感物质分泌量是比原产地种群多的,虽然本研究中使用的是等量处理,如果在考虑自然生境下入侵地化感物质量更多的因素下,将更加有利于入侵地紫茎泽兰根部蜡样芽孢杆菌的增加。此外,原产地紫茎泽兰植株的根系分泌液中,在化感物质组成和含量上与入侵地植株的存在差异,导致其在入侵地新颖的土壤环境下对蜡样芽孢杆菌促生作用在短期内更加明显,这是否是新入侵种群的一种快速适应性特质,值得进一步探究。
紫茎泽兰入侵后会呈现资源再分配现象(Fengetal.,2009),这将会影响其与土壤微生物互作关系的改变(Ramirezetal.,2019);基于蜡样芽孢杆菌可以偏利促进紫茎泽兰的生长,而紫茎泽兰的根系分泌液又可促进蜡样芽孢杆菌的增加(Sunetal.,2021),这些丰富了蜡样芽孢杆菌介导的紫茎泽兰入侵扩张机制的内涵。本研究结果在此基础上,证实紫茎泽兰入侵后与有益菌蜡样芽孢杆菌的互作有所增强,且化感作用起着一定的作用,为深入挖掘根际有益菌与入侵植物互作的演变机制提供了科学依据。
