负载聚六亚甲基双胍丝素蛋白纳米粒子抗菌活性及释放性能评价*
2022-03-21赵祎博曹梓珍陈剑鸿
陈 翔,刘 耀,倪 睿,赵祎博,曹梓珍,陈剑鸿
(中国人民解放军陆军军医大学大坪医院药剂科,重庆 400042)
抗菌药物的大量使用导致耐药菌出现,使得细菌感染的治疗更加困难[1]。因此,需要寻找新的抗菌药物及开发新型抗菌制剂,以应对抗菌药物耐药菌带来的挑战。聚六亚甲基双胍(PHMB)是一种阳离子聚合物,对革兰阳性菌和革兰阴性菌均具有较强的抗菌活性,可与带负电的细菌细胞膜结合,导致细胞质渗漏,从而杀死细菌[2-3]。PHMB 具有抗菌活性强、细胞毒性低、生物相容性好等优点[4-5],已被用作伤口消毒剂和治疗伤口感染的泡沫敷料[6-7]。丝素蛋白(SF)是从蚕茧中提取的蛋白质,生物相容性良好,生物降解性可控,力学性能优异[8-9]。SF 作为一种性能良好的生物材料,已在生物医学领域中用作药物的载体材料,如用于制备薄膜、纤维、多孔海绵、水凝胶、纳米粒子等[10]。本研究中将PHMB 负载于SF 纳米粒子(PHMB - NPs),并对PHMB-NPs 进行表征,考察其体外抗菌活性和累积释放率,为新型抗菌敷料的开发提供理论依据。现报道如下。
1 材料与方法
1.1 仪器、试剂与菌种
仪器:SW-CJ-2FD型洁净工作台(苏州安泰空气技术有限公司);Nano ZS90 型激光粒度仪(英国Malvin公司);Gemini型扫描电镜(德国Zeiss公司);IRAffinity-1S型红外光谱仪(日本Shimadzu 公司);THZ - C 型 气浴恒温振荡器(常州市中贝仪器有限公司);PYX -DHS.400 - BS 型隔水式电热恒温培养箱(上海跃进医疗器械有限公司);Allegra X - 30R 型高速冷冻离心机(美国Beckman 公司);84-1A 型磁力搅拌器(上海司乐仪器有限公司);VCX750 型超声破碎仪(美国Sonics 公司);VORTEX-5 型涡旋振荡器(海门市其林贝尔仪器制造有限公司);Synergy H1 型酶标仪(美国BioTek 公司);CoolSafe Pro 110-4 型冷冻干燥机(丹麦LaboGene公司)。
材料和试剂:蚕茧由西南大学肖波教授赠予;PHMB(上海麦克林生化科技有限公司,批号为C12298306,纯度为98%);碳酸钠(批号为H120BA0007,纯度不低于99.8%),三水合醋酸钠(批号为H115BA0010,纯度不低于99%),均购于生工生物工程(上海)股份有限公司;无水氯化钙(批号为402L021,纯度不低于96%),曙红Y(批号为A916L032,纯度不低于88%),透析袋(批号为1123C028),LB 肉汤(批号为1228O031),LB 营养琼脂(批号为1223A031),均购于北京索莱宝科技有限公司;丙酮(重庆川东化工<集团>有限公司,批号为20161201,纯度不低于99.5%)。
菌种:大肠杆菌E577 由中国人民解放军陆军军医大学大坪医院药剂科提供。
1.2 方法
1.2.1 丝素提取[11]
将蚕茧置0.5%碳酸钠溶液中煮沸30 min,用蒸馏水清洗,重复此步骤3次,以彻底除去丝胶。丝素纤维在60 ℃下干燥4 h,用氯化钙-无水乙醇-水溶液(1∶2∶8,V/V/V)在60 ℃条件下溶解1 h。将得到的溶液放入透析袋(截留相对分子量为8 000~14 000)中,置蒸馏水中透析72 h,得丝素溶液,冻干,得丝素冻干粉。
1.2.2 PHMB-NPs制备[12]
将丝素蛋白冻干粉溶于适量水中,得到质量浓度为10 mg/mL 的SF 溶液。将适量PHMB 加入SF 溶液中,使PHMB 的质量浓度为0.8 mg/mL。在涡旋条件下,将2 mL 含有PHMB 的SF 溶液缓慢滴加到10 mL 丙酮中,混合溶液随即呈现乳白色,继续涡旋1 min,冰浴条件下超声处理1 min,于通风装置中搅拌3 h 以挥发丙酮。随后,4 ℃离心(转速为6 000 r/ m)10 min,收集上清液;4 ℃离心(转速为12 500 r/m)20 min,收集纳米粒子。为增加PHMB的负载量进行二次载药,将冻干后的纳米粒子放入不同PHMB 溶液中(1%,0.5%,0.25%,0.1%,0.05%,0.025%,0.01%,m/V)搅拌20 h,4 ℃,离心(转速为12 500 r/ min)20 min,收集纳米粒子,冻干,即得PHMB - NPs(1%,m/V),PHMB - NPs(0.5%,m/V),PHMB-NPs(0.25%,m/V),PHMB-NPs(0.1%,m/V),PHMB - NPs(0.05%,m/V),PHMB - NPs(0.025%,m/V),PHMB-NPs(0.01%,m/V),置-20 ℃条件下保存,备用。
1.2.3 纳米粒子粒径、多分散指数(PDI)、Zeta 电位、药物负载量测定
取PHMB - NPs,均匀分散在蒸馏水中,测量前用样品溶液润洗样品池。取适量溶液于样品池中,采用激光粒度仪测定,重复3次。
纳米粒子中PHMB的含量测定参考《中华人民共和国国家标准·胍类消毒剂卫生要求》(GB/ T 26367 —2020)。取少量PHMB - NPs,用1 mL DMSO 溶解,取适量,加入三水合醋酸钠溶液(10%,m/V)、曙红Y 溶液(0.024%,m/V)、水,按DMSO溶液、三水合醋酸钠溶液、曙红Y溶液、水体积比为2∶1∶2.5∶19.5(V/V/V/V),混匀,采用酶标仪于545 nm 波长处测定吸光度(OD),并计算PHMB含量。
1.2.4 PHMB-NPs 的形貌观察
取少量制备的PHMB - NPs 样品,滴加于硅片上,自然风干。将载有样品的硅片用导电胶固定在铜钉台上,行喷金处理,采用扫描电子显微镜(SEM)观察PHMB-NPs的形貌。
1.2.5 傅里叶变换红外光谱检测
取1 mg PHMB-NPs 和50 mg 溴化钾,置玛瑙研钵中,充分研磨,放入模具,压片。采用傅里叶红外光谱仪进行检测,设置扫描范围为4 000~400 cm-1,分辨率为4 cm-1。
1.2.6 抗菌活性试验[13]
采用牛津杯抑菌圈法观察纳米粒子对大肠杆菌E577 的抗菌活性。取各PHMB-NPs 3 mg,加入200µL蒸馏水,吹打均匀。取0.1 mL 107cfu/ mL 大肠杆菌E577 菌悬液,滴加于LB 营养琼脂平板上,用涂布棒将菌悬液涂布均匀,将牛津杯置琼脂平板上,吸取各PHMBNPs 混悬液200µL,加至牛津杯内。将此琼脂平板放入37 ℃培养箱中培养24 h,观察抑菌圈大小,用游标卡尺测量并计算抑菌圈宽度,重复3 次。抑菌圈宽度=抑菌圈直径-牛津杯直径。
1.2.7 PHMB-NPs 体外释放曲线建立[14]
分别称取PHMB - NPs(1%,m/V),PHMB - NPs(0.5%,m/V),PHMB - NPs(0.25%,m/V)各100 mg,加入适量蒸馏水,使纳米粒子分散均匀。将混悬液放入透析袋(截留相对分子量为3 500~5 000)中,用细线扎紧透析袋两端,将此透析袋放入装有10 mL pH 为7.2的磷酸盐缓冲液(PBS)的试管中,置气浴恒温振荡器中培养,设置转速为100 r/min,温度为37 ℃。在预定时间点,吸取1 mL 样品溶液测定含量,加入1 mL 新鲜PBS溶液,并保持试管内体积不变。
向样品中加入三水合醋酸钠溶液(10%,m/V)、曙红Y 溶液(0.024%,m/V)、水,按DMSO 溶液、三水合醋酸钠溶液、曙红Y 溶液、水体积比为10∶1∶2.5∶11.5(V/V/V/V),混匀,采用酶标仪于545 nm 波长处测定OD,并计算PHMB 含量。
2 结果
2.1 粒径、PDI、Zeta 电位、药物负载量
纳米粒子的粒径、PDI、Zeta 电位、药物负载量见表1。纳米粒子的粒径范围为150~170 nm,PDI 值均小于0.16,说明粒径的分布范围较窄。SF-NPs 的Zeta 电位为负值,PHMB-NPs的Zeta电位均为正值,说明负载PHMB 后,SF - NPs 表面的负电荷被中和,并由负电变为正电。二次载药时,纳米粒子的药物负载量随PHMB溶液质量体积比的增加而增加。
表1 纳米粒子的粒径、PDI、Zeta电位和药物负载量(±s,n=3)Tab.1 Particle size,PDI,Zeta potential and drug-loading content of nanoparticles(±s,n=3)

表1 纳米粒子的粒径、PDI、Zeta电位和药物负载量(±s,n=3)Tab.1 Particle size,PDI,Zeta potential and drug-loading content of nanoparticles(±s,n=3)
纳米粒子SF-NPs PHMB-NPs 0.01%0.025%0.05%0.1%0.25%0.5%1%粒径(nm)159.7±7.159 159.6±4.687 162.4±5.116 163.7±5.021 160.3±2.892 153.5±8.902 159.3±10.03 169.0±9.945 PDI 0.120±0.006 0.128±0.013 0.141±0.012 0.090±0.015 0.120±0.023 0.155±0.034 0.110±0.031 0.098±0.038 Zeta电位-19.0±0.306 45.4±0.321 51.3±0.987 53.3±1.530 49.7±0.666 48.6±0.700 48.8±0.306 46.5±0.700药物负载量(%)2.30±0.34 2.56±0.41 3.25±0.2 3.67±0.27 5.82±0.31 7.41±0.42 11.51±0.25
2.2 形貌
纳米粒子的形貌见图1。可见,所有纳米粒子均呈球形颗粒状,平均粒径小于100 nm。

a.SF-NPs b.PHMB-NPs(0.01%) c.PHMB-NPs(0.025%) d.PHMB-NPs(0.05%) e.PHMB-NPs(0.1%)f.PHMB-NPs(0.25%) g.PHMB-NPs(0.5%) h.PHMB-NPs(1%)图1 纳米粒子的SEM图(×50 000)a.SF-NPs b.PHMB-NPs(0.01%) c.PHMB-NPs(0.025%) d.PHMB-NPs(0.05%) e.PHMB-NPs(0.1%) f.PHMB-NPs(0.25%)g.PHMB-NPs(0.5%) h.PHMB-NPs(1%)Fig.1 SEM photographs of nanoparticles(×50 000)
2.3 傅里叶变换红外光谱
纳米粒子的红外光谱图见图2,1 645,1 521,1 232 cm-1波数处的特征吸收峰分别对应SF 中3 个酰胺键的伸缩振动吸收峰。随着纳米粒子中PHMB负载量的增加,SF 的特征吸收峰并无明显区别,说明负载PHMB后SF的分子构象未发生明显改变。
图2 纳米粒子的红外光谱图Fig.2 Fourier transform infrared spectra of nanoparticles
2.4 抗菌活性试验
由图3 可知,PHMB - NPs(1%,m/V),PHMB -NPs(0.5%,m/V),PHMB-NPs(0.25%,m/V)均显示出抑菌圈,其余质量体积比PHMB-NPs 及SF-NPs 均未显示出抑菌圈。PHMB-NPs对大肠杆菌E577的抑菌圈宽度见表2。
表2 纳米粒子对大肠杆菌E577的抑菌圈宽度(±s,n=3)Tab.2 Width of inhibition zone of nanoparticles against Escherichia coli E577(±s,n=3)

表2 纳米粒子对大肠杆菌E577的抑菌圈宽度(±s,n=3)Tab.2 Width of inhibition zone of nanoparticles against Escherichia coli E577(±s,n=3)
纳米粒子PHMB-NPs SF-NPs 1%0.5%0.25%0.1%0.05%0.025%0.01%抑菌圈宽度(mm)5.52±0.187 2.26±0.226 0.39±0.185 0 0 0 0 0

图3 PHMB-NPs对大肠杆菌E577的抑制作用Fig.3 Inhibitory effect of PHMB-NPs on Escherichia coli E577
2.5 体外释放曲线
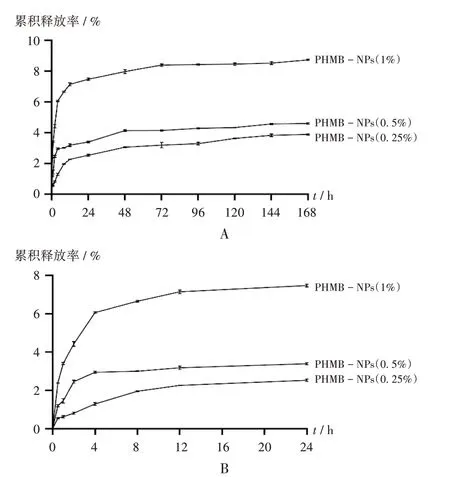
由于PHMB - NPs(0.1%,m/V),PHMB - NPs(0.05%,m/V),PHMB-NPs(0.025%,m/V),PHMBNPs(0.01%,m/V)均未显示出抗菌活性,故不评价其体外释放情况。PHMB 的体外释放曲线见图4。PHMB在PBS中的释放主要集中在24 h内,之后PHMB持续释放,但释放率不高,释放168 h 后PHMB - NPs(1%,m/V),
PHMB-NPs(0.5%,m/V),PHMB-NPs(0.25%,m/V)的累积释放率分别为(8.74±0.04)%、(4.60±0.06)%、(3.89±0.04)%。
3 讨论
伤口的治疗会给医疗保障部门带来巨大的经济负担。在美国,所有伤口类型的医疗保险支出总额估计为281亿至968亿美元,且随着人口老龄化的加剧,全球用于伤口治疗的支出正在迅速增加[15]。伤口一旦被细菌感染,可导致组织损伤、基质重塑、胶原纤维降解等,延长其愈合时间[16]。由于越来越多的细菌对抗菌药物产生了耐药性,传统的抗菌药物治疗达不到期望的疗效[17]。此外,治疗开放性伤口感染时,杀菌剂不会产生临床相关耐药性的风险,抗菌谱更广,皮肤致敏率更低,比抗菌药物更具优势[18-19]。故选用PHMB为模型药物以制备抗菌制剂。
A.168 h内 B.24 h内图4 PHMB-NPs在37 ℃PBS中的体外释放曲线(n=3)A.Within 168 h B.Within 24 hFig.4 In vitro release profiles of PHMB - NPs in PBS at 37 ℃(n=3)
SF是来源于蚕茧的天然蛋白质,由1个重链(350 000)、1 个轻链(26 000)和1 个P25 基因编码的糖蛋白组成。SF 主要有Silk Ⅰ和Silk Ⅱ2 种构象,Silk Ⅰ溶于水,包含无规则卷曲、α螺旋和其他非晶态结构;而Silk Ⅱ不溶于水,主要包含β折叠结构[20]。通过混合水溶性的SF和与水互溶的有机溶剂,可以制备纳米粒子,期间SF的构象可从Silk Ⅰ立即转化为Silk Ⅱ,生成不溶于水的纳米粒子[21]。SF具有良好的生物相容性、可控的降解性和可调节的药物释放特性,已广泛用于药物递送系统的制备[22]。有研究表明,纳米颗粒具有与伤口治疗相关的有益特性,如药物的控制释放[23]。故本研究中选择以SF为药物载体制备负载PHMB的纳米粒子。
本研究中使用激光粒度仪测定了纳米粒子的粒径、PDI和Zeta 电位。通过检测发现,所有纳米粒子粒径均在160 nm 左右,且具有良好的单分散性。此外,在负载PHMB 后,SF 表面的电位由负值变为正值。所有纳米粒子Zeta 电位的绝对值接近或大于20 mV,表明纳米粒子的分散体系具有良好的稳定性。通过观察SEM 图像中显示的粒径,纳米粒子平均粒径小于100 nm,与激光粒度仪测定的粒径差别较大,可能是由于用激光粒度仪测定时纳米粒子在水中呈膨胀状态,用SEM 观察形貌时纳米粒子经过干燥而处于收缩状态。
通过对比不同纳米粒子的红外光谱图发现,差异不明显,没有因为负载PHMB含量的增加而出现明显变化,说明PHMB的加入不会改变SF的分子构象。
牛津杯抑菌圈试验表明,PHMB-NPs 在质量体积比高于0.2%(m/V)的PHMB 溶液中进行二次载药,所得纳米粒子才具有抗菌活性。因此,选取了PHMB-NPs(1%,m/V),PHMB - NPs(0.5%,m/V),PHMB - NPs(0.25%,m/V)3 种纳米粒子进行PHMB 的体外释放试验,发现PHMB 的释放主要集中在24 h 内,且纳米粒子上负载的PHMB 含量越高,累积释放率也越高。这可能是因为,当PHMB 含量较低时,带正电的SF 和带负电的PHMB间的静电相互作用较强,使得PHMB难以克服SF的束缚而释放;而当PHMB 含量较高时,SF 表面的负电被PHMB 中和,SF 与PHMB 的静电相互作用变弱,导致PHMB释放增加[24]。
本研究中成功制备了负载PHMB 的PHMB - NPs,并考察了其抗菌活性和体外释放性。结果表明,PHMB-NPs具有良好的抗菌作用,是一种具有应用潜力的抗菌制剂。本研究为进一步将其开发成新型抗菌敷料提供了实验依据。
