基于超分子传感技术研究血府逐瘀汤对三甲胺结肠吸收的影响
2022-03-21王璐瑶张亚平穆琦瑄于卉娟王跃飞
王璐瑶,张亚平,穆琦瑄,于卉娟,王跃飞
基于超分子传感技术研究血府逐瘀汤对三甲胺结肠吸收的影响
王璐瑶,张亚平,穆琦瑄,于卉娟*,王跃飞
天津中医药大学 省部共建组分中药国家重点实验室,天津市中药化学与分析重点实验室,天津 301617
基于超分子传感技术研究血府逐瘀汤对三甲胺结肠吸收的影响。采用离体外翻肠囊模型研究三甲胺的结肠吸收;基于指示剂置换分析策略,构建选择性识别三甲胺的超分子荧光传感体系,评价血府逐瘀汤对三甲胺结肠吸收的影响。基于杯芳烃分子识别的超分子传感体系实现了三甲胺的灵敏检测;与对照组相比,血府逐瘀汤高剂量(5.0 mg/mL)组显著降低结肠单位面积三甲胺的累积吸收量(<0.05、0.01、0.001),血府逐瘀汤低剂量(2.5 mg/mL)组能够减少结肠单位面积三甲胺的累积吸收量,但与对照组相比无显著性差异。血府逐瘀汤能够减少三甲胺的结肠吸收,为血府逐瘀汤活血化瘀作用提供一定依据。
超分子传感;血府逐瘀汤;指示剂置换分析;三甲胺;外翻肠囊法
三甲胺是胆碱、甜菜碱及肉碱等经肠道菌群代谢生成的产物,经肝脏黄素单加氧酶3(flavin-containing monooxygenase 3,FMO3)转化生成氧化三甲胺(trimethylamine-oxide,TMAO)[1]。研究表明,血浆TMAO水平升高可导致血小板高反应性,增加血栓形成风险,与心血管事件的发生呈正相关[2-3]。因此,通过干预三甲胺的吸收,减少三甲胺向TMAO的转化,减少TMAO的生成,从而降低血栓形成风险,有助于预防心血管疾病的发生。血府逐瘀汤源自清代王清任的《医林改错》,具有活血祛瘀、行气止痛的功效,临床上广泛用于心血管疾病的预防和治疗[4-5]。目前,关于血府逐瘀汤是否调控三甲胺的结肠吸收鲜有报道。
三甲胺相对分子质量小,无显色团,为强极性的有机小分子。目前检测三甲胺的方法主要为气相色谱-质谱联用法、液相色谱-质谱联用法、核磁共振法[6],但检测前样品需进行衍生化或同位素标记等预处理,存在操作繁琐、分析时间长、检测成本高等缺点。基于指示剂置换分析(indicator displacement assay,IDA)的超分子传感技术,通过指示剂荧光信号改变实现分析物的检测,具有操作简单、灵敏度高等优势。基于IDA策略,本课题组前期构建了胍基杯[5]芳烃-荧光素钠主客体对传感体系,提供了一种易操作、低成本、无标记、灵敏检测TMAO的方法,实现了人工尿液和模拟疾病尿液中TMAO的检测[7]。本研究构建超分子荧光传感体系识别检测三甲胺,探究血府逐瘀汤对三甲胺结肠吸收的影响,旨在阐明血府逐瘀汤调控与血栓形成相关的三甲胺-TMAO通路的作用。
1 材料
1.1 动物
SPF级雄性Wistar大鼠,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006。动物饲养于天津药物研究院新药评价有限公司,室温22~25 ℃,相对湿度(40±10)%。动物实验经天津药物研究院新药评价有限公司实验动物管理与使用委员会批准(批准号2020060801)。
1.2 药材
柴胡、川芎、炒桃仁、红花、当归、赤芍、炒枳壳、生地、桔梗、甘草、牛膝饮片购自河北美威药业股份有限公司,经天津中医药大学李天祥教授鉴定分别为伞形科植物柴胡DC.的干燥根、伞形科植物川芎Hort.的干燥根茎、蔷薇科植物桃(L.) Batsch的干燥成熟种子、菊科植物红花L.的干燥花、伞形科植物当归(Oliv.) Diels的干燥根、毛茛科植物芍药Pall.的干燥根、芸香科植物酸橙L.及其栽培变种的干燥未成熟果实、玄参科植物地黄Libosch.的新鲜或干燥块根、桔梗科植物桔梗(Jacq.) A. DC.的干燥根、豆科植物甘草Fisch.干燥根和根茎、苋科植物牛膝Bl.的干燥根,均符合《中国药典》2020年版饮片质量标准。
1.3 药品与试剂
氯化钠、氯化钾、碳酸氢钠、磷酸二氢钠、氯化镁、氯化钙、葡萄糖购自上海阿拉丁生化科技股份有限公司;稀盐酸购自天津市化学试剂供销公司;三甲胺(批号BCBZ6954)购自美国Sigma-Aldrich公司;恶嗪1(oxazine 1,OX1,批号AAT-89)购自武汉艾美捷科技有限公司;磺化杯[4]芳烃(-sulfonatocalix[4]arene,SC4A)由南开大学化学学院郭东升教授惠赠。
1.4 仪器
Varian Cary Eclipse型荧光分光光度计(美国安捷伦科技有限公司);ME 204型万分之一天平、MS 105DU型十万分之一天平(瑞士梅特勒-托利多公司);FDU-2110型冷冻干燥机(上海爱朗仪器有限公司);DB043型离体器官测量系统(北京智鼠多宝生物科技有限责任公司);Centrifuge 5424R型台式离心机(德国艾本德股份公司);Milli-Q超纯水仪(美国密理博公司)。
2 方法
2.1 样品及溶液的制备
2.1.1 血府逐瘀汤冻干粉的制备 取4 g当归、4 g柴胡、6 g桔梗、6 g川芎、8 g甘草、8 g炒枳壳、8 g赤芍、12 g生地、12 g红花、12 g牛膝、15 g炒桃仁,置于圆底烧瓶中,加入8倍量水,回流提取2次,每次提取2 h,合并水提液,浓缩,冷冻干燥,得血府逐瘀汤冻干粉末,备用。根据本课题组已建立方法[8],测定血府逐瘀汤冻干粉中主要成分的含量,冻干粉样品含苦杏仁苷3.50 mg/g、芍药苷5.33 mg/g、阿魏酸0.27 mg/g、柚皮苷7.28 mg/g、新橙皮苷6.18 mg/g、甘草酸1.96 mg/g。
2.1.2 Tyrode缓冲液的配制 按照文献方法[9]配制Tyrode缓冲液:取0.28 g氯化钾、8.0 g氯化钠、0.05 g磷酸二氢钠、1.0 g碳酸氢钠、0.1 g氯化镁,溶于500 mL蒸馏水中,搅拌均匀;取0.2 g氯化钙溶于500 mL蒸馏水中,搅拌均匀;将上述溶液混合均匀,临用前加入1.0 g葡萄糖,用稀盐酸调pH至7.4,备用。
2.1.3 样品溶液的制备 取血府逐瘀汤冻干粉,精密称定,用Tyrode缓冲液分别配制质量浓度为5.0、2.5 mg/mL的血府逐瘀汤样品溶液,备用。
取SC4A、OX1、三甲胺,精密称定,分别用超纯水配制成浓度为100 mmol/L、100 µmol/L、100 mmol/L的储备液,备用。
2.2 外翻肠囊模型的构建与取样
按照文献方法[9]构建外翻肠囊模型。Wistar大鼠实验前16 h禁食,自由饮水,随机分成5组,每组6只。大鼠ip 3%戊巴比妥钠麻醉(40 mg/kg),剥离大鼠肠管,剪取结肠(4~7 cm),用Tyrode缓冲液冲洗至无内容物。将肠管一端结扎,翻转肠管,另一端结扎成囊状。向肠囊内注入1 mL Tyrode缓冲液,将其放入麦氏浴槽(20 mL Tyrode缓冲液)中,并向浴槽中通入95% O2和5% CO2,保持37 ℃,平衡5 min,将麦氏浴槽中的Tyrode缓冲液放出,分别加入20 mL样品溶液:5 mmol/L三甲胺(三甲胺对照组)、5.0 mg/mL血府逐瘀汤(高剂量血府逐瘀汤对照组)、2.5 mg/mL血府逐瘀汤(低剂量血府逐瘀汤对照组)、5.0 mg/mL血府逐瘀汤+5 mmol/L三甲胺(高剂量血府逐瘀汤测试组)、2.5 mg/mL血府逐瘀汤+5 mmol/L三甲胺(低剂量血府逐瘀汤测试组),分别于15、30、45、60、90、120 min时从肠囊内取样200 μL,同时补足相同体积的Tyrode缓冲液。各组实验结束后将肠管纵向剖开,自然摊于滤纸上测量长度和宽度,计算结肠吸收面积。
2.3 荧光分光光度计实验条件
2.3.1 检测溶液的配制 将“2.2”项下采集的肠囊液,12 000 r/min离心10 min,取上清液100 μL,用Tyrode缓冲液稀释10倍,加入SC4A(测试体系中终浓度为0.4 mmol/L)和OX1(测试体系中终浓度为1 μmol/L)混匀,总体积为1 mL,进行荧光检测。由于肠囊液经Tyrode缓冲液稀释10倍后进行荧光检测,故测试体系中血府逐瘀汤质量浓度为0.50、0.25 mg/mL。
2.3.2 检测条件 采用配备Cary Single-cuvette Peltier比色皿控温装置的Varian Cary Eclipse荧光光谱仪进行检测,样品池为石英比色皿,光程为10 mm;荧光滴定试验均在37 ℃下进行。
在目标跟踪系统中,解决非线性滤波最常用的方法是EKF方法及其相关改进算法。CKF算法是近年来新出现的一种非线性滤波算法,该算法利用了三阶球面-径向容积积分准则进行了严密的数学推导,在理论上对该算法具有严格的保证[5-6],估计精度和数值稳定性都比较高。在对CKF算法深入研究的基础上,有学者提出了降维CKF算法[6-7],并将降维CKF成功应用于工程实践[7-8]。
2.3.3 数据统计 荧光滴定数据采用主客体1∶1包结模型拟合公式(oneHost_oneGuest,oneHost_ oneGuest_oneCompetitor)拟合[7],获得主客体对键合常数(association constant,a)。a、线性关系、检测限(LOD)的测定均重复3次试验。
3 结果
3.1 杯芳烃超分子荧光传感体系的构建
在超分子荧光传感体系中,为了提高荧光灵敏度,降低干扰物的影响,选择具有高荧光量子效率及与大环主体分子有强键合的染料作为指示剂,确保大环分子-染料主客体络合时荧光强度发生显著变化。基于IDA策略,分析物(竞争客体)与染料竞争大环主体的空腔,将染料从络合物中置换出来,引起体系荧光强度增大或减小,从而实现分析物的传感检测[10]。
染料OX1具有较高的荧光量子效率,与大环主体SC4A络合后自身荧光被淬灭,传感体系荧光强度变化范围宽,是杯芳烃超分子传感体系的理想荧光指示剂[11]。而且,在Tyrode缓冲液中,OX1(1 μmol/L)荧光强度不受三甲胺(13 mmol/L)和血府逐瘀汤(0.50、0.25 mg/mL)的影响(图1)。
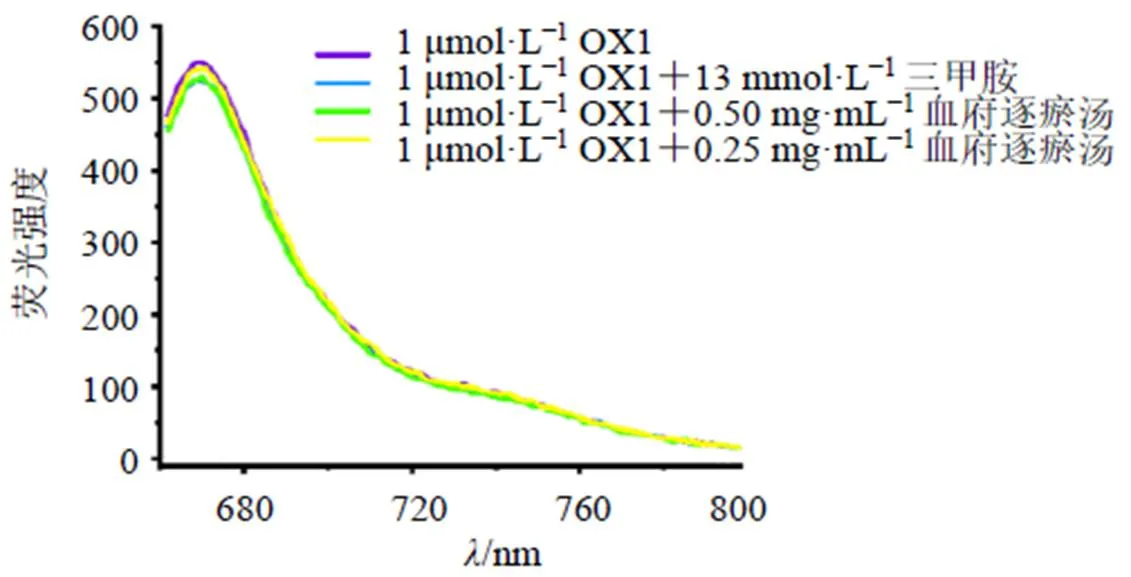
图1 在三甲胺 (13 mmol·L−1)或血府逐瘀汤(0.50、0.25 mg·mL−1) 条件下OX1 (1 μmol·L−1) 的荧光光谱(λex=648 nm,λem=660~800 nm)
血府逐瘀汤药味多,化学成分复杂。为评价SC4A•OX1主客体对传感体系对三甲胺检测的识别选择性,系统考察了在血府逐瘀汤样品溶液(0.50、0.25 mg/mL)中SC4A对三甲胺的包结能力。
在Tyrode缓冲液中,将SC4A(0~2.45 mmol/L)逐步滴加到OX1(1 μmol/L)中,大环主体分子SC4A与指示剂OX1发生可逆结合,OX1的荧光信号被显著淬灭,获得一系列随SC4A增加而荧光强度降低的荧光发射光谱(图2-A)。将OX1荧光光谱最大发射波长处(668 nm)的荧光强度与SC4A的浓度采用主客体1∶1包结模型拟合公式(oneHost_ oneGuest)进行拟合,获得SC4A•OX1主客体对键合常数,即a=(2.44±0.04)×103L/mol。
将三甲胺(0~12.48 mmol/L)逐步滴加到SC4A•OX1(0.4 mmol/L•1 μmol/L)主客体对溶液中,三甲胺与OX1竞争SC4A的空腔,将OX1从SC4A•OX1络合物中置换出来,OX1恢复在溶液中的荧光信号,如图2-B所示。将OX1荧光光谱最大发射波长处(668 nm)的荧光强度与三甲胺的浓度采用主客体1∶1竞争包结模型拟合公式(oneHost_ oneGuest_oneCompetitor)进行拟合,得SC4A•三甲胺主客体对键合常数,即a=(4.42±0.28)×103L/mol。

Tyrode缓冲液(A)、0.50 mg·mL−1血府逐瘀汤 (C)、0.25 mg·mL−1血府逐瘀汤(E) 中SC4A (0~2.45 mmol·L−1) 与OX1 (1 μmol·L−1)的荧光滴定光谱(插图为OX1在λem=668 nm的荧光强度与SC4A浓度的非线性拟合曲线);Tyrode缓冲液(B)、0.50 mg·mL−1血府逐瘀汤(D)、0.25 mg·mL−1血府逐瘀汤(F) 中三甲胺 (0~12.48 mmol·L−1) 与SC4A•OX1 (0.4 mmol·L−1 •1 μmol·L−1) 主客体对的荧光竞争滴定光谱(插图为OX1在λem=668 nm的荧光强度与三甲胺浓度的非线性拟合曲线)
结果表明,在Tyrode缓冲液、血府逐瘀汤(0.50、0.25 mg/mL)中测得SC4A•三甲胺主客体对键合常数基本一致,键合较强,即在高、低质量浓度血府逐瘀汤中SC4A能够选择性识别三甲胺,实现三甲胺传感检测。
3.2 Tyrode缓冲液、血府逐瘀汤样品溶液中三甲胺测定标准曲线的建立
基于IDA策略,分析物与染料竞争大环分子主体的空腔,在一定浓度范围内随着分析物浓度的增加,染料荧光强度呈线性增加,从而构建分析物检测的标准曲线。在Tyrode缓冲液中,SC4A•OX1(0.4 mmol/L•1 μmol/L)主客体对的荧光强度随三甲胺(0~0.62 mmol/L)浓度增加呈线性增加,以三甲胺浓度和OX1荧光强度(em=668 nm)变化的比值(/0,其中0和分别为未加入和加入三甲胺时OX1荧光信号强度值)进行线性拟合,得线性方程,=442.82+1.008 7(2=0.995 2),如图3-A所示。根据3/slope法计算三甲胺的LOD[12-13],计算得Tyrode缓冲液中三甲胺的LOD为(32.78±2.63)μmol/L。同理在0~0.62 mmol/L,0.50 mg/mL血府逐瘀汤样品溶液(图3-B)和0.25 mg/mL血府逐瘀汤样品溶液(图3-C)中建立了三甲胺检测的标准曲线,LOD分别为(36.06±5.10)、(35.08±3.35)μmol/L。
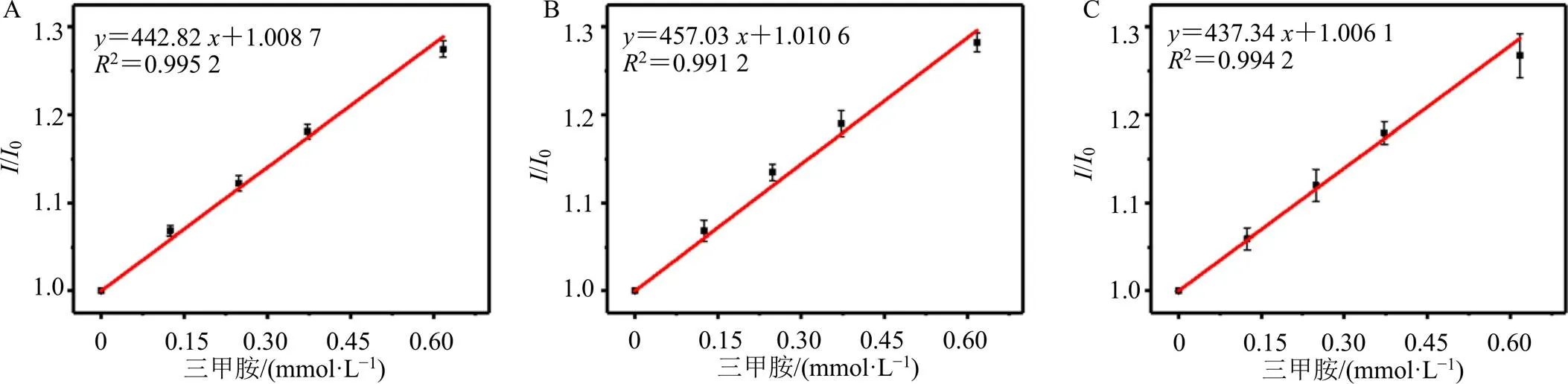
图3 在Tyrode缓冲液 (A)、0.50 mg·mL−1血府逐瘀汤样品溶液(B)、0.25 mg·mL−1血府逐瘀汤样品溶液(C) 中OX1荧光强度比值与三甲胺浓度的线性拟合方程
3.3 肠囊溶液中三甲胺的测定
本研究构建了SC4A•OX1超分子主客体对传感体系识别检测三甲胺,探究血府逐瘀汤对三甲胺结肠吸收的影响。
将“2.3.1”项下各测试液进行荧光检测,三甲胺对照组、高剂量血府逐瘀汤对照组、低剂量血府逐瘀汤对照组、高剂量血府逐瘀汤测试组、低剂量血府逐瘀汤测试组所测的荧光强度分别记为对照、高对照、低对照、高测试、低测试。Tyrode缓冲液中SC4A•OX1(0.4 mmol/L•1 μmol/L)荧光强度值记为0。
将三甲胺对照组荧光变化值(对照/0)、高剂量血府逐瘀汤测试组荧光变化值(高测试/高对照)、低剂量血府逐瘀汤测试组荧光变化值(低测试/低对照)分别代入“3.2”项中Tyrode缓冲液、0.50 mg/mL血府逐瘀汤、0.25 mg/mL血府逐瘀汤中测得的标准曲线,计算得测试溶液中三甲胺浓度(mmol/L),记为C(=15、30、45、60、90、120 min)。因为测试样品在测试时稀释10倍,故各肠囊中三甲胺的浓度为10C。三甲胺结肠累积吸收量()按照公式(1)[9]计算,三甲胺结肠单位面积累积吸收量(μg/cm2)按照公式(2)[9]计算。
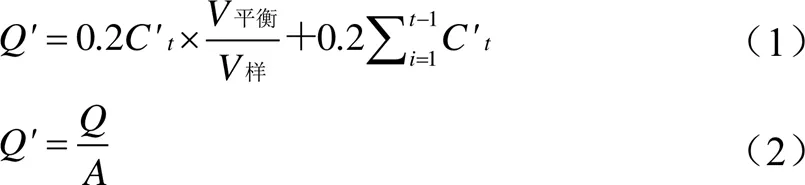
平衡为平衡前肠囊中加入Tyrode缓冲液(1 mL)的体积,样为每次取样的体积(200 μL),C'为各取样时间点肠囊中三甲胺的质量浓度(mg/L),C'为第(+1)时肠囊中三甲胺的质量浓度(mg/L);代表离体肠囊面积(cm2),为剪开肠囊后量取其长度和宽度的乘积
如图4所示,肠囊离体培养15~120 min,与三甲胺对照组比较,5.0 mg/mL血府逐瘀汤测试组中三甲胺结肠单位面积累积吸收量明显降低,且30、45、60、120 min时具有显著性差异(<0.05、0.01、0.001);2.5 mg/mL血府逐瘀汤测试组中三甲胺结肠单位面积累积吸收量与对照组相比呈降低趋势,但无显著性差异。
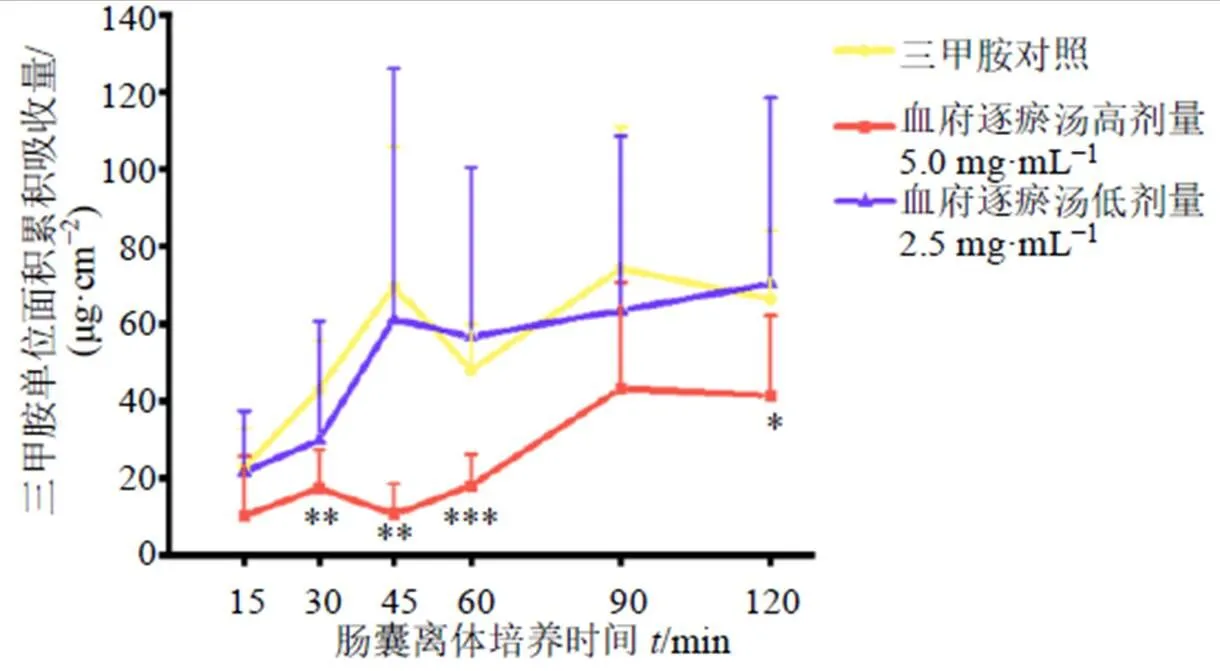
与三甲胺对照组比较:*P<0.05 **P<0.01 ***P<0.001
4 讨论
近年来,超分子化学在生物、环境、医药等领域发挥重要作用[14]。超分子化学主要研究2种或2种以上的分子通过非共价弱相互作用力(如氢键、静电作用、疏水作用等)结合形成的聚集体(超分子)[15]。环糊精、杯芳烃、葫芦脲等大环主体分子是超分子化学重要组成部分。在超分子传感领域中,IDA是由美国化学家Eric V. Anslyn教授研发的荧光传感策略[16],是基于指示剂(染料客体)、分析物(竞争客体)与大环主体的竞争性结合,导致测试体系荧光信号增敏(switch-on)或淬灭(switch-off),从而将微观的分子识别行为转化为宏观的易于观察的荧光信号,从而实现分析物的检测。这种基于IDA策略的超分子传感检测不受限于分析物有无发色团,无需同位素标记,具有操作简单、信号灵敏、检测通量高等优势。本研究基于IDA策略,构建了SC4A•OX1超分子主客体对传感体系(图5),以a为评价指标,评价了Tyrode缓冲液、血府逐瘀汤中SC4A对三甲胺识别的选择性,实现了三甲胺的灵敏检测。
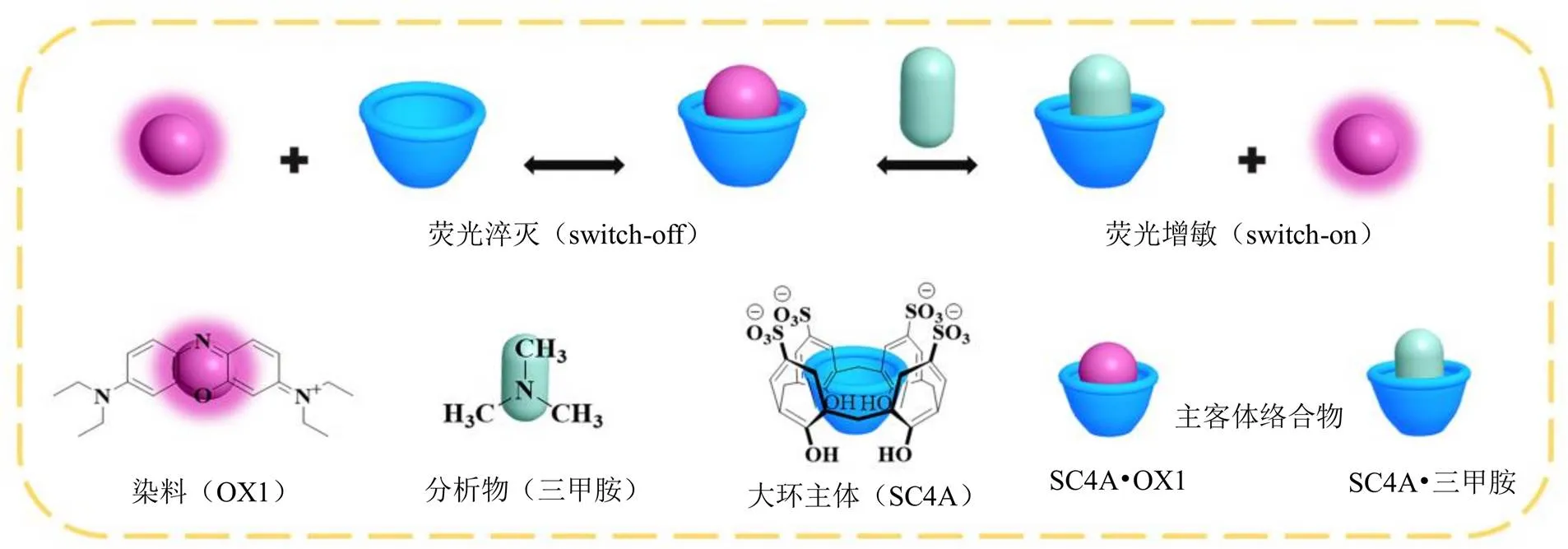
图5 IDA示意图
方剂通过干预免疫应答、影响微生物酶代谢系统、调控肠道菌群,从而干预疾病[17]。膳食中的胆碱、甜菜碱及肉碱类物质经肠道菌群代谢产生三甲胺,在肝脏中经FMO3氧化成心血管“危险分子”TMAO,诱发心血管疾病。近年来,已有研究报道白藜芦醇[18]、葫芦巴碱[19]、黄连素[20]等中药成分通过重塑肠道菌群,抑制胆碱向三甲胺转化,减少三甲胺产生,降低体内TMAO水平,从而降低心血管疾病风险。目前,关于血府逐瘀汤抗TMAO诱导的血栓性疾病研究主要聚焦于其入血成分调控的三甲胺-FMO3-TMAO通路,通过抑制FMO3活性,抑制TMA向TMAO的体内转化,减少TMAO生成,从而延缓或阻断心血管疾病的发生与发展[11]。本研究采用离体外翻肠囊模型研究血府逐瘀汤对三甲胺结肠吸收的影响,结果表明,血府逐瘀汤可抑制结肠吸收三甲胺,为血府逐瘀汤调控与血栓形成相关的三甲胺-TMAO通路的作用提供了依据。
本研究基于IDA策略构建了杯芳烃超分子传感体系,实现了三甲胺的灵敏检测,探究了血府逐瘀汤对三甲胺结肠吸收的影响。血府逐瘀汤能够减少三甲胺结肠的吸收,为揭示血府逐瘀汤调控与血栓形成相关的三甲胺-TMAO通路的机制提供了科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Koeth R A, Wang Z N, Levison B S,. Intestinal microbiota metabolism of-carnitine, a nutrient in red meat, promotes atherosclerosis [J]., 2013, 19(5): 576-585.
[2] Zhu W F, Gregory J C, Org E,. Gut microbial metabolite TMAO enhances platelet hyperreactivity and thrombosis risk [J]., 2016, 165(1): 111-124.
[3] He S Y, Jiang H, Zhuo C L,. Trimethylamine/ trimethylamine--oxide as a key between diet and cardiovascular diseases [J]., 2021, 21(8): 593-604.
[4] 吴剑宏, 陈幸谊. 血府逐瘀汤方剂的现代药理研究进展 [J]. 中成药, 2013, 35(5): 1054-1058.
[5] 孟瑶, 赵丹阳, 隋月皎. 血府逐瘀胶囊治疗冠心病疗效的Meta分析 [J]. 药物评价研究, 2021, 44(9): 1990-1997.
[6] 杨睿颖, 朱秋劲, 白晶, 等. 肉制品中三甲胺检测方法的应用研究进展 [J]. 食品研究与开发, 2020, 41(23): 212-219.
[7] Yu H J, Geng W C, Zheng Z,. Facile fluorescence monitoring of gut microbial metabolite trimethylamine-oxide via molecular recognition of guanidinium-modified calixarene [J]., 2019, 9(16): 4624-4632.
[8] Zhang L, Zhu L, Wang Y F,. Characterization and quantification of major constituents of Xue Fu Zhu Yu by UPLC-DAD-MS/MS [J]., 2012, 62: 203-209.
[9] 朱晶晶, 王智民, 龚慕辛, 等. 基于肠吸收的质量评价指标选择的方法和原则 [J]. 中国中药杂志, 2011, 36(6): 659-662.
[10] Sedgwick A C, Brewster J T, Wu T H,. Indicator displacement assays (IDAs): The past, present and future [J]., 2021, 50(1): 9-38.
[11] Yu H J, Chai X, Geng W C,. Facile and label-free fluorescence strategy for evaluating the influence of bioactive ingredients on FMO3 activity via supramolecular host-guest reporter pair [J]., 2021, 192: 113488.
[12] Huang G B, Wang S H, Ke H,. Selective recognition of highly hydrophilic molecules in water by endo-functionalized molecular tubes [J]., 2016, 138(44): 14550-14553.
[13] MacDougall D, Crummett W, Lal J,. Guidelines for data acquisition and data quality evaluation in environmental chemistry [J]., 1980, 52(14): 2242-2249.
[14] Geng W C, Sessler J L, Guo D S. Supramolecular prodrugs based on host-guest interactions [J]., 2020, 49(8): 2303-2315.
[15] Samorì P, Giuseppone N. From supramolecular chemistry to complex chemical systems [J]., 2019, 25(58): 13229-13230.
[16] Nguyen B T, Anslyn E V. Indicator-displacement assays [J]., 2006, 250(23/24): 3118-3127.
[17] 丁佳敏, 张竞, 肖明明, 等. 方剂“从肠道菌群论治”的理论与实践 [J]. 世界科学技术—中医药现代化, 2018, 20(2): 157-162.
[18] Chen M L, Yi L, Zhang Y,. Resveratrol attenuates trimethylamine--oxide (TMAO)-induced atherosclerosis by regulating TMAO synthesis and bile acid metabolism via remodeling of the gut microbiota [J]., 2016, 7(2): e02210-e02215.
[19] Anwar S, Bhandari U, Panda B P,. Trigonelline inhibits intestinal microbial metabolism of choline and its associated cardiovascular risk [J]., 2018, 159: 100-112.
[20] Li X, Su C, Jiang Z,. Berberine attenuates choline-induced atherosclerosis by inhibiting trimethylamine and trimethylamine--oxide production via manipulating the gut microbiome [J]., 2021, 7(1): 36.
Effect of Xuefu Zhuyu Decoction on trimethylamine absorption based on supramolecular sensing technology
WANG Lu-yao, ZHANG Ya-ping, MU Qi-xuan, YU Hui-juan, WANG Yue-fei
State Key Laboratory of Component-based Chinese Medicine, Tianjin Key Laboratory of TCM Chemistry and Analysis, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
To study the effect of Xuefu Zhuyu Decoction (血府逐瘀汤) on trimethylamine (TMA) absorption based on supramolecular sensing technology.The model of everted intestinal sac was used to explore the affection of Xuefu Zhuyu Decoction on colon absorption of TMA. Based on the indicator displacement assay, a supramolecular fluorescence sensing system was established for selective recognition of TMA, which was employed to evaluate the effect of Xuefu Zhuyu Decoction on colonic absorption of TMA.The established supramolecular sensing method can successfully detect TMA via molecular recognition of calixarene. Compared with control group, the cumulative absorption of TMA per unit area of colon in high-dose Xuefu Zhuyu Decoction (5.0 mg/mL) group was significantly decreased (< 0.05, 0.01, 0.001), and there was no significant difference in low-dose Xuefu Zhuyu Decoction (2.5 mg/mL) group.Xuefu Zhuyu Decoction can reduce colonic absorption of TMA, which provides the basis for the role of Xuefu Zhuyu Decoction in promoting blood circulation and removing blood stasis.
supramolecular sensing; Xuefu Zhuyu Decoction; indicator displacement assay; trimethylamine; everted intestinal sac
R285.5
A
0253 - 2670(2022)06 - 1783 - 07
10.7501/j.issn.0253-2670.2022.06.021
2021-11-12
国家自然科学基金资助项目(81873192)
王璐瑶(1997—),女,硕士,主要从事中药药效物质及质量控制研究。Tel: (022)59596366 E-mail: W1224967197@163.com
于卉娟(1988—),女,助理研究员,主要从事中药药效物质及质量控制研究。Tel: (022)59596366 E-mail: huijuanyu@tjutcm.edu.cn
[责任编辑 李亚楠]
