UPLC-MS/MS在蛋鸡中利巴韦林代谢研究中的应用
2022-03-19陈国许秀琴
陈国, 许秀琴
(宁波市农业科学研究院,浙江 宁波 315101)
利巴韦林又名病毒唑,是一种广谱抗病毒药物,在畜牧业和水产养殖业上有广泛的应用,主要用以预防和治疗病毒性疾病[1-2]。若不规范使用,致使动物体内残留,人类长期食用此类食品,导致体内利巴韦林残留过量,会产生一系列毒副作用,如遗传毒性、生殖毒性、致癌等[3-4]。本文以蛋鸡为研究对象,采用UPLC-MS/MS分析方法,开展鸡肉和鸡肝中利巴韦林及其代谢物残留消除规律研究,以期为禽产品质量安全风险评估和预警提供科学依据。
1 材料与方法
1.1 材料
主要仪器有液相色谱串联质谱联用仪(Water 2695 XevoTMTQ MS),电子天平(Sartorius Quintix 124),氮吹仪(美国Organomation N-EVAP 112),离心机(SIGMA 3K15),漩涡振荡器(IKA VORTEX GENIUS 3)。
主要试剂有乙腈(色谱纯)、甲醇(色谱纯)、甲酸(色谱纯),均购于美国Merck公司。利巴韦林标准品(99.9%纯,Dr.Ehrenstorfer公司),TCONH2标准品(99.9%纯,英国阿波罗科学有限公司),RTCOOH标准品(99.9%纯,美国USP标准品公司),13C5-利巴韦林标准品(99.9%纯,Dr.Ehrenstorfer公司),利巴韦林颗粒(每包50 mg,新博林)。
试验用蛋鸡84只,200 d龄,设置重复A、B 2组,光照、温度、饮水等条件遵照养殖场正常条件设定。
1.2 方法
1.2.1 试验动物给药方案
参照《兽药残留试验设计规范》,利巴韦林原药用无菌生理盐水配制成30 mg·mL-1的溶液,蛋鸡给药前禁食12 h,自由饮水,采用30 mg·kg-1的给药剂量连续用药7 d,分别于断药后4、8、12、24、48、60、72、120、240、480 h取样,每次随机抓取4只鸡取鸡胸肉、鸡肝,分别用样品袋装好,贴好标签,-18 ℃冷冻保存,待测。
1.2.2 样品的提取与净化
精确称取2.00 g样品于50 mL的离心管中,加入100 μL浓度为0.1 mg·L-1的13C5-利巴韦林内标工作液,涡旋均匀,放置0.5 h,加入1 mL超纯水提取,涡旋30 s,超声5 min。再加入9 mL的乙腈,涡旋30 s,超声5 min,涡旋10 s混匀,振荡15 min。9 000 r·min-1离心5 min,转移上清液3.0 mL于10 mL离心管中,待净化。
在提取液中加入40 mg Carbon和60 mg C18 ODS填料,涡旋1 min,5 000 r·min-1离心5 min,移取2.0 mL上清液于10 mL离心管中,40 ℃温度条件下吹干,准确加入1 mL 0.1%甲酸乙腈溶液复溶,涡旋30 s,超声5 min,过0.22 μm滤膜上机。
1.2.3 色谱和质谱条件
色谱柱:Agilent ZORBAX SB-Aq反相色谱柱,规格100 mm×3.0 mm,粒径1.8 μm。流动相:A相为0.1%甲酸水溶液,B相为甲醇溶液。采用梯度淋洗,流速0.3 mL·min-1,进样体积10 μL。流动相比例:0 min,A—99%,B—1%;2.5 min,A—99%,B—1%;4.0 min,A—85%,B—15%;5.0 min,A—10%,B—90%;5.1 min,A—99%,B—1%;8.0 min,A—99%,B—1%。
离子源为电喷雾正离子模式(ESI+);监测模式为多离子反应监测(MRM);电喷雾电压(IS)为3 700 V;离子源温度(TEM)为500 ℃;锥孔反吹气流量为25 L·h-1;脱溶剂气流量为1 000 L·h-1。质谱参数见表1。
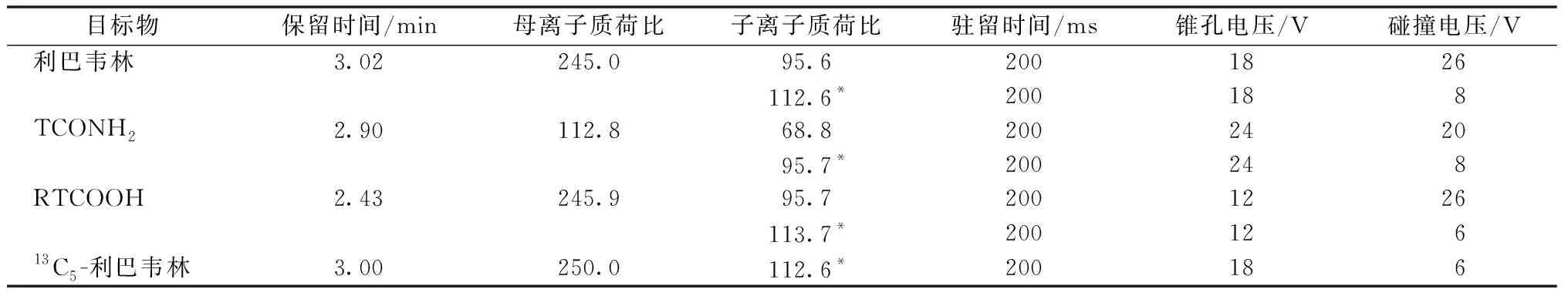
表1 质谱的参数
2 结果与分析
2.1 标准曲线
准确称取利巴韦林、RTCOOH、TCONH2标准品0.01 g于100 mL容量瓶中,用甲醇溶解并定容,配制成质量浓度为100 mg·L-1的混合标准储备液。采用内标法定量,将混合标准储备液依次用甲醇、鸡肉基质、鸡肝基质稀释配制成5.0、10.0、20.0、40.0、60.0 μg·L-1的系列标准工作溶液,以13C5-利巴韦林为内标,浓度为10.0 μg·L-1,进样分析,获得标准工作溶液曲线线性方程(表2),曲线的回归系数均大于0.998。从表中的斜率比发现,鸡肝的基质效应要比鸡肉强,即使采用内标法也不能很好地消除基质效应。因此,本试验中实际样品分析时采用基质标准曲线进行定量分析。

表2 标准曲线方程及斜率比
2.2 方法的灵敏度、准确度和精密度
在上述条件下,利巴韦林、RTCOOH、TCONH2在样品中定量限分别为0.005、0.02、0.01 μg·kg-1,灵敏度达到分析要求。取鸡肉、鸡肝空白样品进行回收率试验,添加水平分别为5.0、10.0、50.0 μg·L-1,每个浓度重复6次,内标法定量。3个水平添加下,在鸡肉和鸡肝中利巴韦林及代谢物回收率均在70%~99%,组内变异系数未超过10%(表3),表明LC-MS/MS检测方法具有较好的准确度和精密度。
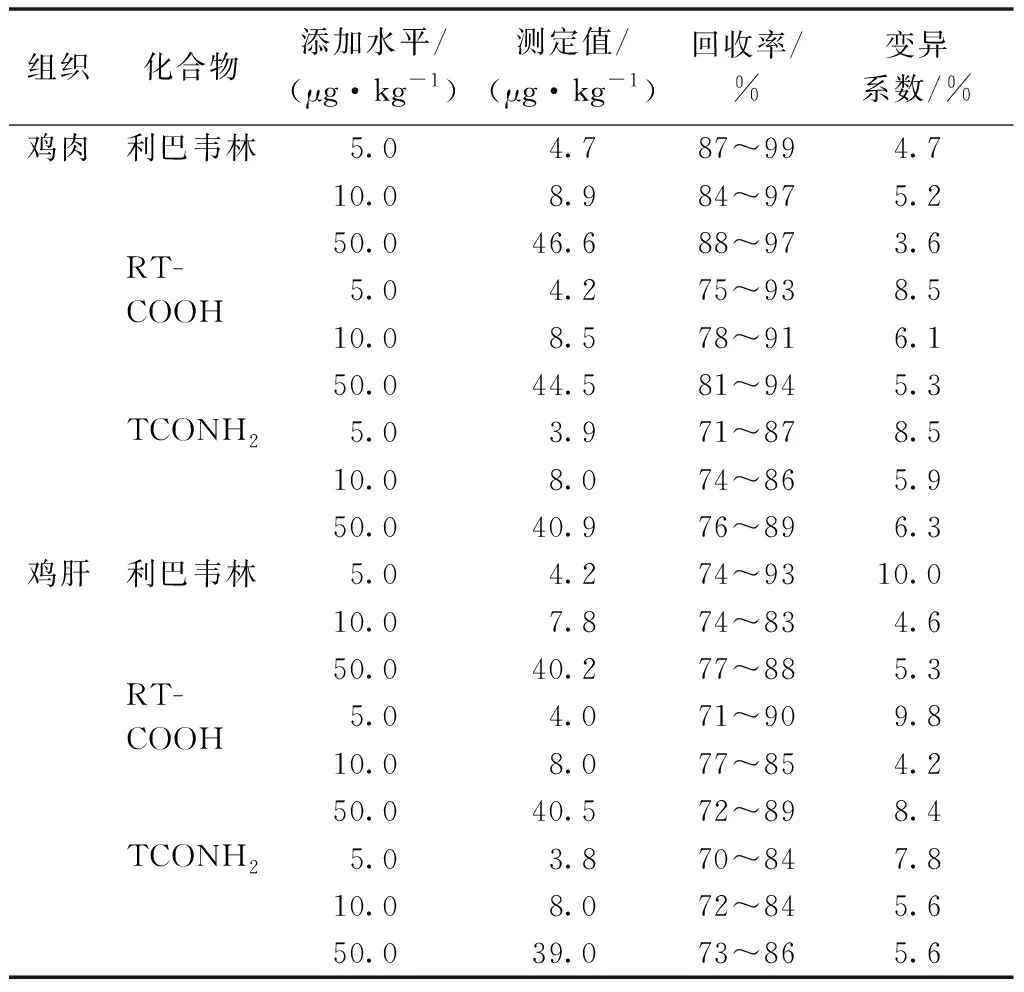
表3 利巴韦林及代谢物在蛋鸡组织中的添加回收率(n=6)
2.3 残留浓度和消除规律
2.3.1 鸡肝中利巴韦林及代谢物残留浓度及消除规律
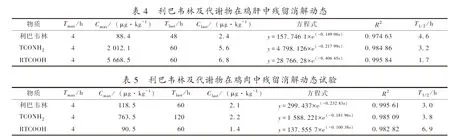
按照给药剂量30 mg·kg-1的标准,连续用药7 d后,鸡肝中利巴韦林及代谢物的残留消解结果见表4。蛋鸡经连续多次口服灌喂利巴韦林原药后,4 h时,原药残留含量为88.4 μg·kg-1,其代谢物TCONH2和RTCOOH的含量分别为2 012.1、5 668.5 μg·kg-1,相对其他时间,浓度均处于最高点。说明利巴韦林经口服灌喂后,在肝脏中迅速发生代谢行为,转化为TCONH2和RTCOOH代谢物。从4 h检测结果看,原药浓度显著低于代谢物浓度,也说明利巴韦林在蛋鸡体内没有产生富集作用,而是被转化为代谢物,主要以代谢物形式残留在体内。利巴韦林、TCONH2和RTCOOH在肝脏中残留最后检出点分别为48、60、60 h,也说明了利巴韦林在肝脏中被迅速转化的同时,也被迅速消除排出肝脏组织。在停药60 h后,原药及代谢物均被排出肝脏组织,转移到体内其他组织部位或排出体外。
2.3.2 鸡肉中利巴韦林及代谢物残留浓度及消除规律
鸡肉中利巴韦林及代谢物的残留消解结果见表5,3种物质在4 h时测得最大残留浓度,说明利巴韦林经口喂进入代谢器官,迅速发生代谢作用,原药和代谢物迅速扩散到全身组织。试验结果显示,鸡肉中利巴韦林代谢物残留时间较长,其中TCONH2的最后检出时间为120 h。3种物质在鸡肉中残留消除时间有较大差异,代谢物TCONH2前期在鸡肉中残留量大,残留时间长。
3 讨论
利巴韦林在鸡肝和鸡肉中残留消除试验中发现,在给蛋鸡灌喂30 mg·kg-1利巴韦林原药后,鸡肝中利巴韦林的Tmax为4 h,Cmax为88.4 μg·kg-1;TCONH2的Tmax为4 h,Cmax为2 012.1 μg·kg-1;RTCOOH的Tmax为4 h,Cmax为5 668.5 μg·kg-1;鸡肉中利巴韦林的Tmax为4 h,Cmax为118.5 μg·kg-1;TCONH2的Tmax为4 h,Cmax为763.5 μg·kg-1;RTCOOH的Tmax为4 h,Cmax为90.5 μg·kg-1。原药在鸡肝和鸡肉组织中残留的达峰浓度要低于代谢物TCONH2和RTCOOH。说明了代谢物TCONH2和RTCOOH是利巴韦林进入蛋鸡体内后的主要残留代谢物。
比较2种代谢物TCONH2和RTCOOH,在4 h时,鸡肝中浓度最高代谢物为RTCOOH(5 668.5 μg·kg-1),鸡肉中残留浓度最高代谢物为TCONH2(763.5 μg·kg-1),说明不同组织中代谢物的残留分布有组织差异性。RTCOOH在肝脏中起始浓度最高,半衰期为1.7 h,在短时间内消除干净,可能是肝脏作为机体中主要代谢器官,药物残留首先集中在肝脏,随着时间的推移,快速消除,对比鸡肉组织(半衰期为6.9 h),消除更为迅速。代谢物TCONH2在鸡肝中的Tlast为60 h,在鸡肉中的Tlast为120 h;代谢物RTCOOH在鸡肝中的Tlast为60 h,在鸡肉中的Tlast为60 h,比较而言,代谢物TCONH2在鸡肉中残留时间更长。
从试验结果看,不同组织中药物分布情况不同,鸡肝中代谢物RTCOOH的Cmax浓度高,代谢快;鸡肉中代谢物TCONH2的Cmax浓度高,残留时间长,Tlast为120 h。根据Tlast和药物分布特点,鸡肉可作为利巴韦林的监控靶组织,代谢物TCONH2为靶标物。
