纺织品霉变微生物的分离纯化与鉴定
2022-03-19陶娅妃张嫄周椿浩胡芸孙付保刘建立
陶娅妃 张嫄 周椿浩 胡芸 孙付保 刘建立


摘要: 为了确定霉变棉织物上霉变微生物的种类,文章采用PDA培养基划线分离纯化,从霉变棉织物上得到5种霉菌,然后采用真菌形态学和显微形态学进行了初步鉴定。结果表明,引起棉织物霉变的微生物主要为曲霉属霉菌、青霉属霉菌和根霉属霉菌,其中曲霉属占比60 % ,为棉织物致霉的优势菌属。通过对纯化后的霉菌进行18S rDNA-ITS序列分析,并在NCBI核酸序列数据库里比较序列同源性,鉴定为5个种,分别为谢瓦式曲霉、指状青霉、聚曲多霉、米根霉和黑曲霉。文章利用形态学方法结合ITS序列分析鉴定霉菌种类,使得获取结果更加快速和精准,为纺织品防霉基础研究与抗霉材料研发提供参考。
关键词: 棉织物;霉菌;形态学;序列分析;纯化与鉴定
中图分类号: TS117.6
文献标志码: A
文章编号: 1001 7003(2022)03 0040 05
引用页码: 031106
DOI: 10.3969/j.issn.1001-7003.2022.03.006 (篇序)
在日常生活中,服装不可避免地要接触各种各样的细菌和真菌,微生物污染是导致服装损坏的主要原因之一。纺织材料属于多孔材料,具有表面积大、孔隙多等特点,使其更容易吸附微生物 [1] 。人体分泌的代谢物,如汗液、皮脂为微生物提供了营养源,使得微生物能够迅速繁殖和生长 [2-3] 。因此,服装在日常生活环境中很容易被空气中的微生物所污染,在多雨潮湿的气候里,则更容易滋生霉菌。霉菌能够将含有碳、硫等营养源的棉、毛和丝纤维分解为养分,促进其快速繁殖和生长。同时,霉菌在生长过程中会分泌有机酸和色素对纺织品造成酸蚀和颜色污染,影响其机械性能和美观,缩短了纺织品的使用寿命 [4] 。
纺织品上的微生物包括细菌和真菌,目前纺织品抗菌主要针对的是细菌,对于纺织品抗真菌的研究较少,而真菌是纺织品生物降解过程中最重要的微生物 [5-6] 。纺织品上霉菌菌种的鉴定一直基于形态学特征,包括宏观和微观,只能鉴定到霉菌属,这些方法通常耗时且不准确。本文利用形态学方法结合ITS序列分析鉴定霉菌种类,可鉴定到霉菌菌种,使得获取结果更加快速和精准。织物表面的霉菌与空气中的霉菌真菌种类密切相关,织物霉变是空气中的霉菌对织物基质选择的结果。方治国等 [7] 对城市室内外空气真菌群落的研究表明,空气中优势真菌为枝孢属、链格孢属、青霉属、曲霉属和无孢菌等;杨靖 [8] 对徐州市城区不同季节、昼夜24 h空气中霉菌群落组成变化和分布特点进行了研究,观察到曲霉属和青霉属为优势霉菌群落。本次分离出的霉菌菌属均属于文献[7-8]报道的空气真菌,优势菌属与空气中优势真菌菌属也基本一致。唐欢等 [9] 从馆藏纸质书画文物上分离出8株分属于曲霉属、根霉属和木霉属的霉菌; 宋贤冲等 [10] 从广西南宁霉变的纤维板上分离出茨木霉、深绿木霉和孢脉孢霉;唐长波等 [11] 从污染丝绸织物中分离出根霉属、曲霉属和拟青霉属霉菌,不同基质和环境条件下分离出的霉菌存在差异。因此,需要鉴定污染纺织品上的微生物种类,并针对这些微生物的生理生化特征,采取相应的物理、化学方法抑制其在织物表面的生长,以保护纺织品,延长其使用寿命。本文从霉变棉织物上提取霉菌,并在PDA培养基上划线分离纯化,得到了单一的菌株,再采用显微形态学观察与ITS序列分析相结合的方法对霉变微生物进行鉴定,确定了棉织物致霉优势菌属,然后可根据其生长规律和生理生化特性,开发相应的防霉试剂。
1 实 验
1.1 材料与设备
1.1.1 材 料
霉变织物:以肉眼可见的霉变为标准,于江苏省无锡市江南大学纺织科学与工程学院D区实验室中采集的霉变棉织物(平纹,18.5 tex×18.5 tex,510根/10 cm×275根/10 cm, 148 g/m 2 ;中恒大耀纺织科技有限公司)。
PBS缓冲液:5.155 2 g Na 2HPO 4·12H 2O,0.876 3 g NaH 2PO 4·2H 2O(中国医药集团有限公司),1 000 mL蒸 馏水。
PDA培养基:40.1 g马铃薯葡萄糖琼脂培养基干粉(中国医药集团有限公司),1 000 mL蒸馏水,加热溶解 [12] 。
上述培养基及试剂均采用121 ℃高压蒸汽灭菌20 min,用于分离鉴定霉变棉织物上的霉菌。使用乳酸石炭酸棉蓝(福州飞净生物科技有限公司)给霉菌染色并观察其微观 形态。
1.1.2 设 备
DZF-6050型真空干燥箱、BSD-YF2200型立式双层精密摇床、YXQ-LS-75G型立式压力蒸汽灭菌锅(上海博讯实业有限公司),NU-425-400S型生物安全柜(美国Nuaire公司)、 MJ-1608-Ⅱ型 霉菌培养箱(上海跃进医疗器械有限公司)、VHX-5000超景深三维数码显微镜(基恩士公司)。
1.2 方 法
1.2.1 霉变微生物的分离纯化
参照GB 4789.15—2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》中霉菌分離纯化的方法。称取霉变棉织物10 g,置于90 mL PBS溶液中,(28±2) ℃、180 r/min条件下于摇床震荡培养24 h制成1 ︰ 10菌液,依次稀释10倍梯度,共稀释6个梯度。各梯度均吸取1 mL菌液,并用无菌玻璃棒均匀涂布在PDA培养基上,(28±2) ℃、85 % RH条件下于霉菌培养箱中倒置培养5 d。从平板上长出的菌落中挑取少量菌丝,划线接种于PDA培养基上,相同条件下继续培养5~7 d。根据菌落的形态、大小及颜色,挑选不同的单菌落接种于PDA培养基中纯化3次,得到形态单一的菌落,最后接种试管斜面,于4 ℃冰箱保存备用。
1.2.2 菌落形态观察
利用无菌接种针挑取少量纯化后的菌落菌丝,在PDA培养基平板中间点植接种。将其在(28±2) ℃、85 % RH条件下置于霉菌培养箱中倒置培养5 d,观察菌落的生长情况和形态特征,并用佳能700D相机拍照,根据《真菌鉴定手册》 [13] 进行初步鉴定。
1.2.3 显微镜形态观察
采用透明胶带镜检法 [14] 。吸取适量乳酸石炭酸棉蓝染液于载玻片,用无菌镊子夹住胶带两端,使透明胶带呈U字形,保持胶面朝下触碰菌落表面,将粘有菌丝体的部分浸入载玻片上的染色液中,在超景深三维数码显微镜下观察霉菌的菌丝形态和孢子形状。
1.2.4 PCR扩增及测序
霉菌属于真菌微生物,因此本文选用引物ITSl(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCG CTTATTGATATGC-3′) [9-10,15] 进行ITS片段扩增。其中PCR反应体系为 50 μL ,共包含35.5 μL水,1 μL模板引物,1 μL引物ITS1, 1 μL引 物ITS4,1 μL dNTP 10 mM,5 μL Taq Buffer,5 μL MgCl 2 25 mM,0.5 μL Taq酶5 U/μL。PCR反应条件设置:在95 ℃时预变性3 min,94 ℃时变性20 s,50~60 ℃时退火 20 s,72 ℃时 延伸20~50 s,总共循环35次,在72 ℃时修复延伸5 min。得到的PCR扩增产物在150 V、100 mA条件下用1 % 琼脂糖进行20 min电泳。天霖生物科技(上海)有限公司对样品进行序列测定。
1.2.5 序列分析
将序列结果输入NCBI的核酸序列数据库,使用在线序列比对搜索工具BLAST进行同源性比对分析,选取与比对菌株序列同源性超过99 % 且已知分类地位的真菌菌株 [16-17] ,确定霉菌种名。使用MEGA7.0软件构建系统进化树,通过Neighbor- Joining进行聚类计算,使用Bootstrap检验系统进化树的分枝可信度,自举检验次数为1 000 [10] 。
2 结果与分析
2.1 形态学分析
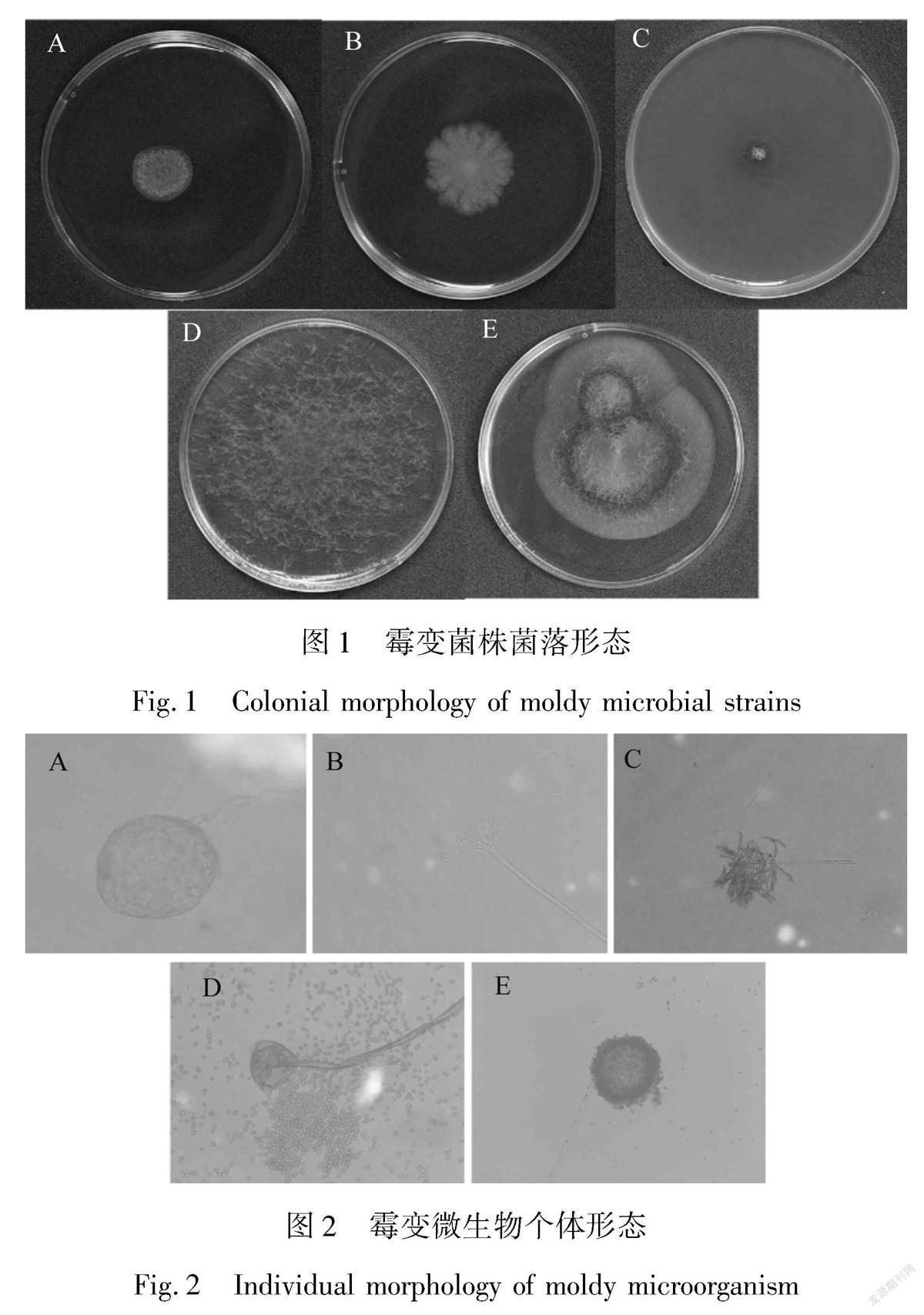
在PDA培养基上对霉变棉织物中的微生物进行划线分离与纯化,观察霉菌菌落的生长状况、表面高度、菌落边缘形状和菌落颜色等,并在超景深显微镜的不同放大倍数下观察霉变微生物的菌丝有无横隔,分生孢子的形状、分生孢子梗和顶囊等个体形状 [14] ,初步确定为5种霉菌,依次编号为A、B、C、D和E。(28±2) ℃、85 % RH条件下,将5种霉菌接种到PDA培养基上进行培养,观察霉菌的生长情况。A霉菌生长初期无色,4~5 d后菌落慢慢变成黄色。B霉菌生长初期为白色,生长过程中菌落颜色逐渐变灰,成熟后呈灰绿色。C霉菌在生长过程中产生大量渗透液,使得培养基呈浅褐色,与其他培养基差异比较明显。D霉菌在PDA培养基上迅速繁殖生长,48 h后出现白色的直立菌丝,生长后期菌丝顶端长出圆形的黑色孢子。E菌落在培养基上快速蔓延生长,气生菌丝呈厚绒状,表面生成黑色的孢子。5种霉变微生物菌落形态、个体形态描述及初步鉴定结果如表1所示。
5种霉菌生长7 d后的菌落形态如图1所示,霉菌个体形态(×1 000倍)如图2所示。通过对菌落形态和微生物个体形态的分析,初步鉴定菌种A、C和E为曲霉属霉菌,B为青霉属霉菌,D为根霉属霉菌。由形态学鉴定结果可知,曲霉属真菌为3株,占比60 % ,为棉织物致霉的优势菌属。
2.2 18S rDNA-ITS序列分析鉴定
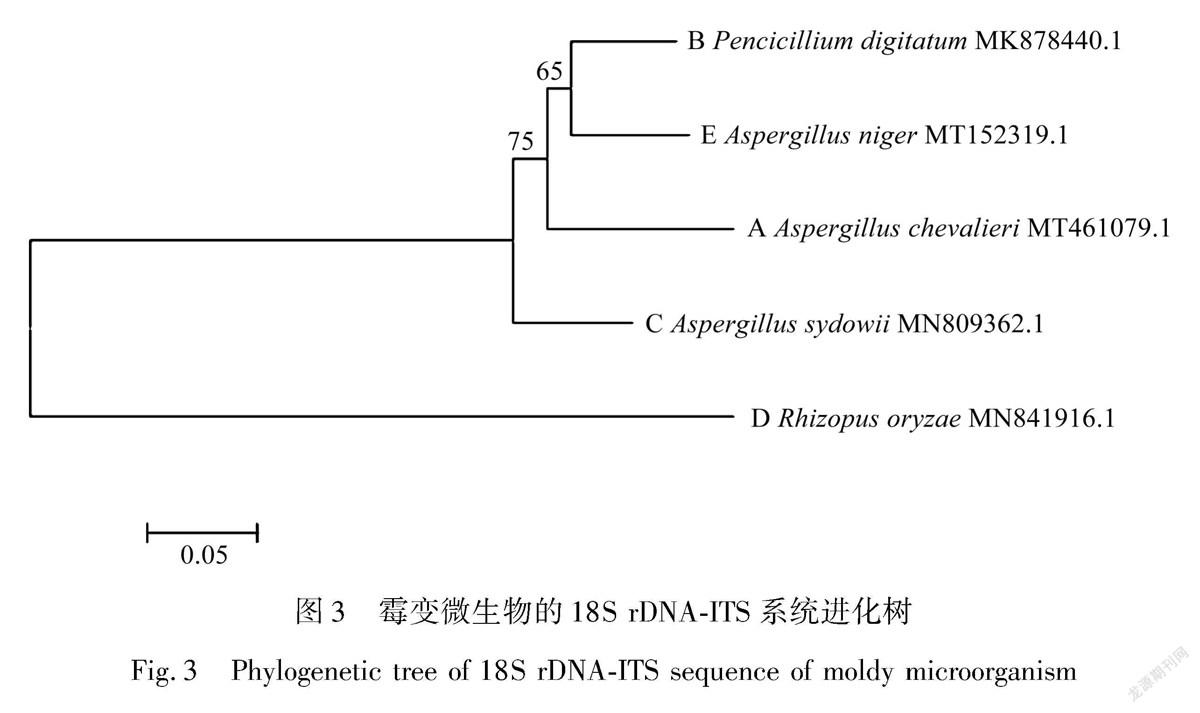
根据天霖生物科技(上海)有限公司的测序结果,将得到的序列按照1.2.5的方法进行比对分析鉴定霉菌微生物种类,鉴定结果如表2所示,提交序列与数据库中参照序列的同源性大于99 % ,可视为同一种 [16] 。因此,A、B、C、D、E分别为谢瓦式曲霉、指状青霉、聚曲多霉、米根霉和黑曲霉。
在MEGA7.0中构建5种霉菌18S rDNA-ITS序列的系统进化树,采用1.2.5中的方法进行距离分析,并检验其可信度,来评估系统进化树的分枝可信度。由图3可知,系统进化树的自展值均超过50,表明构建的系统进化树可信。5种霉变微生物的ITS序列聚类出3个分支,分别为青霉属、曲霉属和根霉属,同种属的霉菌进化关系近,获得较高的支持率,合并在同一分支。
3 结 论
本文采用PDA培养基划线分离纯化霉变棉织物上的霉菌,并利用形态学方法和ITS序列分析完成棉织物致霉优势菌属的鉴别,该方法具有可行性,能为纺织品致霉微生物的鉴定提供参考。分离纯化的霉菌通过单菌落形态特征初步鉴定出5种霉变微生物,其中3种霉菌属于曲霉属霉菌,1种属于青霉属霉菌,1种属于根霉属霉菌, 曲霉属霉菌占比60 % ,为棉织物致霉的优势菌属。本文通过序列分析和同源性比较鉴定为5个种,分别为谢瓦式曲霉、指状青霉、聚曲多霉、米根霉和黑曲霉。根据纺织品上微生物种类及其生理生化特征,可选择合适的存储环境和防霉整理剂,从而抑制霉菌生长,延长纺织品的使用寿命。
参考文献:
[1] 羅燕, 杨俊枝. 羊绒针织品抗菌功能整理[J]. 毛纺科技, 2010, 38(10): 18-20.
LUO Yan, YANG Junzhi. Antibacterial functional finishing for cashmere knitwear[J]. Wool Textile Journal, 2010, 38(10): 18-20.
[2] 崔乐, 贾焱, 成志伟, 等. 维持皮肤屏障研究进展: 脂质的分泌及组成[J]. 中国皮肤性病学杂志, 2016, 30(6): 640-643.
CUI Le, JIA Yan, CHENG Zhiwei, et al. Advancement in maintaining skin barrier-secretion and composition of lipid[J]. The Chinese Journal of Dermatovenereology, 2016, 30(6): 640-643.
[3]KRIFA M, RAJAGANESH S, FAHY W. Perspectives on textile cleanliness: Detecting human sebum residues on worn clothing[J]. Textile Research Journal, 2019, 89(23/24): 5226-5237.
[4] 路智勇, 惠任. 紡织品文物霉害预防性控制[J]. 四川文物, 2009(3): 89-92.
LOU Zhiyong, HUI Ren. Preventive control of mildew damage on textile cultural relics[J]. Sichuan Cultural Relics, 2009(3): 89-92.
[5]JADWIGA S K. Biodeterioration of textiles[J]. International Biodeterioration & Biodegradation, 2004, 53: 165-170.
[6]SANDERS D, GRUNDEN A, DUNN R R. A review of clothing microbiology: The history of clothing and the role of microbes in textiles[J]. Biology Letters, 2020, 17(1): 1-4.
[7] 方治国, 欧阳志云. 城市室内外空气真菌群落及影响因素研究进展[J]. 生态环境学报, 2009, 18(1): 386-393.
FANG Zhiguo, OUYANG Zhiyun. Advance of airborne fungal community and the influencing factors in indoor and outdoor environments in urban ecosystem[J]. Ecology and Environment, 2009, 18(1): 386-393.
[8] 杨靖. 徐州城市空气中霉菌群落分布规律及结构组成差异性研究[J]. 环境与发展, 2016, 28(5): 56-58.
YANG Jing. In the air of Xuzhou city mold community distribution and structural composition diversity research[J]. Inner Mongolia Environmental Sciences, 2016, 28(5): 56-58.
[9] 唐欢, 王春, 范文奇, 等. 馆藏纸质书画文物上霉菌的分离与鉴定[J]. 文物保护与考古科学, 2015(2): 40-46.
TANG Huan, WANG Chun, FAN Wenqi, et al. Isolation and identification of molds from ancient Chinese calligraphy and paintings in museums[J]. Sciences of Conservation and Archaeology, 2015(2): 40-46.
[10] 宋贤冲, 张照远, 刘媛, 等. 广西南宁纤维板霉变微生物的分离及鉴定[J]. 林业工程学报, 2016, 1(1): 78-82.
SONG Xianchong, ZHANG Zhaoyuan, LIU Yuan, et al. Isolation and identification of microorganisms causing mildew of fiberboard in Nanning, Guangxi[J]. China Forestry Science and Technology, 2016, 1(1): 78-82.
[11] 唐长波, 李世超. 污染的丝绸织物中霉菌的分离与鉴定[J]. 安徽农学通报, 2009, 15(17): 28-29.
TANG Changbo, LI Shichao. Separation and identification of mould from silk fabrics contaminated by microorganisms[J]. Anhui Agricultural Science Bulletin, 2009, 15(17): 28-29.
[12] 王志惠. 纺织品抗真菌性能评价方法的研究与改进[D]. 上海: 东华大学, 2015.
WANG Zhihui. Research and Improvement of Evaluation Methods on Antifungal Activity of Textile[D]. Shanghai: Donghua University, 2015.
[13] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
WEI Jingchao. Fungal Identification Manual[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1979.
[14] 冯长海. 改良透明胶带法在丝状真菌形态观察中的應用[J]. 临床检验杂志, 2017, 35(10): 32-33.
FENG Changhai. Application of a modified transparent tape method to the observation of filamentous fungi morphology[J]. Chinese Journal of Clinical Laboratory Science, 2017, 35(10): 32-33.
[15] 雷声, 杨乾栩, 师艳萍, 等. 成品卷烟霉变微生物的分离纯化与鉴定[J]. 食品与机械, 2019, 35(9): 98-101.
LEI Sheng, YANG Qianxu, SHI Yanping, et al. Isolation, purification and identification of microorganisms in moldy cigarettes products[J]. Food & Machinery, 2019, 35(9): 98-101.
[16] 樊壬水, 何贤蓉, 叶伟, 等. 纤维板霉变微生物的分离鉴定及生长抑制方法[J]. 林业工程学报, 2020, 5(5): 84-89.
FAN Renshui, HE Xianrong, YE Wei, et al. Isolation, identification and growth inhibition of microorganisms mildew of fiberboard[J]. China Forestry Science and Technology, 2020, 5(5): 84-89.
[17]LANDEWEERT R, LEEFLANG P, KUYPER TW, el al. Molecular identification of ectomycorrhizal mycelium in soil horizons[J]. Applied and Environmental Microbiol, 2003, 69(1): 327-333.
Isolation, purification and identification of moldy microorganisms on textiles
TAO Yafei 1a , ZHANG Yuan 2, ZHOU Chunhao 2, HU Yun 1b , SUN Fubao 1b , LIU Jianli 1a
(1a.College of Textile Science and Engineering; 1b.School of Biotechnology, Jiangnan University, Wuxi 214122, China; 2.Wuxi Little Swan Electric Co., Ltd., Wuxi 214122, China)
Abstract:
During the wearing process, clothing will be contaminated by microorganisms from the human skin together with sebaceous lipids, sweat, and dead skin cells, which serve as a source of microbial nutrition. Therefore, clothing is easily contaminated by microorganisms in the air in the environment of daily life and is prone to mildew in warm and humid climate. The invasion of microbes in textile materials is mainly due to the presence of fungi. The growth of mildew on textiles has a series of effects not only on the textile itself but also on the wearer because mildew can secrete enzymes to decompose cotton, wool, and silk containing carbon, sulfur, and other nutrient sources into nutrients to promote their rapid reproduction and growth. At the same time, the mold will secrete organic acids and pigments during the growth process, causing acid corrosion and discoloration to the textiles, affecting their mechanical properties and aesthetics, and shortening the service life of the textiles. Therefore, it is necessary to identify the kinds of mildew on textiles, and adopt corresponding physical and chemical methods to inhibit their growth on the surface of the fabric according to the physiological and biochemical characteristics of these microorganisms, protect the textiles, and extend their service life.
In this experiment, mildew microorganisms were extracted from moldy cotton fabrics. Then, they were separated and purified by streaking on the PDA culture medium suitable for mildew growth, and a single bacterial strain was obtained. Microbial morphology was used for preliminary identification, and the gene sequencing identification of mildew microorganisms was completed through ITS sequence analysis. The moldy cotton fabric was collected from the real environment, and the mold-causing microorganisms were isolated and purified from the above. The mildew was identified through microbial morphology and ITS sequence analysis, and the species of mildew and the dominant fungi causing the mildew of cotton fabric were determined, providing a scientific basis for preventing mildew and inhibiting the growth of mildew. Among the isolated and purified mildew, five moldy microorganisms were initially identified based on the morphological characteristics of a single colony, in which three (60 % ) belonged to the genus Aspergillus , one belonged to the genus Penicillium , and one belonged to the genus Rhizopus . Aspergillus is the dominant genus of mildew-causing cotton fabrics. Five species were identified by sequence analysis and homology comparison, namely, Aspergillus chevalieri , Penicillium digitatum , Aspergillus sydowii , Rhizopus oryzae , and Aspergillus niger .
Clarifying the types of microorganisms that cause mildew in textiles can help people to choose suitable storage environment and anti-mold finishing agent in accordance with their physiological and biochemical characteristics, so as to inhibit mildew growth and prolong the service life of textiles.
Key words:
cotton fabric; mildew; morphology; sequence analysis; purification and identification
3162501186558
