毛柳苷在缺血性脑损伤中对白介素4诱导蛋白1表达和小胶质细胞激活及表型的影响
2022-03-18刘文倩赵顺英叶维贞姜鸣钰陈文涛陈青芳温少红董雯刘向荣
刘文倩,赵顺英,叶维贞,姜鸣钰,陈文涛,陈青芳,温少红,董雯,刘向荣
我国面临着严重的卒中负担,卒中在所有死亡原因中位列第三,其中缺血性卒中占所有卒中的64.9%[1]。及时有效的治疗能减少缺血性卒中的复发、致残及死亡不良结局[2-3]。毛柳苷也称红景天苷,是我国传统中药红景天的提取物,也是其主要的药效成分。红景天具有益气活血的功效,可用于卒中后偏瘫的治疗。近年来的研究及本课题组的前期研究均发现,毛柳苷在缺血性脑损伤后可能通过抑制氧化应激、反应性胶质增生、调控小胶质细胞极化等机制发挥神经保护作用[4-5],但其作用详细的分子机制尚不十分清楚。
白介素4诱导蛋白1(interleukin-4 induced protein 1,IL4I1)是在IL-4的诱导下产生的一种氨基酸氧化酶,可将苯丙氨酸氧化为苯丙酮酸,该反应同时释放氨和过氧化氢[6]。IL4I1作为免疫调节蛋白参与机体免疫应答的过程[7]。针对多发性硬化的研究发现,IL4I1可调节小胶质细胞极化并促进神经髓鞘再生[8]。由此推测毛柳苷可能通过影响IL4I1的表达,进而调节脑缺血再灌注后小胶质细胞的激活和炎症表型变化,从而发挥神经保护作用。
1 对象与方法
1.1 实验对象及药物 ①实验动物:选取8~12周C57BL/6J雄性小鼠38只,体质量20.0±0.5 g(北京华阜康生物科技控股有限公司)。本实验遵照动物伦理相关要求进行,实验小鼠饲养于22~26 ℃,相对湿度50%~60%,12 h循环照明的环境中,自由摄食水。②小胶质细胞:BV2小鼠小胶质细胞(中国医学科学院基础医学研究所细胞资源中心)复苏后,培养于含10%胎牛血清(HyClone,美国)的基础培养基(HyClone,美国)中。③实验药物:毛柳苷粉末(Sigma,美国)按1 mg/mL溶解于生理盐水后备用。
1.2 模型制作与药物注射 小鼠随机分为3组:假手术组4只、脑缺血再灌注后注射毛柳苷组(简称毛柳苷组)17只、脑缺血再灌注后注射生理盐水组(简称生理盐水组)17只。
模型制作:小鼠经异氟烷麻醉,仰卧位,分离颈总动脉起始段,通过颈内动脉插入线栓至大脑中动脉,60 min后拔栓以恢复血流实现再灌注,逐层缝合皮肤。手术期间使用保温垫,监测小鼠肛温,保持在37.0±0.5 ℃。激光散斑仪(瑞沃德,中国)检测缺血前基线、缺血后60 min的脑血流,缺血后60 min脑血流低于基线水平的30%为模型成功。脑缺血再灌注后10 min,毛柳苷组与生理盐水组小鼠分别经尾静脉按照10 mg/kg注射毛柳苷与生理盐水,每天1次,持续28 d。
1.3 血清IL4I1浓度检测
1.3.1 血清制备 采集假手术组及缺血再灌注(毛柳苷组和生理盐水组)后48 h、7 d、28 d血清,其中假手术组4只,缺血再灌注28 d时每组各5只,其余时间点每组各4只。使用10%水合氯醛麻醉小鼠,通过摘眼球法获取全血,静置2 h后,在常温下以4000 r/min离心15 min,取上清液即为血清。
1.3.2 ELISA法检测血清IL4I1浓度 使用ELISA试剂盒(MyBioSource,美国)检测小鼠血清中IL4I1的浓度。设置2个复孔,每孔加入40 μL血清、10 μL IL4I1抗体与50 μL辣根过氧化物酶标记生物素,37 ℃下避光反应60 min,清洗96孔板5次,先后加入底物溶液A与B各50 μL,37 ℃下避光反应10 min,加入50 μL终止液,10 min内在450 nm检测光密度值,绘制标准曲线,计算各样本的IL4I1浓度。
1.4 脑梗死体积测定 取毛柳苷组与生理盐水组小鼠各4只,缺血再灌注后7 d取脑并进行冰冻切片6层,使用神经元特异核蛋白抗体(neuronal nuclei,NeuN)抗体,(Millipore,美国)进行免疫荧光染色标记6个层面的神经元,以确定梗死体积。通过Vectra Polaris全自动成像系统(Perkin-Elmer,美国)拍摄荧光图片。使用Image J软件统计不同层面的脑梗死体积,梗死体积=各层健侧脑组织体积之和-各层损伤侧正常脑组织体积之和。
1.5 小胶质细胞三维形态及突起长度和数量分析 取生理盐水组与毛柳苷组小鼠各4只,缺血再灌注后7 d脑组织冰冻切片,进行离子化钙结合适配分子1(ionized calcium binding adapter molecule 1,Iba1)荧光染色标记损伤区周围小胶质细胞。使用LSM710激光共聚焦显微镜Z-stack拍摄小胶质细胞3D图像,并通过Imaris 9.0.1软件Filament插件计算小胶质细胞的突起长度、突起数量、突起的分叉点数量及突起的终末端点数量。
1.6 免疫组织荧光染色 取毛柳苷组与生理盐水组缺血再灌注后7 d的脑组织冰冻切片,每组各4只小鼠,进行Iba1(和光纯药,日本)和CD16/32(BD Pharmingen,美国)及Iba1和CD206(R&D Systems,美国)免疫荧光共染,分别标记损伤区M1和M2型小胶质细胞。使用LSM710激光共聚焦显微镜(Carl Zeiss AG,德国)拍摄Iba1分别与CD16及CD206共定位图像,Image J软件统计M1、M2型小胶质细胞的数量。
1.7 BV2小胶质细胞不同表型IL4I1表达测定
1.7.1 BV2小胶质细胞培养与表型诱导 设置空白对照组为M0型小胶质细胞,使用脂多糖(lipopolysaccharide,LPS)(10 μg/mL,Sigma,美国)和INF-γ(10 μg/mL,Peprotech,美国)诱导BV2小胶质细胞极化为M1型小胶质细胞;使用IL-4(10 μg/mL)(Peprotech,美国)和IL-13(10 μg/mL)(Peprotech,美国)诱导BV2小胶质细胞极化为M2型小胶质细胞。
1.7.2 BV2小胶质细胞蛋白提取 收集M0型及诱导48 h后的M1型和M2型细胞,每107细胞使用500 μL放射免疫沉淀法缓冲液(radio immunoprecipitation assay buffer,RIPA)蛋白裂解液(索莱宝,中国)提取小胶质细胞蛋白,4 ℃,12 000 r/min离心20 min,取上清即为细胞蛋白裂解液。
1.7.3 蛋白印迹测定BV2小胶质细胞IL4I1表达使用10%的十二烷基磺酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfonate-polyacrylamide gel electrophoresis,SDS-PAGE)进行电泳(每孔40 μg蛋白),后转移到聚偏二氟乙烯膜(polyvinylidene,PVDF)。使用含0.1%吐温20和5%胎牛血清白蛋白的Tris缓冲液室温封闭膜60 min,兔来源抗鼠IL4I1抗体(博奥森,中国)、鼠来源抗鼠β-Actin抗体(景杰生物科技有限公司,中国)4 ℃孵育过夜,辣根过氧化物酶耦联抗兔、抗鼠二抗(CST,美国)室温孵育1 h,使用化学发光试剂盒(Abcam,英国)通过G:BOX化学发光成像系统(Syngene,英国)检测蛋白条带,并使用Image J分析图像计算IL4I1相对表达量。
1.8 统计方法 使用GraphPad Prism 8.0.2软件进行统计分析,计量资料符合正态分布,用表示,单时间点两组比较采用独立t检验;单时间点多组比较采用单因素方差分析,在整体差异有统计学意义的情况下进行Tukey检验两两比较;多时间点多组比较采用双因素方差分析,在整体差异有统计学意义的情况下进行Bonferroni法两两比较。以P<0.05为差异具有统计学意义。
2 结果
2.1 脑缺血再灌注后血清IL4I1的表达 生理盐水组脑缺血再灌注后48 h、7 d、28 d与假手术组相比血清中IL4I1浓度整体差异具有统计学意义(P=0.0235)。两两比较发现,与假手术组相比,生理盐水组脑缺血再灌注后48 h血清中IL4I1浓度降低(P=0.0302);生理盐水组脑缺血再灌注后7 d和28 d较48 h血清中IL4I1浓度有升高趋势,但差异不具有统计学意义(P=0.8160,P=0.2874)。毛柳苷组与生理盐水组脑缺血再灌注后48 h、7 d、28 d血清中IL4I1浓度整体差异有统计学意义(P<0.0001),两两比较发现两组脑缺血再灌注后48 h血清中IL4I1浓度无差异(P=0.1581),毛柳苷组脑缺血再灌注后7 d和28 d血清中IL4I1浓度较生理盐水组升高(P=0.0229,P=0.0076)。上述结果提示毛柳苷能促进小鼠缺血性脑损伤后早期及恢复期血清中IL4I1的表达(表1)。

表1 缺血再灌注后不同时间点不同组小鼠血清IL4I1浓度比较[单位:ng/L]
2.2 脑缺血再灌注后7 d脑梗死体积 NueN免疫荧光染色结果显示,脑缺血再灌注后7 d毛柳苷组小鼠脑梗死体积显著低于生理盐水组脑梗死体积(16.47±5.44 mm3vs.30.20±8.90 mm3,P=0.0389),表明毛柳苷可降低小鼠缺血再灌注后的脑梗死体积(图1)。

图1 生理盐水组和毛柳苷组小鼠缺血再灌注后7 d脑梗死体积比较
2.3 脑缺血再灌注后7 d小胶质细胞三维形态及突起变化 图2显示了脑缺血再灌注后7 d小鼠脑损伤区周围小胶质细胞的三维形态。与生理盐水组相比,毛柳苷组小胶质细胞的突起长度更长(110.60±24.93 μmvs. 95.64±27.65 μm,P=0.0040),单个小胶质细胞突起数量更多(104.60±60.21个vs. 50.58±33.47个,P<0.001),单个小胶质细胞突起的分叉点数量(53.43±33.99个vs. 24.83±16.41个,P<0.001)和终末端点数量(56.03±35.20个vs. 26.85±17.12个,P<0.001)均增多。结果提示毛柳苷可促进小鼠缺血性脑损伤后小胶质细胞的进一步活化,促进突起伸长,增加突起分支(图3)。
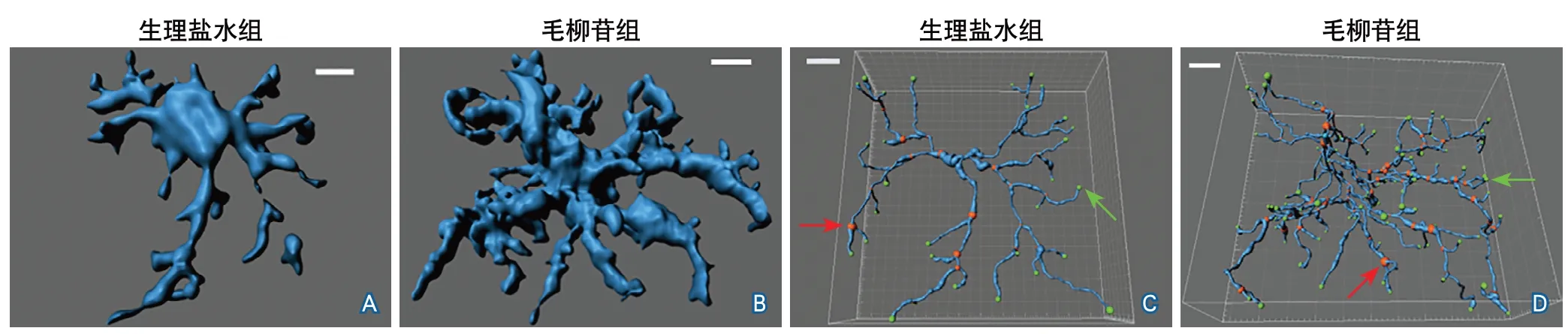
图2 生理盐水组和毛柳苷组缺血再灌注后7 d脑组织小胶质细胞三维形态

图3 生理盐水组和毛柳苷组缺血再灌注后7 d脑组织小胶质细胞突起长度与数量变化

2.4 脑缺血再灌注后小胶质细胞极化状态 Iba1+CD16/32+标记损伤区域周围M1型小胶质细胞,Iba1+CD206+标记M2型小胶质细胞。统计皮层与纹状体区域小胶质细胞总数量、M1型与M2型小胶质细胞数量,结果显示毛柳苷组与生理盐水组脑缺血再灌注后7 d皮层及纹状体区域小胶质细胞总数差异无统计学意义。与生理盐水组相比,毛柳苷组脑缺血再灌注后7 d梗死区域周围皮层及纹状体的M1型小胶质细胞数量减少(皮层:P=0.0407,纹状体:P=0.0032),M2型小胶质细胞数量显著增多(皮层:P=0.0206,纹状体:P=0.0075)(表2)。上述结果提示毛柳苷可促进小鼠缺血性脑损伤后小胶质细胞向M2型抗炎表型小胶质细胞极化(图4)。

图4 生理盐水组和毛柳苷组缺血再灌注后7 d脑组织小胶质细胞极化状态

表2 生理盐水组和毛柳苷组缺血再灌注后7 d脑组织小胶质细胞不同表型数量[单位:个/mm2]
2.5 BV2小胶质细胞不同极化表型IL4I1的表达水平 检测BV2小胶细胞不同表型(M0、M1、M2)中IL4I1的表达情况。结果显示,三种表型的小胶质细胞IL4I1的表达差异整体具有统计学差异(P=0.001)。与M0型相比,M1型与M2型BV2小胶质细胞IL4I1表达均下降(P=0.0008,P=0.0155),M1型与M2型相比IL4I1表达下降(P=0.0406)。表明小胶质细胞在激活状态下降低IL4I1表达,M1型比M2型下降更多(图5)。

图5 BV2小胶质细胞不同极化状态下IL4I1表达情况
3 讨论
急性缺血性卒中是致残率较高的疾病,脑组织损伤后由于氧化应激、兴奋性毒性作用导致神经细胞死亡,造成感觉、运动神经功能损伤[9-10],因此脑缺血后进行神经保护治疗尤为重要。在本课题组前期的研究中,发现毛柳苷可通过调节小鼠脑缺血再灌注后14 d小胶质细胞极化促进少突胶质细胞分化及有髓神经纤维髓鞘的再生,从而保护神经功能,减少小鼠脑缺血后的认知功能障碍[4]。但前期实验对毛柳苷是否影响缺血早期的脑组织损伤范围并没有进行分析,本实验发现,在脑缺血损伤早期,毛柳苷可减少脑梗死体积。
IL4I1参与机体抗感染防御,通过抑制T细胞增殖分化及限制B细胞增殖发挥免疫抑制作用,抑制机体抗肿瘤免疫反应,参与肿瘤免疫逃逸[11-12]。本实验发现缺血性脑损伤发生后48 h,小鼠血清中IL4I1浓度下降,随着损伤恢复到28 d又逐渐回升,而毛柳苷能够减轻脑缺血后7 d IL4I1水平的下降程度,促进恢复期IL4I1浓度回升。缺血性脑损伤后血清中IL4I1浓度变化与损伤发生和恢复相关,因此IL4I1可能成为新的缺血性脑损伤诊断与预后的生物标志物。
小胶质细胞是中枢神经系统的固有免疫细胞,小胶质细胞在生理状态下为静息状态(M0),在疾病状态下可激活为促炎表型(M1)和抗炎表型(M2)。M1型细胞分泌IL-1β、TNF-α等促炎细胞因子介导神经炎症[13];M2型细胞则分泌精氨酸酶-1、转化生长因子-β等细胞因子抑制炎症反应[14]。损伤发生后小胶质细胞由纤细分支状变为短厚突起多分支状,便于快速地应答[15-17]。本实验发现毛柳苷使缺血区周围小胶质细胞呈现出多突起分支状,增加了小胶质细胞的监测范围,促使其更快地感知损伤区域的炎症并发挥炎症调节作用。另外,毛柳苷促使脑组织损伤区周围的小胶质细胞由M1促炎表型向M2抗炎表型转化。而M2型细胞的增多有助于损伤区域的炎症修复,保护神经细胞,提示毛柳苷可能通过调节小胶质细胞极化,抑制脑损伤区域的炎症,保护神经功能。本实验中BV2小胶质细胞IL4I1表达的研究发现,活化后小胶质细胞不同表型中,IL4I1表达均降低,其中M1型较M2型细胞表达有更明显的下降趋势,提示IL4I1可能在小胶质细胞激活和表型转化中发挥重要作用。结合本实验缺血性脑损伤后毛柳苷促进脑组织IL4I1表达,且有研究发现IL4I1可调节巨噬细胞/小胶质细胞的极化[8,18],提示毛柳苷可能通过促进缺血性脑损伤后免疫调节蛋白IL4I1的表达,调节小胶质细胞的激活与极化。不过,本实验中未对IL4I1在缺血性脑损伤后小胶质细胞极化中的调节作用及机制进行研究,因此免疫调节蛋白IL4I1对小胶质细胞极化的调节作用仍有待深入研究。
【点睛】本研究通过小鼠脑缺血再灌注模型和细胞培养,探索了毛柳苷在缺血性脑损伤后脑保护作用的分子机制,提示毛柳苷可能通过促进IL4I1表达调节小胶质细胞激活与极化,从而达到神经保护的作用。
