碎米荠硒肽的制备及其体外抗氧化活性分析
2022-03-17向极钎赵小红
贾 蕾,何 慧,向极钎,赵小红,侯 焘,
(1.华中农业大学食品科技学院,湖北武汉 430070;2.恩施土家族苗族自治州农业科学院,湖北恩施 445002)
恩施碎米荠(Cardamine enshiensis)是一种十字花科碎米荠属的多年生草本植物,可药食两用,现已开始规模化种植[1]。该植物属于高聚硒植物,脂肪含量低、蛋白含量高、矿物质种类丰富,具有明显的地域特色,是极具开发价值的植物资源[2]。植物中硒的蓄积通常涉及硒代氨基酸的合成,以此消除植物体出现的硒代谢不平衡,防止机体功能失调[3]。目前,针对碎米荠的研究多集中于其生理特性、耐硒机理、大分子物质(如硒蛋白、硒多糖)的生理活性等方面。比如,石爱华等人对碎米荠的基础理化性质和营养价值进行了研究[4];有学者利用基因组学、生物信息学等技术对碎米荠的耐硒机制进行了初步探究[5];还有研究发现碎米荠多糖具备良好的抗肿瘤活性[6]。然而,对来源于碎米荠的小分子活性物质的研究却鲜见,结合其耐硒、富硒的植物特点以及硒和肽均具有良好的抗氧化活性[7-8],开发来源于碎米荠的抗氧化活性硒肽极具应用前景。
近年来,国内外研究者在植物源抗氧化肽方面已做了大量研究,证实其营养价值和附加价值均较高,与生物合成的抗氧化物相比,其副作用小、生产成本低,对于促进人体健康具有重要意义[9]。例如,米糠蛋白水解物被证实具有良好的抗氧化、抗炎活性,能够减轻氧化应激,缓解代谢综合征[10];燕麦麸蛋白水解物在体外细胞实验中,表现出了降低活性氧含量、提高抗氧化酶活性和降低促凋亡酶活性的能力,可防止氧化应激导致的细胞凋亡[11];菜籽粕蛋白水解物在体内外实验中均显示具有良好的抗氧化能力,不仅能够清除超氧阴离子,且能够大幅度降低体内的丙二醛含量,是抗氧化肽的优良来源[12]。
本研究以恩施碎米荠为原料,从中提取碎米荠蛋白,然后以自由基清除能力为评价指标,通过蛋白酶的筛选及单因素实验确定最佳酶解方案,后采用膜分离设备得到抗氧化活性较强的小分子碎米荠硒肽,以期为碎米荠的深入开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
恩施碎米荠干株 恩施土家族苗族自治州农业科学院提供;碱性蛋白酶(1.50×105U/mL)、中性蛋白酶(6.69×104U/mL)、复合蛋白酶(1.85×105U/g)、胰蛋白酶(2.50×105U/g)、木瓜蛋白酶(8.00×105U/g)诺维信(中国)生物技术有限公司;1,1-二苯基-2-苦肼基(DPPH)、2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS) 源叶生物;硒标准溶液(1000 mg/mL) 天津市光复精细化工研究所;盐酸、硝酸为国产优级纯;其他试剂 均为国产分析纯。
DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;FE20实验室pH计、ML204/02电子天平 上海梅特勒-托利多仪器有限公司;LGJ-12冷冻干燥机 北京松源华兴科技发展有限公司;半自动凯氏定氮仪 海能仪器股份有限公司;Multiskan Spectrum全波长酶标仪 美国Thermo公司;截留分子量为5、3、1 kDa再生纤维素卷式膜美国 Millipore公司;Kylin-S12+AS-90L+SA50+5500型液相色谱-原子荧光联用仪 北京吉天仪器有限公司。
1.2 实验方法
1.2.1 工艺流程及操作要点 本实验碎米荠肽的制备工艺流程如图1所示。恩施碎米荠干株打粉,过80目筛,低温干燥条件下贮藏,用于碎米荠蛋白提取;蛋白提取采用碱液提取,调节pH以沉淀蛋白,并对所提取蛋白进行氨基酸分析。利用商业酶酶解蛋白,酶解前碎米荠蛋白溶液沸水浴30 min预变性,酶解结束后,同样沸水浴灭酶10 min,最终以DPPH·、ABTS+·清除能力为指标筛选制备具有高抗氧化活性的碎米荠肽,利用超滤分级获得活性最高的肽级分。
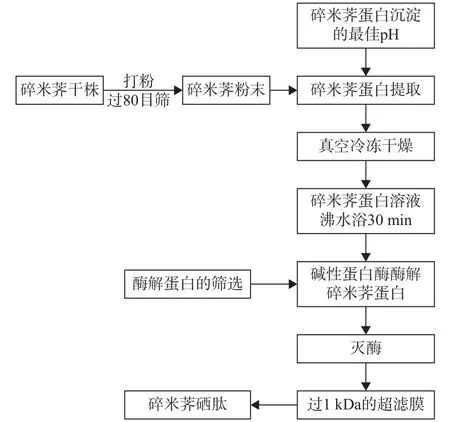
图1 碎米荠硒肽制备的工艺流程图Fig.1 Process flow chart of preparation of selenopeptide from C.enshiensis
1.2.2 碎米荠蛋白提取工艺优化及氨基酸分析
1.2.2.1 碎米荠蛋白沉淀的最佳pH的确定 利用0.10 mol/L的NaOH溶液在液料比40:1 mL/g、40 ℃的条件下对碎米荠浸提3 h,提取结束后,离心(3800 r/min,20 min)保留上清液,将其均分为11份,依次调节 pH为 1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0,静置 2 h后,离心(10000 r/min,20 min)收集上清液。用考马斯亮蓝法测上清液中蛋白的残留量。
1.2.2.2 单因素实验 以0.100 mol/L NaOH溶液、提取温度40 ℃、液料比40:1 mL/g、提取时间3 h、提取1次作为固定条件,考察NaOH溶液浓度(0.025、0.050、0.075、0.100、0.125 mol/L)、提取温度(30、40、50、60、70 ℃)、液料比(20:1、30:1、40:1、50:1、60:1 mL/g)、提取时间(2、3、4、5、6 h)、提取次数(1、2、3)对碎米荠蛋白提取率的影响。
1.2.2.3 正交试验 在单因素实验基础上,采用三因素三水平正交表L9(34),如表1所示,以蛋白提取率为测定指标,对提取条件进行优化。

表1 碎米荠蛋白提取正交试验因素水平表Table 1 Independent variables and levels of orthogonal of the extraction of C.enshiensis proteins
1.2.2.4 蛋白质提取率的测定 参考文献[13]对碎米荠粉的蛋白质氮和非蛋白质氮进行分离,具体方法为:20 mL 5%三氯乙酸溶液在室温下浸提0.1 g碎米荠粉1 h,非蛋白质氮类物质溶于三氯乙酸,蛋白质氮存于沉淀内。参考GB 5009.5-2016《食品中蛋白质的测定》,利用凯氏定氮法对碎米荠粉的氮含量、非蛋白质氮含量以及碎米荠蛋白纯度进行测定,蛋白质系数取6.25,得到碎米荠粉中的蛋白含量为9.79%。碎米荠蛋白提取率参考以下公式进行计算:

1.2.2.5 氨基酸分析 参考GB 5009.124-2016《食品中氨基酸的测定》对碎米荠蛋白进行氨基酸种类及含量进行测定。
1.2.3 碎米荠硒肽制备工艺的优化及体外抗氧化活性
1.2.3.1 单因素实验 考察碱性蛋白酶、中性蛋白酶、复合蛋白酶、木瓜蛋白酶和胰蛋白酶对碎米荠蛋白酶解效果的影响。在五种酶的最适反应条件下(表2),按照碎米荠蛋白质量浓度3%、加酶量3%、反应时间3 h的酶解条件,以水解度(DH)、DPPH·和ABTS+·清除率为主要指标,筛选出最佳试验用蛋白酶。
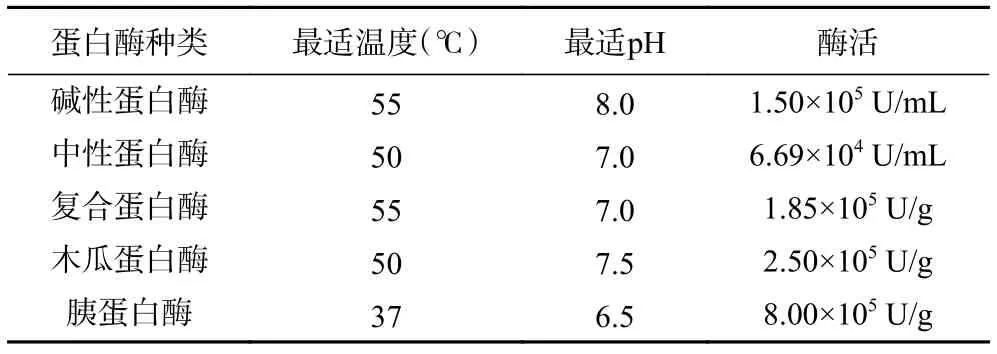
表2 蛋白酶的最适反应条件Table 2 Optimal reaction conditions of protease
在最佳实验用蛋白酶的最适反应条件下,考察碎米荠蛋白质量浓度(2%、3%、4%、5%、6%)、酶解时间(1、2、3、4、5 h),酶底比(0.5%、1.0%、2.0%、3.0%、4.0%、5.0%)对碎米荠蛋白酶解效果的影响。其中,以碎米荠蛋白质量浓度3%、酶解3 h、酶底比3.0%为固定条件,以DPPH·、ABTS+·清除率为主要指标,筛选出最佳的酶解条件。
1.2.3.2 碎米荠蛋白酶解物的分级 碎米荠蛋白酶解液依次通过截留分子量为5、3、1 kDa的超滤膜,收集不同级分的滤出液,旋转浓缩后冻干即为不同级分的碎米荠肽。测定不同级分碎米荠肽的DPPH·、ABTS+·清除能力以及硒含量,确定分离碎米荠酶解液的超滤膜规格。
1.2.3.3 水解度的确定 采用Ph-STAT 法测定 DH[14-15]。
式中:α表示NH2基团的平均解离度,等于1.01;B表示碱液的用量(L);Nb表示碱液的浓度(0.5 mol/L);M表示蛋白的质量(kg);htot表示蛋白底物的总肽键数,由氨基酸检测结果计算得知碎米荠蛋白的htot值为7.95 mmol/g。
1.2.3.4 硒含量的测定 参考GB 5009.93-2017《食品中硒含量的测定》对碎米荠不同级分肽的硒含量进行测定。
1.2.3.5 DPPH·清除能力的测定 参考文献[16]的方法对碎米荠蛋白酶解液(2.0 mg/mL)及不同级分碎米荠肽的DPPH·清除能力进行测定。清除率为50%的质量浓度为半有效浓度(EC50值),用来表示不同级分碎米荠肽的DPPH·清除能力。
1.2.3.6 ABTS+·清除能力的测定 参考文献[17]的方法对碎米荠蛋白酶解液(2.0 mg/mL)及不同级分碎米荠肽的ABTS自由基清除能力进行测定。用EC50值表示不同级分碎米荠肽的ABTS+·清除能力。
1.2.3.7 还原力的测定 参考文献[18]的方法对碎米荠硒肽的还原力进行测定。取100 μL待测样品溶液与试管内,依次加入100 μL 0.2 mol/L PBS缓冲液(pH6.6)和 100 μL 1.0% 的铁氰化钾溶液,混匀,50 ℃水浴20 min,冷却至室温后加入100 μL 10%的三氯乙酸溶液,混匀,3000 r/min下离心10 min,取100 μL上清液于96孔板内,依次加入等体积的蒸馏水和1/5体积的0.1%三氯化铁溶液,混匀,室温下避光静置10 min,用酶标仪在700 nm下测定吸光值。
1.2.3.8 Fe2+螯合能力 参考文献[19]的方法对碎米荠硒肽的Fe2+螯合能力进行测定。96孔板内,依次加入100 μL待测样品溶液、135 μL超纯水和5 μL 2 mmol/L FeCl2·4H2O,室温静置 3 min 后,继续加入10 μL 5 mmol/L的菲洛嗪溶液,均匀混合后,室温静置10 min,用酶标仪在562 nm下测定吸光值,以EDTA-2Na作为阳性对照。
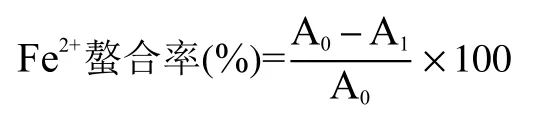
式中:A1为待测样品的吸光值;A0为空白对照组的吸光值。
1.3 数据处理
所有实验重复3次,取平均值,数据处理利用SPSS.17软件,绘图利用GraphPad Prism7.0软件进行处理,采用单因素方差分析(ANOVA)对P<0.05的差异进行统计学分析。
2 结果与分析
2.1 碎米荠蛋白最佳沉淀pH的确定
考马斯亮蓝法是测定可溶性蛋白含量的方法,在其他条件固定的情况下,所测OD值的大小与蛋白含量呈正相关关系,因此,碎米荠蛋白提取液上清中蛋白含量最低时的pH即为沉淀碎米荠蛋白的最佳pH。如图2所示,OD值随着pH的增大呈现先减后增的趋势,当pH为4.0时,OD值最小,即蛋白沉降较为完全。由此确定碎米荠蛋白沉淀的最佳pH为4.0。
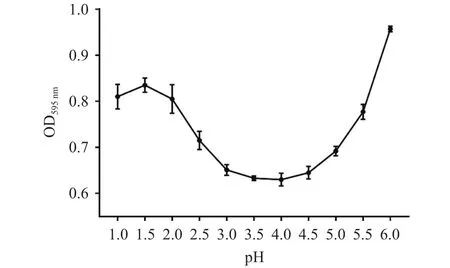
图2 pH对上清液光密度的影响Fig.2 Effect of pH on the optical density of the supernate
2.2 碎米荠蛋白提取的单因素实验
2.2.1 NaOH溶液浓度对蛋白提取率的影响 如图3a所示,碎米荠蛋白提取率随NaOH溶液浓度的增大呈现先增加后减小的趋势。因为随着碱液浓度的增加,碎米荠的细胞壁被破坏,更利于蛋白的溶出,当NaOH溶液为0.1 mol/L时,蛋白提取率最高为61.57%,显著高于其他碱液浓度提取所得蛋白(P<0.05),而随着碱液浓度的继续增大,部分蛋白质溶解,不利于沉降,碎米荠蛋白提取率随之下降。因此,选择碎米荠蛋白提取的最佳NaOH溶液浓度宜控制在0.10 mol/L左右。
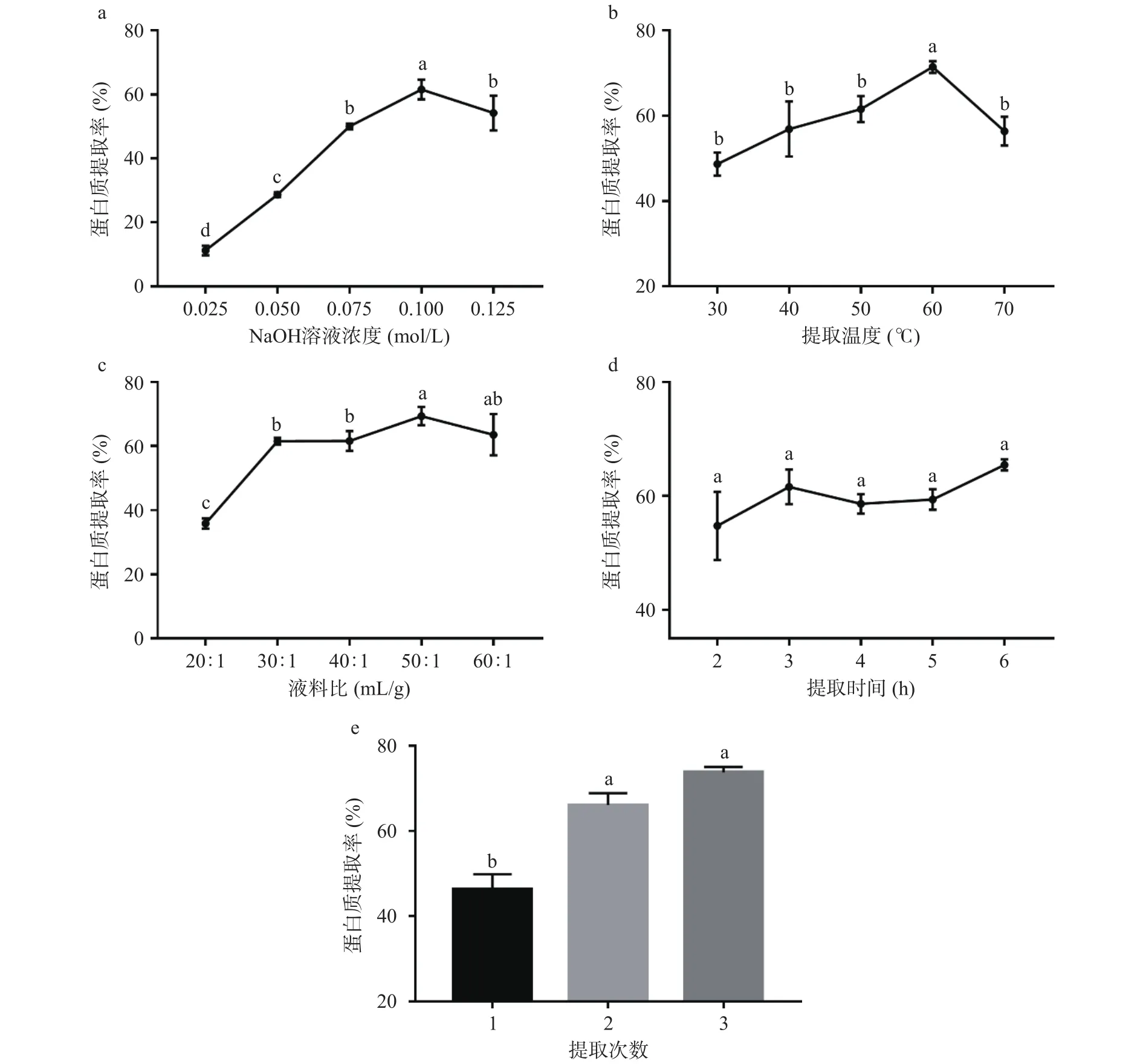
图3 各因素对碎米荠蛋白提取率的影响Fig.3 Influence of various factors on the extraction rate of SeCP
2.2.2 提取温度对蛋白提取率的影响 如图3b所示,提取温度在30~50 ℃时,蛋白质的提取率变化不显著(P>0.05);60 ℃时,蛋白质的提取率显著高于其他处理组(P<0.05)。随着温度的增加,蛋白提取率下降,其原因可能是温度过高,导致蛋白质变性,影响蛋白质的溶出。因此,碎米荠蛋白提取的最佳温度应控制在60 ℃左右。
2.2.3 液料比对蛋白提取率的影响 如图3c所示,蛋白的提取率随着液料比的增加而趋于平稳,在液料比为50:1 mL/g时,蛋白质提取率最高为69.32%,且与液料比为40:1 mL/g时的提取率有显著性差异(P<0.05),因为随着液料比的增加,溶液的浓稠度变小,碎米荠粉的分散性改善,有利于蛋白的溶出。因此,蛋白质提取的液料比宜控制在50:1 mL/g左右。
2.2.4 提取时间对蛋白质提取率的影响 如图3d所示,随着提取时间的增加,碎米荠蛋白的提取率并没有显著性改变,说明浸提时间对蛋白的提取率影响较小。这可能是在较短的浸提时间内,碱液就打开了碎米荠的细胞壁,与蛋白质充分接触,高效地促使蛋白溶出。综合考虑,选择3 h作为最佳提取时间。
2.2.5 提取次数对蛋白提取率的影响 如图3e所示,碎米荠蛋白提取率随着提取次数的增加而增大,提取2次与3次,蛋白提取率虽有增大,但已无显著性差异(P>0.05),故选择碎米荠蛋白的最佳提取次数为2次。
2.3 碎米荠蛋白质提取的正交试验
根据单因素实验的结果,选取NaOH溶液浓度、提取温度、液料比3个因素进行正交试验,各因素设3个水平,结果如表3所示。采用极差分析可知3个因素均会影响碎米荠蛋白提取率,NaOH溶液浓度的影响最大,其最佳提取组合为A1B2C2,即采用液料比 45:1 mL/g、60 ℃、0.1 mol/L NaOH 溶液、3 h、提取2次作为碎米荠蛋白的最佳提取条件。经验证,此时碎米荠蛋白的提取率为72.91%,所得碎米荠蛋白的纯度为50.50%。

表3 碎米荠蛋白提取的正交试验及极差分析Table 3 Orthogonal test and range analysis of SeCP extraction
2.4 碎米荠蛋白的氨基酸分析
由表4可知,碎米荠蛋白富含多种氨基酸。其中,44.37%为人体必需氨基酸,疏水性氨基酸占比约52.09%。生物活性肽的活性与其分子量、链长、氨基酸组成以及排序等有关,疏水性氨基酸(如Leu、Ile、Pro)以及芳香族氨基酸(如Tyr)对于肽的抗氧化活性具有显著贡献[20-22]。疏水氨基酸可以增加水-脂界面多肽的存在,并有助于清除脂相中产生的自由基[23]。高含量的疏水性氨基酸及其在序列N端或C端第三位的位置更有利于抗氧化能力的提升,例如,在棕榈仁饼粕蛋白水解物中有9种抗氧化肽均具有较强的DPPH·清除作用,其结构中的疏水氨基酸含量较高[24]。碎米荠蛋白含有丰富的疏水性氨基酸(约 52.09%)和芳香族氨基酸(如 Phe、Tyr),具有制备抗氧化活性肽的结构基础。
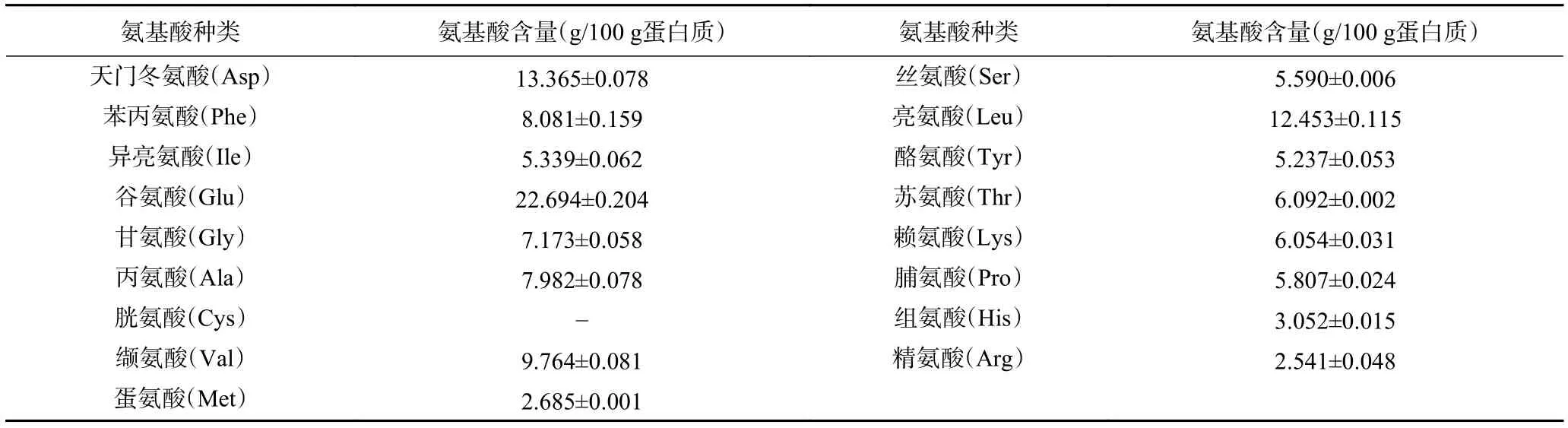
表4 碎米荠蛋白的氨基酸分析结果Table 4 Amino acid analysis results of SeCP
2.5 不同蛋白酶对碎米荠蛋白酶解效果的影响
由图4可知,经碱性蛋白酶和胰蛋白酶处理后,碎米荠蛋白水解物的自由基清除率显著高于其他酶解组(P<0.05),且碱性蛋白酶在水解过程中拥有最高的DH,此时,碎米荠蛋白水解物的DPPH·、ABTS+·清除率和DH分别为84.86%、67.16%、14.58%。综合自由基清除率和水解度考虑,选择碱性蛋白酶作为水解碎米荠蛋白的实验用酶。
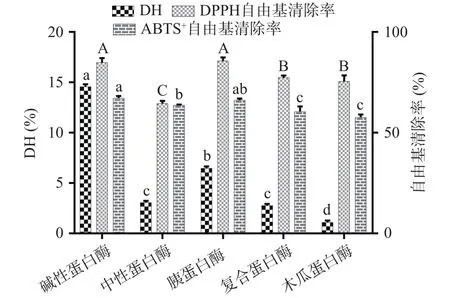
图4 蛋白酶的种类对碎米荠蛋白水解物自由基清除率和水解度的影响Fig.4 Effects of protease types on free radical scavenging rate and degree of hydrolysis of SeCP hydrolysatese
2.6 碎米荠蛋白酶解的单因素实验
2.6.1 碎米荠蛋白质量浓度对碎米荠蛋白酶解的影响 如图5a所示,随着碎米荠蛋白质量浓度的增加,碎米荠蛋白酶解物的自由基清除率呈现先增加后减小的趋势,当底物浓度为4%时,DPPH·、ABTS+·清除率均达到了最高,分别为75.06%、70.41%,但与其他浓度并没有显著性差异(P>0.05)。这可能是因为碎米荠蛋白质量浓度较低时,蛋白酶与碎米荠的蛋白接触未达到饱和状态,随着碎米荠蛋白浓度的增加,酶促反应速率提高,继续提高碎米荠蛋白浓度,则会出现底物抑制作用,不利于碎米荠蛋白水解。因此选择4%作为碎米荠蛋白酶解的底物浓度。
2.6.2 酶解时间对碎米荠蛋白酶解的影响 如图5b所示,随着酶解时间的增加,ABTS+·的清除率变化不显著,DPPH·的清除率还略有减小,当酶解时间为1 h时,DPPH·、ABTS+·清除率分别为 76.55%、67.32%。这说明1 h就足以产生较多的抗氧化肽段,而随着酶解时间的持续增长,部分活性肽被进一步水解,导致其结构发生变化,从而影响其抗氧化活性。因此,选择1 h作为碎米荠蛋白酶解的最佳时间。
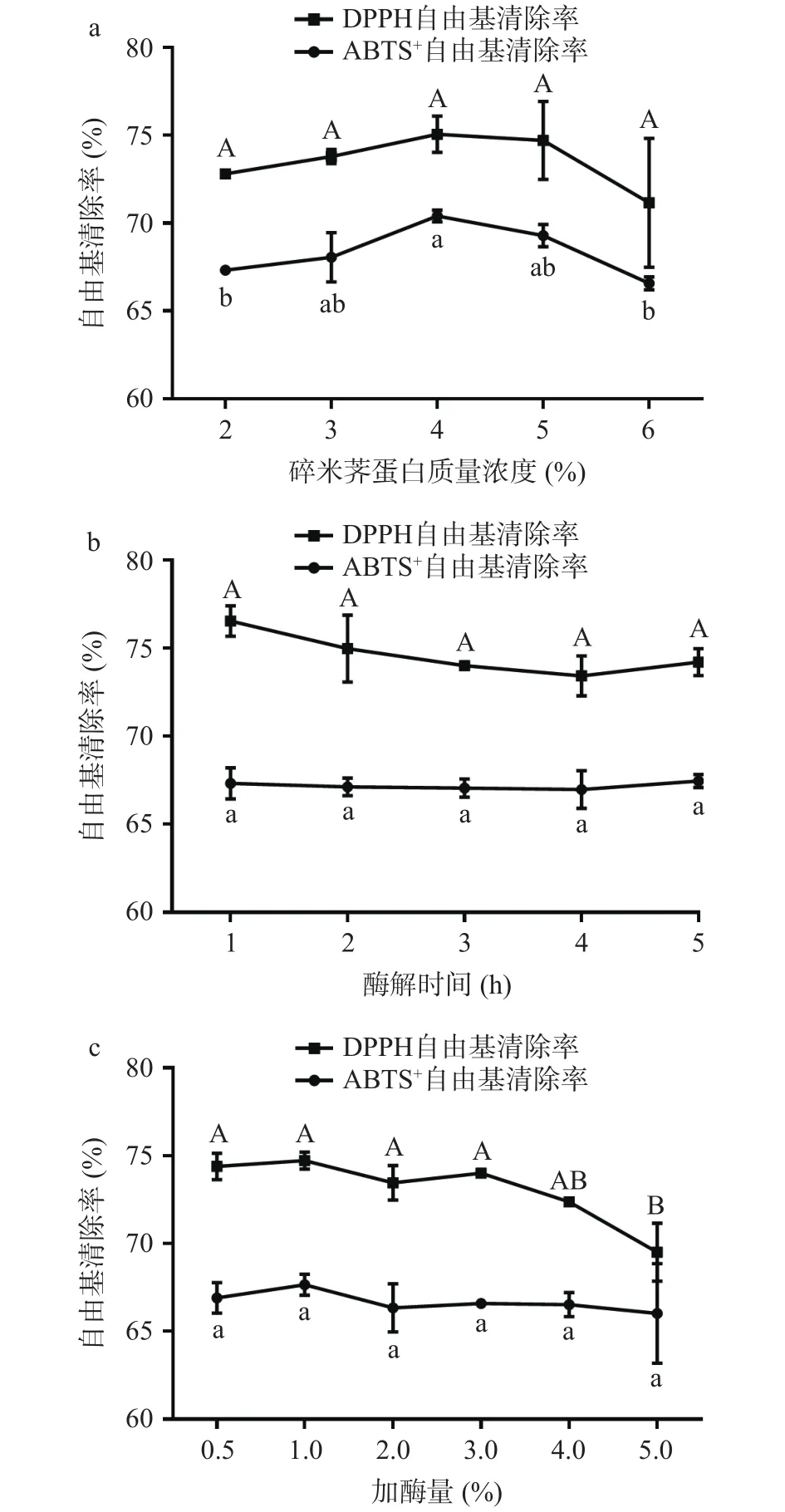
图5 各因素对碎米荠蛋白酶酶解效果的影响Fig.5 Influence of various factors on the enzymatic hydrolysis of SeCP
2.6.3 加酶量对碎米荠蛋白酶解的影响 如图5c所示,当加酶量处于0.5%~3.0%时,酶解物的自由基清除率没有显著性变化(P>0.05),且随着加酶量继续增大,自由基清除率有所下降。当加酶量为1.0%时,酶解物对DPPH·、ABTS+·的清除率达到最高。因此,选择1.0%为碎米荠蛋白酶解的最佳加酶量。
2.7 不同级分碎米荠肽的硒含量及抗氧化活性
如图6所示,不同分子量的碎米荠肽其含硒量无显著差异(P>0.05),但 ABTS+·清除率 EC50值却呈现显著性变化(P<0.05)。Mw<1 kDa的碎米荠肽其 EC50值显著小于其他级分(P<0.05);DPPH·清除率的EC50值随着分子量的减小而有所下降,但Mw<1 kDa和Mw<3 kDa碎米荠肽的DPPH·清除率无显著差异(P>0.05)。综合考虑,选择截留量为1 kDa的超滤膜用于分离分级碎米荠蛋白酶解液,所得碎米荠肽即为碎米荠硒肽,其含硒量为362.378 mg/kg,DPPH·和 ABTS+·清除率的 EC50值分别为 0.435和0.399 mg/mL。
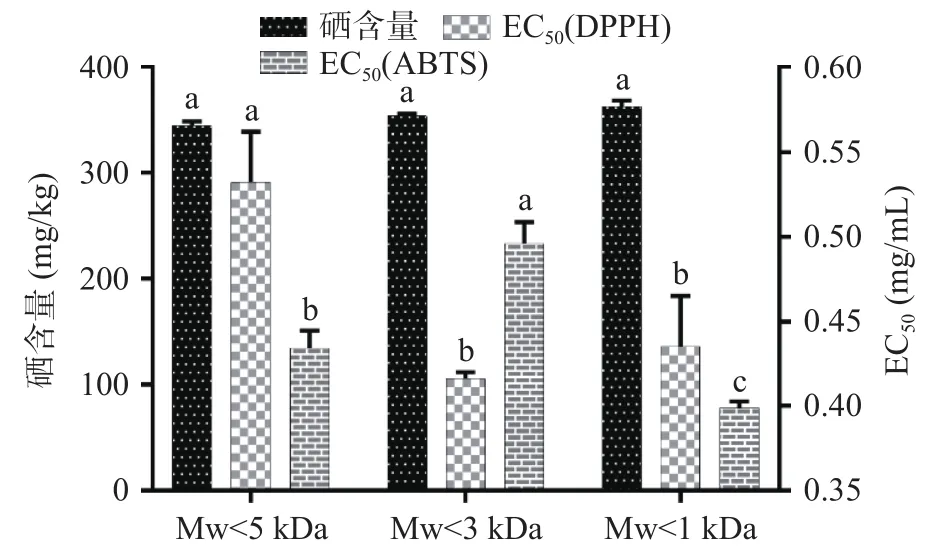
图6 不同级分碎米荠肽的硒含量及自由基清除率Fig.6 Selenium content and free radical scavenging rate of SeCP hydrolysate in different fractions
肽的分子质量、疏水性、氨基酸组成和肽序列是影响肽抗氧化活性发挥的关键结构因素[25]。有研究表明小分子量的肽相较于蛋白质往往拥有更好的抗氧化活性,其原因可能是小肽更易通过肠上皮细胞被机体吸收利用,从而发挥生理活性[26]。Li等[27]将来源于郫县豆瓣酱的水溶性肽分离为>5、3~5、1~3和<1 kDa四种级分,经体外实验发现分子量<1 kDa的肽表现更显著的DPPH·和ABTS+·清除活性,本实验结果与该文献报道一致。硒是多种氧化还原酶的重要组成部分(如谷胱甘肽过氧化物酶、硒蛋白P),其生物活性的发挥受摄入量、赋存形式以及生物利用度等因素的影响[28]。其中,有机硒化合物的安全性高,活性稳定,在调节氧化还原平衡、催化引发细胞损伤的过氧化物的还原以及保护机体免受氧化损伤方面,表现出极大的优势[29]。碎米荠肽中硒含量较高,其具有高抗氧化能力可能是硒、肽协同作用的结果。
2.8 碎米荠硒肽的体外抗氧化活性
碎米荠硒肽的还原力、Fe2+螯合能力如图7所示。由图7a可知,碎米荠硒肽的还原力与其质量浓度存在剂量-效应关系,浓度越高,OD700nm值越大,还原力越强。由图7b可知,当质量浓度为0.8 mg/mL时,碎米荠硒肽的Fe2+螯合能力与阳性对照EDTA-2Na大致相当,螯合率达到了94.99%,说明碎米荠硒肽能充当还原剂与氧化剂反应,并能螯合金属离子,抑制其对油脂氧化反应的催化能力。
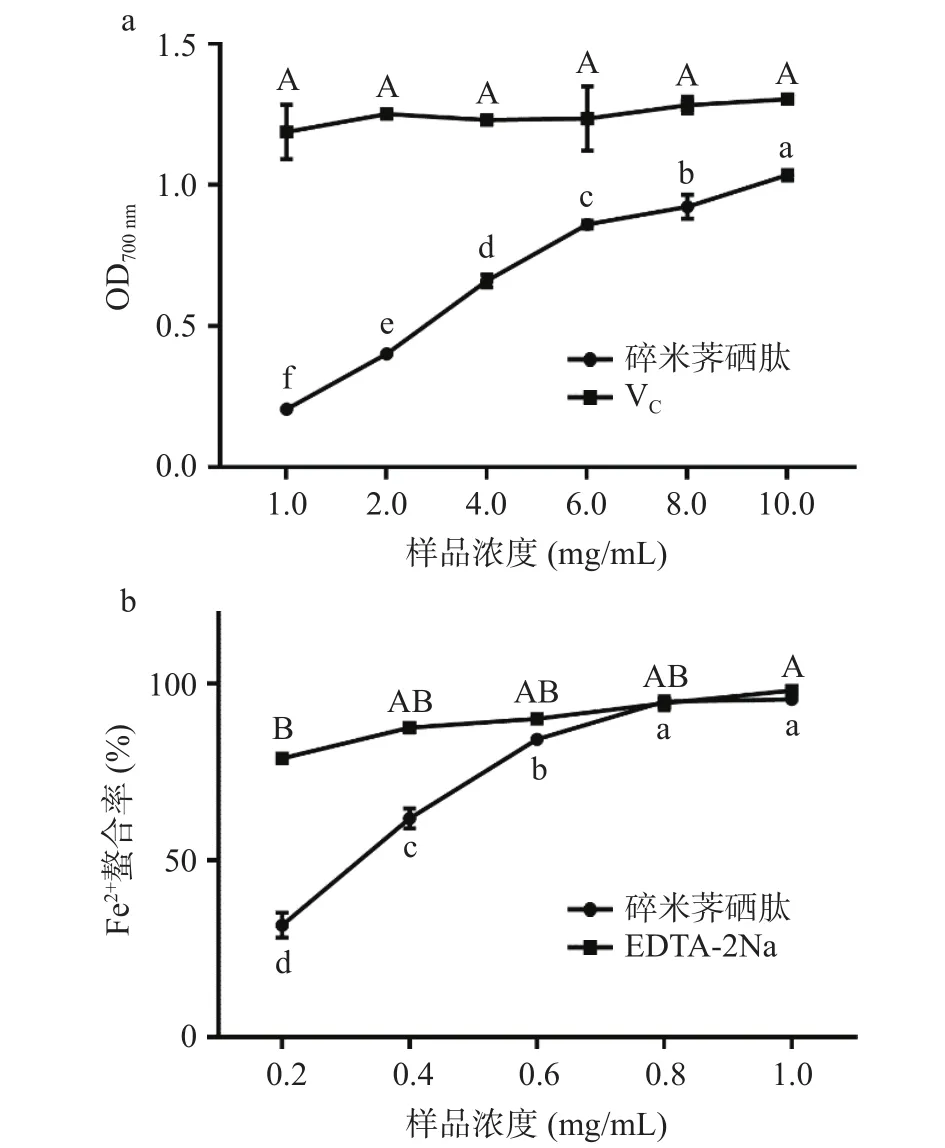
图7 碎米荠硒肽的体外抗氧化试验结果Fig.7 Antioxidant test of SeCPPs in vitro
3 结论
以恩施碎米荠为原料,利用碱溶酸沉法提取碎米荠蛋白,并在其质量浓度4%、酶解时间1 h、碱性蛋白酶加酶量1%、超滤膜截留分子量为1 kDa的条件下制备得碎米荠硒肽,其DPPH·、ABTS+·清除率的EC50值分别为0.435和0.399 mg/mL。本研究以恩施州特色农产品为原料,为开发碎米荠硒肽成为功能性食品奠定了基础,也为其产业化提供了新思路。
