苯乙烯的同步硒化和烯基化反应
2022-03-17王利敏胡博张万轩
王利敏,胡博,张万轩
(湖北大学化学化工学院,湖北 武汉 430062)
0 引言
硒醚在温和条件下,可以被氧化脱去硒基生成碳碳双键[1],这一重要反应的发现促进了有机硒化合物在有机合成中的应用. 有机硒化合物不仅作为中间体广泛应用于天然产物、生物活性物质的合成中[2-5],而且能够用作催化剂催化许多独特的转化反应[6-8],表现出良好的应用前景. 因此,研究向有机分子中引入硒的途径,发展新的有机硒化合物的合成方法具有重要意义. 碳碳双键与亲电性硒化物(RSeX)的加成反应是制备有机硒化合物的重要方法之一,在此类反应中,亲电性硒化物(RSeX)与碳碳双键反应生成硒鎓离子或碳正离子中间体(A),然后与亲核试剂(Nu-)结合,得到加成反应产物(如图1).
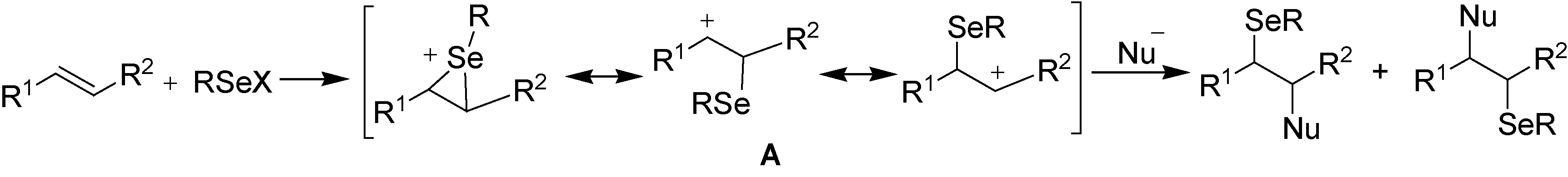
图1 亲电性硒化物与烯的加成反应
烯烃与各种亲电性硒化物(RSeX)及亲核试剂的加成反应已有许多报道[ 2-5, 9-13 ],此方法可以制得邻位含有多种官能团(如卤素、羟基、烷氧基、叠氮基等)的硒醚,但是以烯烃作为亲核试剂进攻中间体A,发生分子间反应的很少.文献[14]报道利用溴氧化二硒醚,AgOTf作为添加剂,实现了苯乙烯的同步硒化和烯基化,但只有提供了一个反应实例;用碘作为氧化剂氧化二硒醚再与苯乙烯类物质反应[15],也可以实现苯乙烯的硒化和烯基化反应,但苯环联有钝化基团的乙烯类物质反应较差.
如图2所示,我们利用Selectfluor试剂 [1-氯甲基-4-氟-1, 4-二氮杂双环[2.2.2]辛烷二(四氟硼酸盐)] 氧化二苯二硒醚,然后与苯乙烯类物质反应,得到苯乙烯同时硒化和烯基化的产物,且加入三甲基氰基硅作为添加剂使产率得到提高. 该方法操作简便,反应时间短,为实现此类反应提供了新途径[16].
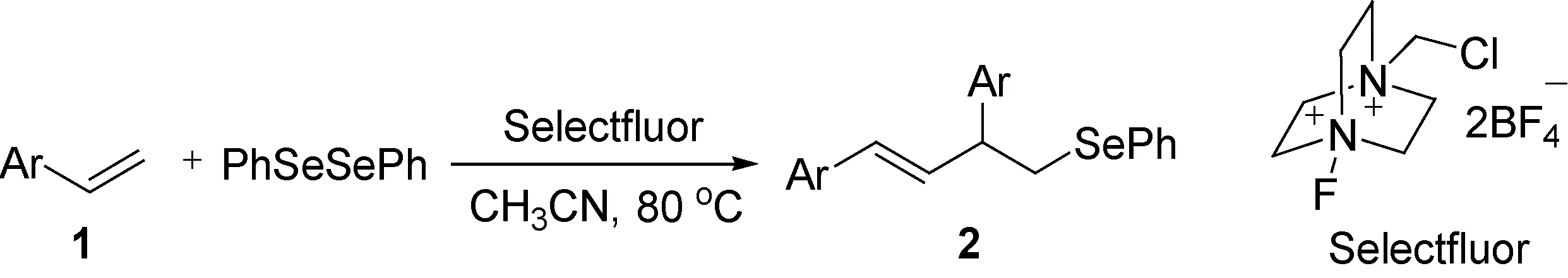
图2 二苯基二硒醚/ Selectfluor与苯乙烯类物质的反应
1 实验部分
1.1 试剂与仪器试剂:4-乙基苯乙烯,2-乙基苯乙烯,4-氯苯乙烯,4-溴苯乙烯,2-氯苯乙烯根据文献方法制备[17],其他试剂为市售分析纯试剂. 1, 4-二氧六环,THF,乙腈,DMF在使用前经过去水干燥. 仪器: WIPM 400 MHz核磁共振仪(中科开物公司),Varian Unity INOVA 600 MHz (美国Varian 公司);安捷伦 1260-6224 LC-MS TOF ESI (EI) 液质联用质谱仪.
1.2 实验步骤
1.2.1 反应条件研究 在惰性气体条件保护下,将苯乙烯1a(104 mg,1.0 mmol),二苯二硒醚(87 mg,0.28 mmol),Selectfluor(195 mg,0.55 mmol),三甲基氰基硅烷(50 mg,0.5 mmol)加入到1 mL无水溶剂中,在设定温度下反应, 利用薄层色谱检测反应,待苯乙烯反应消耗完毕后,先加水(10 mL)搅拌几分钟,再用二氯甲烷(3×10 mL)萃取,有机相用无水硫酸钠干燥,过滤,减压下蒸去溶剂,最后通过硅胶柱色谱分离提纯得到产物. 具体反应见表1.
1.2.2 多种烯烃的硒化反应的实验步骤 在无水无氧条件下,将烯1(1.0 mmol),二苯二硒醚(0.28 mmol),Selectfluor(0.55 mmol), 三甲基氰基硅烷(0.5 mmol)加入到装有乙腈(1 mL)的反应管中,在80 ℃下反应6 h,反应结束后加入10 mL水,再用二氯甲烷(3×10 mL)萃取. 萃取所得有机相用无水硫酸钠干燥,过滤,减压蒸干溶剂,最后通过硅胶柱色谱分离提纯,得到最终硒化产物.
2 结果与讨论
2.1 反应条件的优化以苯乙烯(1a),二苯基二硒醚为原料,讨论了添加剂用量,过渡金属离子,溶剂,反应温度等因素对反应的影响. 首先用乙腈作溶剂,探讨了添加剂对反应的影响,从反应1, 5, 6可知,加入添加剂三甲基氰基硅烷后,产率有较大提升,而加入三甲基叠氮基硅烷后,产率无太大变化;从反应1, 4可知,当三甲基氰基硅烷的用量再增加一倍时,产率只增加了1%,所以进一步增加三甲基氰基硅烷的用量是不必要的. 因为在Selectfluor参与的反应中,一些金属离子常常具有催化作用,所以分别讨论了加入AgOTf和CuCl后的反应情况,对比反应1, 2, 3的产率,未加入过渡金属离子时,硒化反应产物的产率为55%,而加入了AgOTf和CuCl后,硒化反应的产率分别为53%和54%,与未加入过渡金属离子时的反应的产率没有明显差别. 反应1, 10, 11讨论了温度对反应的影响,从反应10可知,在0 ℃时,该反应不能进行,在室温下反应12 h后,得到产物的产率仅为21%. 从反应1,7,8,9可以看出,反应在PhMe、 DMF、 二氧六环中进行时,产率均不超过22%.因此,当1.0 mmol苯乙烯反应时,加入0.28 mmol二苯二硒醚,0.5 mmol三甲基氰基硅烷,乙腈(1 mL)作溶剂,惰性气体保护下在80 ℃反应6 h为适宜的反应条件.
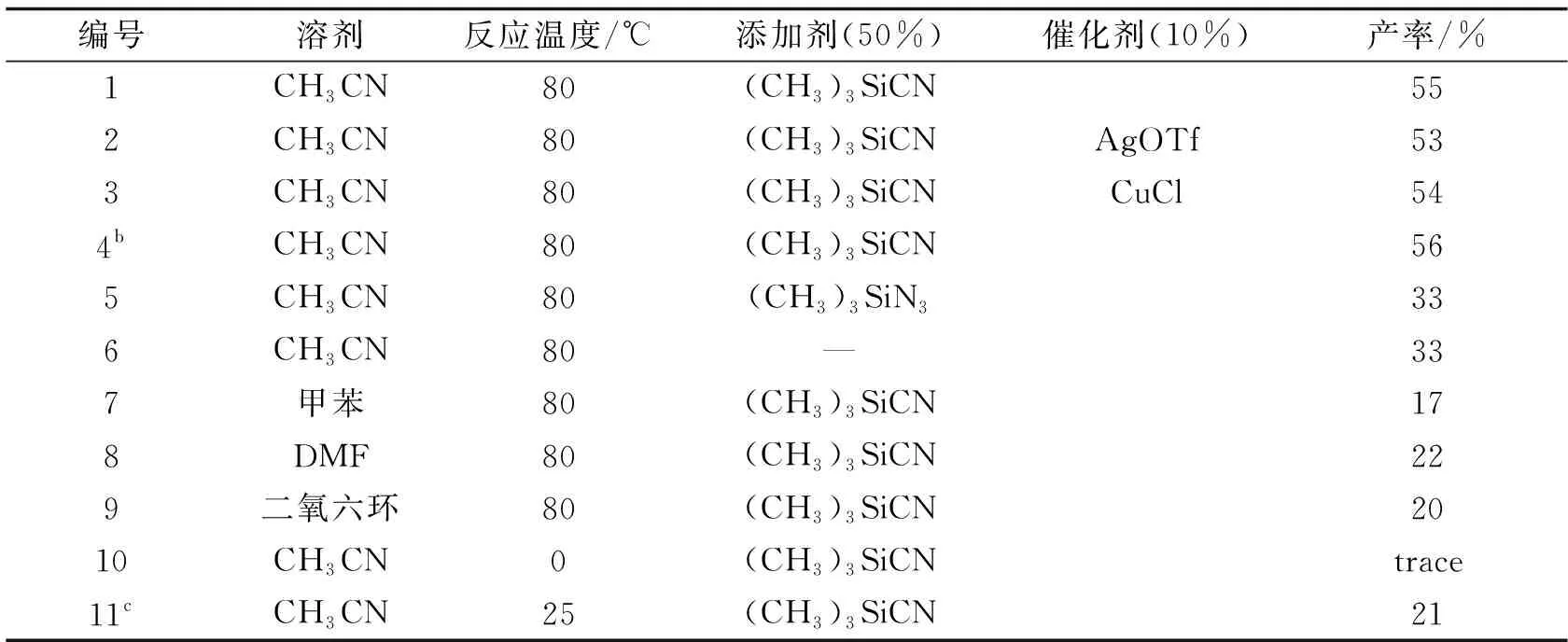
表1 二苯基二硒醚/Selectfluor与苯乙烯反应条件的优化a
2.2 多种烯烃与二苯二硒醚/Selectfluor的反应在优化的反应条件下,对连有不同取代基的烯烃1与二苯二硒醚/Selectfluor的反应进行研究,结果见表2. 发现芳基烯1a-1l与二苯二硒醚在Selectfluor存在下反应,都可以得到同时被苯硒化和烯基化的产物2a-2k, 产率为37%~58%, 但烷基烯不能发生此反应(反应13,14). 芳基烯烃中苯环上的取代基对硒化反应的结果都有着不同程度的影响. 取代基的电子效应对产率的影响规律不明显,但取代基的位置对反应影响有明显规律,在取代基相同的情况下,对位取代的芳烯,硒化反应的产率较高(反应2,6和7;4和5;8和9;10和12).
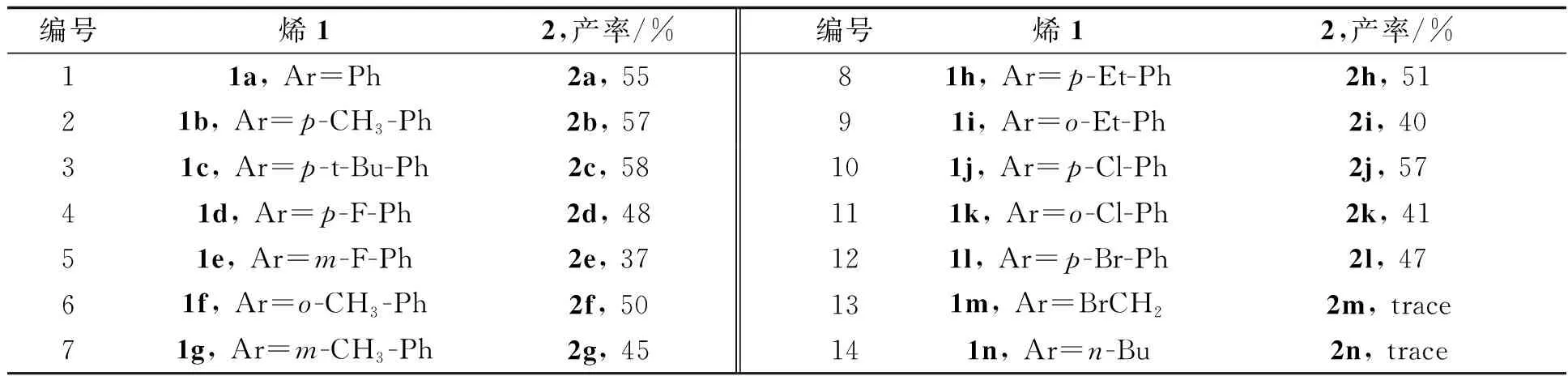
表2 多种烯的硒化反应结果
2.3 化合物的结构表征
2a:黄色油状液体[15];1H NMR (400 MHz, CDCl3):δ=7.48~7.46 (m, 2H), 7.32~7.28 (m, 4H), 7.27~7.17 (m, 9H), 6.44~6.33 (m, 2H), 3.76 (dd,J=14.4, 7.4 Hz, 1H), 3.36~3.33 (m, 2H).13C NMR (100 MHz, CDCl3)δ=143.23, 137.12, 132.81, 132.22, 130.87, 130.75, 129.13, 128.75, 128.55, 127.65, 127.43, 126.95, 126.91, 126.38, 49.41, 34.13.
2b: 黄色油状液体[15];1H NMR (400 MHz, CDCl3):δ=7.48~7.46 (m, 2H), 7.25~7.17 (m, 5H), 7.14~7.00 (m, 6H), 6.41~6.27 (m, 2H), 3.77~3.68 (m, 1H), 3.33 (d,J=7.6 Hz, 2H), 2.32 (s, 3H), 2.31 (s, 3H).13C NMR (100 MHz, CDCl3)δ=140.20, 137.09, 136.50, 134.38, 132.75, 131.40, 130.80, 130.57, 129.42, 129.23, 129.10, 127.50, 126.83, 126.26, 48.95, 34.13, 21.24, 21.15.
2c:白色固体[15];1H NMR (400 MHz, CDCl3):δ=7.43~7.44 (m, 2H), 7.33~7.26 (m, 6H), 7.22~7.19 (m, 3H), 7.19~7.15 (m, 2H), 6.44~6.29 (m, 2H), 3.79~3.70 (m, 1H), 3.34 (d,J=7.6 Hz, 2H), 1.30 (s, 9H), 1.29 (s, 9H).13C NMR (100 MHz, CDCl3)δ=150.43, 149.62, 140.35, 134.52, 132.68, 131.54, 130.96, 130.42, 129.06, 127.18, 126.77, 126.06, 125.55, 125.43, 48.93, 34.57, 34.48, 34.28, 31.42, 31.35.
2d:无色油状液体[15];1H NMR (400 MHz, CDCl3):δ=7.46~7.41 (m, 2H), 7.26~7.20 (m, 5H), 7.18~7.13 (m, 2H), 7.01~6.91 (m, 4H), 6.34~6.19 (m, 2H), 3.76~3.67 (m, 1H), 3.33~3.23 (m, 2H).13C NMR (100 MHz, CDCl3)δ=163.24 (JF-C=50.7 Hz), 160.80 (JF-C=49.3 Hz), 138.71 (JF-C=3.3 Hz), 133.10 (JF-C=3.3 Hz), 132.87, 131.76, 130.45, 129.75, 129.14 (JF-C=3.3 Hz), 129.04, 127.83 (JF-C=7.9 Hz), 127.03, 115.59 (JF-C=8.2 Hz), 115.38 (JF-C=8.5 Hz), 44.61, 34.10.
2e:无色油状液体;1H NMR (400 MHz, CDCl3):δ=7.49~7.46 (m, 2H), 7.39~7.23 (m, 5H), 7.06 (d,J=7.8 Hz, 1H), 7.01 (d,J=7.9 Hz, 2H), 6.94~6.87 (m, 3H), 6.39~6.29 (m, 2H), 3.79~3.70 (m, 1H), 3.35~3.27 (m, 2H).13C NMR (100 MHz, CDCl3)δ=164.27 (JF-C=7.0 Hz), 161.82 (JF-C=8.0 Hz), 145.39 (JF-C=6.7 Hz), 139.19 (JF-C=7.7 Hz), 132.93 (JF-C=11.9 Hz), 130.21, 129.98 (JF-C=8.4 Hz), 129.18, 127.14, 123.26 (JF-C=2.9 Hz), 122.28 (JF-C=2.5 Hz), 114.64, 114.44 (JF-C=3.0 Hz), 114.24, 114.03, 113.82, 112.88, 112.66, 49.11, 33.58; HRMS (ES+):m/z[M+H]+calculated for C22H19F2Se: 401.0615; found: 401.065 8.
2f:黄色油状液体[15];1H NMR (400 MHz, CDCl3):δ=7.50~7.48 (m, 2H), 7.36~7.34 (m, 1H), 7.24~7.22 (m, 5H), 7.14~7.11 (m, 5H), 6.59 (d,J=15.6 Hz, 1H), 6.17 (dd,J=15.7, 7.7 Hz, 1H), 4.05~3.96 (m, 1H), 3.33 (d,J=7.6 Hz, 2H), 2.29 (s, 3H), 2.27 (s, 3H).13C NMR (100 MHz, CDCl3)δ=141.39, 136.43, 135.86, 135.30, 133.25, 132.97, 130.68, 130.19, 129.11, 128.90, 127.29, 126.97, 126.63, 126.42, 126.05, 125.75, 45.00, 33.59, 19.87, 19.56.
2g:黄色油状液体[15];1H NMR (400 MHz, CDCl3):δ=7.48~7.46 (m, 2H), 7.23~7.11 (m, 7H), 7.05~7.00 (m, 4H), 6.41~6.30 (m, 2H), 3.76~3.68 (m, 1H), 3.34 (d,J=8.0 Hz, 2H), 2.33 (s, 3H), 2.31 (s, 3H).13C NMR (100 MHz, CDCl3)δ=143.24, 138.05, 137.09, 132.76, 132.10, 130.80, 129.10, 128.60, 128.44, 128.35, 128.18, 127.69, 127.03, 126.84, 124.63, 123.58, 49.44, 34.13, 21.58, 21.44.
2h:无色油状液体;1H NMR (400 MHz, CDCl3):δ=7.49~7.42 (m, 2H), 7.27~7.20 (m, 5H), 7.17~7.10 (m, 6H), 6.42~6.28 (m, 2H), 3.78~3.69 (m, 1H), 3.33 (d,J=8 Hz, 2H), 2.67~2.56 (m, 4H), 1.24 ~1.16 (m, 6H).13C NMR (100 MHz, CDCl3)δ=143.56, 142.78, 140.57, 134.67, 132.70, 131.44, 130.91, 130.51, 129.07, 128.16, 128.03, 127.52, 126.78, 126.33, 49.00, 34.31, 28.64, 28.51, 15.65, 15.56; HRMS (ES+):m/z[M+H]+calculated for C26H29Se: 421.142 9; found: 421.152 4.
2i:无色油状液体;1H NMR (400 MHz, CDCl3):δ=7.52~7.47 (m, 2H), 7.39 (d,J=7.3 Hz, 1H), 7.31~7.22 (m, 5H), 7.21~7.13 (m, 5H), 6.64 (d,J=15.6 Hz, 1H), 6.25 (dd,J=15.6, 7.6 Hz, 1H), 4.10~4.02 (m, 1H), 3.33 (d,J=6.4 Hz, 2H), 2.68~2.56 (m, 4H), 1.19~1.12 (m, 6H).13C NMR (100 MHz, CDCl3)δ=141.78, 141.44, 140.91, 135.75, 133.88, 133.01, 130.65, 129.11, 129.03, 128.62, 126.58, 127.50, 126.99, 126.81, 126.75, 126.34, 126.06, 126.03,44.18, 34.28, 26.50, 25.87, 15.69, 15.36; HRMS (ES+):m/z[M+H]+calculated for C26H29Se: 421.142 9; found: 421.141 3.
2j:无色油状液体[15];1H NMR (400 MHz, CDCl3):δ=7.48~7.42 (m, 2H), 7.30~7.20 (m, 9H), 7.14 (d,J=8.4 Hz, 2H), 6.37~6.23 (m, 2H), 3.72 (dd,J=13.9, 7.4 Hz, 1H), 3.36~3.22 (m, 2H).13C NMR (100 MHz, CDCl3)δ=141.30, 135.37, 133.15, 132.96, 132.73, 132.40, 130.28, 129.93, 129.18, 129.00, 128.87, 128.71, 127.55, 127.07, 48.79, 33.75.
2k:无色油状液体;1H NMR (400 MHz, CDCl3):δ=7.52~7.50 (m, 2H), 7.46~7.43 (m, 1H), 7.37~7.29 (m, 3H), 7.25~7.22 (m, 4H), 7.19~7.14 (m, 3H), 6.85 (d,J=15.8 Hz, 1H), 6.33 (dd,J=15.8, 7.8 Hz, 1H), 4.37 (dd,J=15.1, 7.5 Hz, 1H), 3.42~3.29 (m, 2H).13C NMR (100 MHz, CDCl3)δ=140.27, 135.19, 133.82, 133.34, 133.27, 133.02, 130.16, 129.97, 129.66, 129.09, 128.54, 128.51, 128.08, 128.01, 127.13, 127.12, 126.91, 126.78, 45.39, 32.65; HRMS (ES+):m/z[M+H]+calculated for C22H19Cl2Se: 433.002 4; found: 433.000 4.
2l:无色油状液体[15];1H NMR (400 MHz, CDCl3):δ=7.48~7.36 (m, 6H), 7.25~7.22 (m, 3H), 7.15 (d,J=8.4 Hz, 2H), 7.09 (d,J=8.4 Hz, 2H), 6.30 (d,J=2.8 Hz, 2H), 3.73~3.68 (m, 1H), 3.34~3.24 (m, 2H).13C NMR (100 MHz, CDCl3)δ=141.76, 135.79, 132.97, 132.44, 131.81, 131.64, 130.23, 130.01, 129.38, 129.16, 127.87, 127.11, 121.30, 120.82, 48.87, 33.63.
3 反应机理的讨论
根据文献报道[15],该反应的机理可能是Selectfluor先氧化二苯二硒醚生成亲电的中间体B, 烯烃1与B发生亲电加成反应,生成碳正离子C和苯基氟化硒(PhSeF)[图3反应(1)];由于Si-F键很稳定,易生成,所以三甲基氰基硅烷可以夺去PhSeF中氟负离子,使生成苯硒正离子(PhSe+)的速度更快,从而促进碳正离子C[图3反应(2)]的生成,有利于提高产率. 由于芳基Ar的共轭作用可以稳定碳正离子,所以正电荷更易处于苄位碳上. 碳正离子C与另一分子烯烃1发生亲电加成反应,得到中间体D, 该碳正离子脱去邻位H+,生成产物2[图3反应(3)]. 烷基烯生成类似C的碳正离子中间体不够稳定,难以发生此类反应.
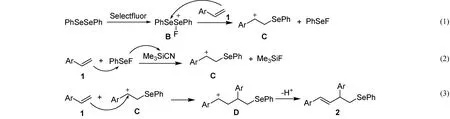
图3 反应机理推测
4 结论
利用含氟氧化剂Selectfluor氧化二苯二硒醚,并与芳基乙烯反应,在引入苯硒基的同时,伴随着与芳基乙烯分子的偶联反应,得到苯硒化和烯基化产物.加入三甲基氰基硅烷,使产率明显提高;在取代基相同的情况下,对位取代的芳基乙烯比邻、间位取代的芳基乙烯反应产率高. 此反应所用原料稳定,操作方便,为芳基乙烯的硒化提供了新方法.
