山西省玉米品种抗矮花叶病鉴定及蚜虫传播分析
2022-03-17谢咸升张作刚
杨 帆,谢咸升,张作刚
(1.山西农业大学 植物保护学院,山西 太谷 030801;2.山西农业大学 小麦研究所,山西 临汾 041000)
近年来,玉米逐步取代小麦,成为了山西省产量最高的粮食作物,与此同时,制约山西省玉米产量的重要病害,玉米矮花叶病的发生趋势也渐渐上升[1]。玉米矮花叶病是全球传播最广泛的玉米病毒病,我国最早于1968年在河南新乡、安阳地区发现,此后逐年加重并向周围蔓延,导致周边多地矮花叶病大流行[2]。在20世纪初,抗矮花叶病自交系品种的种植与繁育受到重视,玉米矮花叶病情得到控制,发生较少[3],但近期又出现逐年加重的迹象。
对于矮花叶病的研究主要分为病原鉴定、寄主鉴定及传播途径3个方面。1965年,WILLIAMS和ALEXANDER最早明确了矮花叶病主要是由玉米矮花叶病毒(maize dwarf mosaic virus,MDMV)引发的病害[4]。紧随其后,MACKENZIE发现了能侵染约翰逊草的MDMV-B株系[5]。1988年,我国学者史春霖和徐绍华利用MACKENZIE的方法,以约翰逊草为鉴别寄主,确定了引起我国矮花叶病的主要病毒为B株系[6]。随着DNA测序技术的普及,SHUKLA等[7]对比多个病毒的外壳蛋白基因序列,确定了MDMV-B株系应属于甘蔗花叶病毒(Sugarcane mosaic virus,SCMV)。在此期间,玉米矮花叶病毒的传播途径研究也逐步丰富。1978年,甘肃省农科院通过对天玉一号玉米品种的种子进行检测,证明矮花叶病毒可以贮藏在种子中越冬。马铃薯Y病毒属(Potyvirus)成员通过蚜虫以非持久方式传播。杨士华等[8]对田间蚜虫的动态变化进行长达3 a的监测,初步明确蚜虫大面积发生与矮花叶病流行之间具有重要的因果联系。杨俊伟等[9]、李向东等[10]综合了我国常见传播矮花叶病毒的蚜虫,主要包括麦二叉蚜、苜蓿蚜、豌豆蚜、绵蚜、麦长管蚜、桃蚜、禾谷缢管蚜以及玉米蚜。而高文臣等[11]通过蚜虫传毒对比试验,不仅发现田间一些常见的蚜虫,如麦长管蚜等并不具备传毒能力,还总结了几种能高效传播矮花叶病毒的蚜虫。随着蚜虫传毒能力的研究日渐透彻,不少学者开始着重研究蚜虫获取毒源的途径。一些禾本科其他作物和杂草也可感染矮花叶病毒。一开始,仅有一些1年生杂草被鉴定可感染该病毒,随着世界多地的学者研究杂草传播特性,逐渐将一些龙爪茅属、荩草属、短柄草属和假稻属的部分多年生杂草也纳入该病毒的侵染范围[12-13]。许小洁等[14]根据我国田间常出现的15种杂草进行感染试验,结果表明,狗尾草、马唐、稗草3种杂草也可作为SCMV的初侵染源。目前,矮花叶病病原、蚜虫传播、种子传播等各个单方面的研究较为丰富,但关于蚜虫传播效率与田间环境、播种时期之间联系方面的研究还相对欠缺,且目前防治矮花叶病毒的主要方式着重于抗病品种的推广[15]。
为进一步解释蚜虫在玉米矮花叶病流行中的重要性,丰富矮花叶病防治手段,确定蚜虫传播矮花叶病毒的影响,本研究通过结合传统反转录(RT-PCR)与酶联免疫吸附反应(Enzyme linked immunosorbent assay,ELISA)技术[16],设计多种试验探究影响玉米矮花叶病毒传播的因素,明确玉米矮花叶病流行前后影响病害发生的主效因子与微效因子,旨在为矮花叶病的防治提供理论依据。
1 材料和方法
1.1 材料
1.1.1 供试材料 供试玉米为2019年由山西省种子站提供的370份玉米抗性鉴定品种,同年5月种植于山西农业大学小麦研究所红堡国家试验基地。
1.1.2 试剂 RNA抽提裂解液由实验室配制,成分包括:528μL 10%十二烷基肌氨酸钠、10.9 mL水饱和苯酚、0.02 g 8-羟基喹啉、352μL 0.75 mol/L p H=7.0柠檬酸钠、1.09 mL 2 mol/L醋酸钠、10 mL 7.22 mol/L异硫氰酸胍、76μLβ-巯基乙醇;in‑NovaUscript II First-Strand cDNA Synthesis Super‑Mix反转录试剂盒、PCR Mix、DNA Marker2000购自湖南一诺唯真公司;Goldview购自陕西中辉赫彩医药科技有限公司;SCMV第一抗体由浙江大学吴建祥教授赠予;Tris、硝酸纤维素膜(NC膜)购自北京索莱宝生物科技公司;碱性磷酸酶(alkaline phos‑phatase,AP)标记的羊抗鼠IgG二抗购自美国Sigma公司;NBT/BCIP购自武汉博士德生物公司;PCR引物购自南京金斯瑞公司;其余试剂为国产分析纯。
1.1.3 仪器 H1850高速离心机(湖南湘仪实验室仪器开发有限公司);Champ Gel 5000凝胶成像仪(北京赛智创业科技有限公司);凝胶电泳槽(北京六一仪器厂);DYY-2C型电泳仪(北京六一仪器厂);G-1000基因扩增仪(杭州博日科技股份有限公司);移液器(北京大龙兴创实验仪器有限公司)。
1.2 方法
1.2.1 玉米矮花叶病抗性鉴定 参照中华人民共和国农业农村部颁布的玉米抗病虫鉴定技术规范第4部分:玉米抗矮花叶病鉴定技术规范,将保毒玉米幼苗上的病叶研碎,加入0.01 mol/L PBS缓冲液(8 g氯化钠、0.2 g氯化钾、0.2 g磷酸二氢钾、3 g磷酸氢二钠定容至1 000 mL,p H值调节至7.0)配制为溶液,以摩擦接种法处理待鉴定品种叶片,10月初调查并记载各品种植株的病情指数,根据规范中的公式计算并划分品种的抗性水平。
1.2.2 病毒侵染试验设计 于抗性鉴定结果中筛选感病品种,2020年11月3日至12月3日玻璃温室模拟无蚜虫环境种植;2021年4月10日至5月10日播种前模拟非作物生境种植;2021年6月1日至7月1日分别于田间、田间杂草集中区域模拟田间幼苗矮花叶病偶发区与田间杂草集中区域种植;对田间幼苗进行接毒处理,2021年8月2日至9月1日模拟田间矮花叶病大流行时期种植。每阶段种植30 d作为1个侵染周期,衡量矮花叶病的传播效率与发病情况。
1.2.3 玉米矮花叶病病毒分子鉴定 取待检测试验样本,加入液氮研磨细碎,DEPC处理(用0.1%浓度的DEPC浸泡过夜,后高压灭菌去除DEPC残留液体)后的EP管中称取0.1 g样本,加入1 mL RNA抽提裂解液,常温裂解15 min,加入200μL三氯甲烷,静置3 min,12 000 g离心15 min,取上清液至新DEPC处理后的EP管中并加入500μL异丙醇,振荡混合后静置10 min,12 000 g离心10 min,弃上清液,加入1 mL 75%DEPC乙醇(0.1%DEPC配置75%乙醇并进行高压灭菌处理)后7 500 g离心5 min,用移液器缓慢吸取液体,晾干后加入40μL DEPC水(0.1%DEPC过夜放置后高压灭菌),充分溶解后吸取1μL至DEPC处理后的PCR管中,加入无酶水和gDNA去除液,置于PCR仪中42℃保持2 min,加入4μL鼠源反转录酶、0.5μL多聚胸腺嘧啶、0.5μL随机引物进行反转录,设置PCR程序25℃持续20 min、50℃持续20 min、85℃保持持续5 s。反转录结束后,取1.5μL模板,加入10μmol/L上游引物与下游引物各0.5μL、PCR Mix 12.5μL、无菌水10μL。设置PCR程序为:94℃预变性5 min;94℃变性30 s,49℃退火30 s,72℃延伸1 min,设置35次循环;72℃延伸10 min结束。引物名称及序列如表1所示。
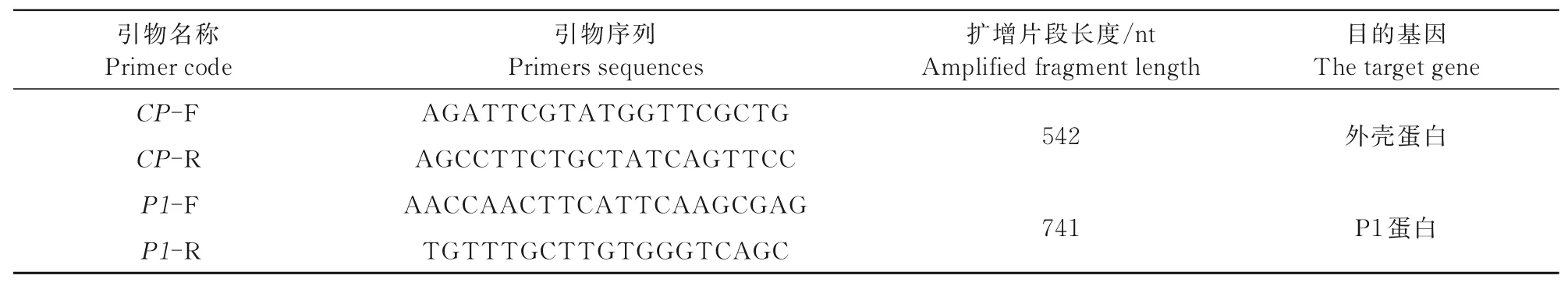
表1 PCR检测病毒引物Tab.1 Pr imer s for PCR detection of viruses
PCR程序运行结束后,配制1%琼脂糖凝胶进行电泳检测病毒条带,在凝胶成像仪下观察电泳结果。
1.2.4 dot-ELISA法检测叶片携带SCMV情况
取试验材料置于研钵中,液氮研磨至粉末状后按样品与缓冲液质量比1∶30的比例加入PBS缓冲液再进行研磨,吸入研磨液1.5 mL于EP管中4 000 g离心3 min,将细胞碎片沉淀至管底,吸取5μL上清液滴在NC膜表面,静置15 min晾干,加入由含5%脱脂奶粉PBST(1 L 0.01 mol/L PBS中加入500μL Tween 20配制0.01 mol/L PBST,再加入50 g脱脂奶粉于PBST中)稀释5 000倍后的一抗,使一抗与上清液充分结合30 min,0.01 mol/L PBST冲洗4次NC膜以去除多余的一抗液体,用含5%脱脂奶粉PBST包被空白部分,加入由含5%脱脂奶粉PBST稀释8 000倍后的二抗使其与一抗充分结合,0.01 mol/L PBST漂洗6次,去除多余的二抗,加入由底物缓冲液(12.14 g Tris、5.84 g氯化钠、0.475 g氯化镁定容至1 L并用浓盐酸调pH值至9.5)稀释100倍的NBT/BCIP底物进行显色反应,显色后观察鉴定结果。
1.3 数据分析
对鉴定结果进行计数,在Microsoft Excel 2019汇总并计算各品种发病率,SPSS Statistics 22分析各品种发病率,检验各条件下矮花叶病的发病率是否具有显著差异。
2 结果与分析
2.1 玉米矮花叶病抗性鉴定结果
统计抗性鉴定结果表明(图1),共有257株植株表现为1级病情级别;2 650株植株表现为3级;3 942株植株表现为5级;4 943株植株表现为7级;273株植株表现为9级。根据每个品种中鉴定植株病情指数计算,共0份品种鉴定为高抗;3份品种(占0.81%)鉴定为抗;27份品种(占7.30%)鉴定为中抗;109份品种(29.46%)鉴定为感;231份品种(占62.43%)鉴定为高感。根据鉴定结果,可知近年来品种抗性丧失严重,抗矮花叶病种质资源稀缺。

根据抗性鉴定结果,筛选18个高感品种作为后续试验材料,进行盆栽试验与田间试验。
2.2 种子携带SCMV与种传玉米矮花叶病试验结果分析
选取抗性鉴定中表现为高感品种的干种子,鉴定干种子中携带病毒情况。18个品种的干种子6次混检结果表明,在干种子中未能检测到SCMV病毒。
根据上述结果,对筛选出的高感品种新鲜种子进行RT-PCR检测,结果如图2所示。结果表明,3次重复中共有3个品种的新鲜种子中含有SCMV,病毒可从母体中传入子代。
为进一步探究种内病毒是否可以传入子代植株中,本试验设计温室盆栽种植,并对幼苗进行RT-PCR检测,检测结果如图3所示。结果表明,111个样品中共有2株幼苗检测到SCMV病毒,病毒可从干种子中随寄主植物生长而大量繁殖,达到检测水平。


2.3 蚜虫传播玉米矮花叶病毒检测结果分析
为探究蚜虫对传播玉米矮花叶病毒的影响,2020年10月中旬从发病叶片采集玉米蚜、麦长管蚜保存于-80℃冰箱中,2021年5月于夏玉米田前茬作物小麦上采集麦长管蚜、麦二叉蚜对其进行病毒检测,并接种至幼苗,对冬前蚜虫、春季玉米播前蚜虫、春季麦芽取食的玉米盆栽幼苗叶片、未接种蚜虫玉米盆栽幼苗叶片以及阳性对照进行RTPCR检测。检测结果如图4所示,冬前蚜虫口针上可检测相对较高含量的SCMV;春季蚜虫口针上检测到相对较低含量的SCMV,并且被春季蚜虫取食的玉米幼苗叶片也可检测到一定含量的SCMV;未被蚜虫取食的玉米幼苗叶片未检测到SCMV。

2.4 不同播种时间环境蚜虫对SCMV传播的影响
经上述试验,已明确春季玉米播种后主要的病毒来源为种子带毒和蚜虫传毒。由于蚜虫为非持久型传毒,其携带的病毒源于带毒种子萌发或是非作物生境尚不清楚,故设计盆栽与田间试验,以多个高感品种作试验材料,降低不同高感品种对试验结果的影响,明确不同环境下蚜虫传播玉米矮花叶病毒影响差异,设置阴性与阳性对照验证每次处理的检测灵敏度,其中,阳性对照均来自同一样品。
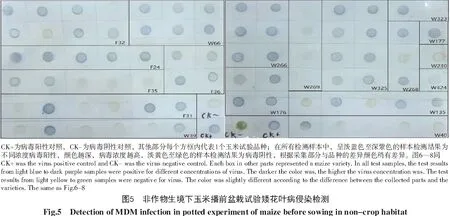
对播种前蚜虫传毒效率进行测定,种植感病品种30 d后,用dot-ELISA手段检测所有品种发病率,结果如图5所示,其中,绿色斑点样品中不含有SCMV;蓝色或深紫色斑点为样品中携带SCMV。该试验盆栽置于非作物生境下,田间玉米播种前种植,以检测在播前蚜虫与非作物生境对于SCMV传播的能力。结果表明,F24共检测5株样本,5株呈阳性;F31共检测6株样本,3株呈阳性;F32共检测8株样本,6株呈阳性;F35共检测5株样本,2株呈阳性;F36共检测4株样本,4株呈阳性;W39共检测6株样本,2株呈阳性;W40共检测5株样本,1株呈阳性;W66共检测6株样本,6株呈阳性;W135共检测5株样本,3株呈阳性;W176共检测4株样本,4株呈阳性;W177共检测1株样本,1株呈阳性;W230共检测1株样本,0株呈阳性;W266共检测6株样本,6株呈阳性;W268共检测3株样本,2株呈阳性;W269共检测4株样本,0株呈阳性;W323共检测2株样本,1株呈阳性;W324共检测1株样本,1株呈阳性;W325共检测8株样本,8株呈阳性。
对播种时期田间环境下蚜虫传毒效率进行测定,结果如图6所示。该试验盆栽置于田间玉米播种区,于播种期同时种植,以检测蚜虫在播种期时间范围,无田间初侵染幼苗的毒源条件下,从环境获取并传播SCMV的能力。结果表明,F24共检测8株样本,6株呈阳性;F31共检测5株样本,4株呈阳性;F32共检测9株样本,8株呈阳性;F35共检测7株样本,7株呈阳性;F36共检测4株样本,4株呈阳性;W39共检测8株样本,6株呈阳性;W40共检测6株样本,6株呈阳性;W66共检测6株样本,4株呈阳性;W135共检测8株样本,6株呈阳性;W176共检测4株样本,1株呈阳性;W177共检测7株样本,7株呈阳性;W230共检测1株样本,1株呈阳性;W266共检测6株样本,3株呈阳性;W268共检测6株样本,5株呈阳性;W269共检测7株样本,4株呈阳性;W323共检测6株样本,6株呈阳性;W324共检测3株样本,3株呈阳性;W325共检测8株样本,4株呈阳性。

对播种时期杂草环境下蚜虫传毒效率进行测定,结果如图7所示。该试验盆栽置于玉米播种区周边杂草茂密区,于播种期同时种植,以检测蚜虫在播种期时间范围,无田间初侵染幼苗的毒源条件下,从杂草环境获取并传播SCMV的能力。结果表明,F24共检测9株样本,9株呈阳性;F31共检测7株样本,5株呈阳性;F32共检测8株样本,8株呈阳性;F35共检测4株样本,2株呈阳性;F36共检测5株样本,3株呈阳性;W39共检测6株样本,3株呈阳性;W40共检测5株样本,4株呈阳性;W66共检测8株样本,7株呈阳性;W135共检测6株样本,3株呈阳性;W176共检测8株样本,6株呈阳性;W177共检测4株样本,3株呈阳性;W230共检测2株样本,1株呈阳性;W266共检测8株样本,6株呈阳性;W268共检测7株样本,5株呈阳性;W269共检测10株样本,8株呈阳性;W323共检测8株样本,7株呈阳性;W324共检测2株样本,1株呈阳性;W325共检测8株样本,7株呈阳性。

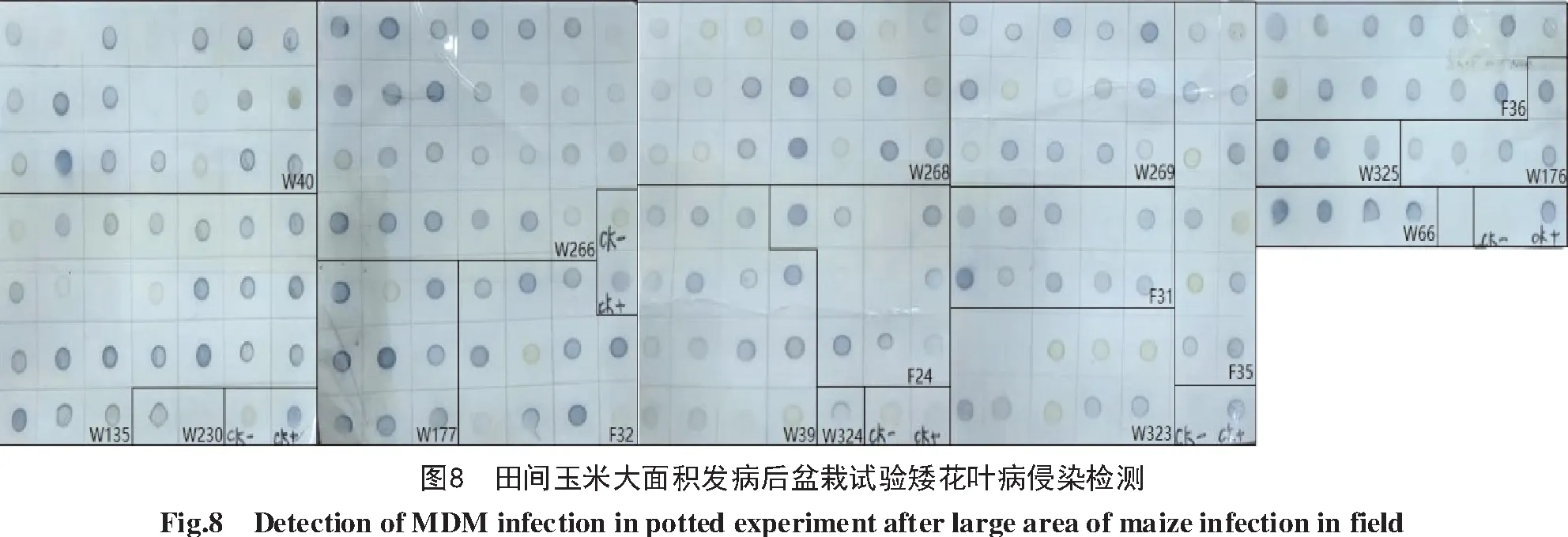
对播种后田间大面积发生矮花叶病时期蚜虫传毒效率进行测定,结果如图8所示。该试验盆栽置于田间玉米区,以检测蚜虫在田间已具备大量毒源条件下,从发病植株获取并传播SCMV的能力。结果表明,F24共检测10株样本,7株呈阳性;F31共检测10株样本,9株呈阳性;F32共检测11株样本,8株呈阳性;F35共检测12株样本,8株呈阳性;F36共检测13株样本,13株呈阳性;W39共检测15株样本,14株呈阳性;W40共检测21株样本,16株呈阳性;W66共检测4株样本,4株呈阳性;W135共检测24株样本,20株呈阳性;W176共检测5株样本,5株呈阳性;W177共检测9株样本,8株呈阳性;W230共检测2株样本,1株呈阳性;W266共检测27株样本,26株呈阳性;W268共检测21株样本,16株呈阳性;W269共检测15株样本,12株呈阳性;W323共检测10株样本,4株呈阳性;W324共检测1株样本,1株呈阳性;W325共检测3株样本,3株呈阳性。
对上述结果进行整理,统计同一时期同一品种 的材料发病率,结果如表2所示。
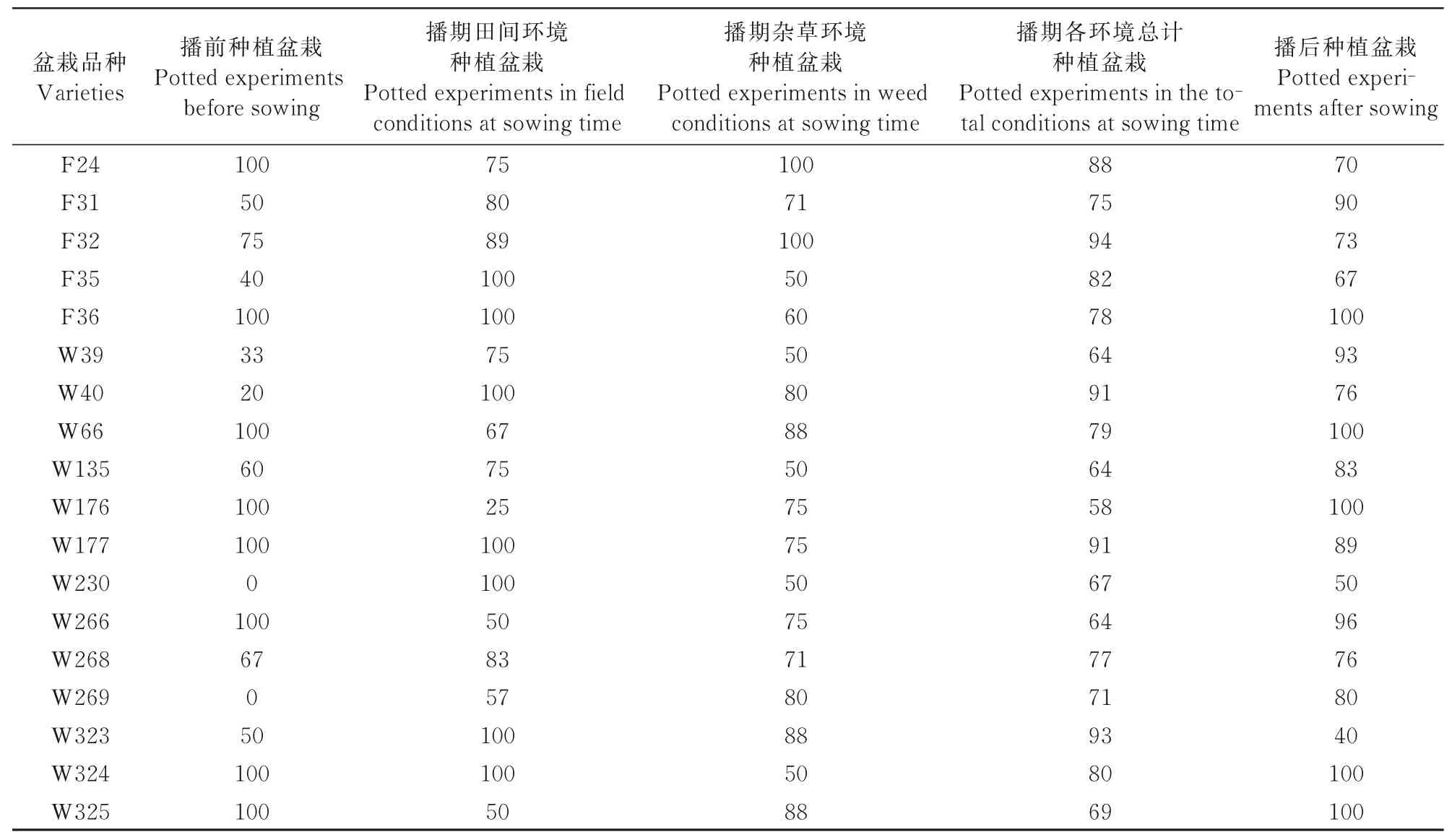
表2 不同时期、环境高感品种发病率统计Tab.2 Incidence statistics of high sensitive varieties in different periods and environments %
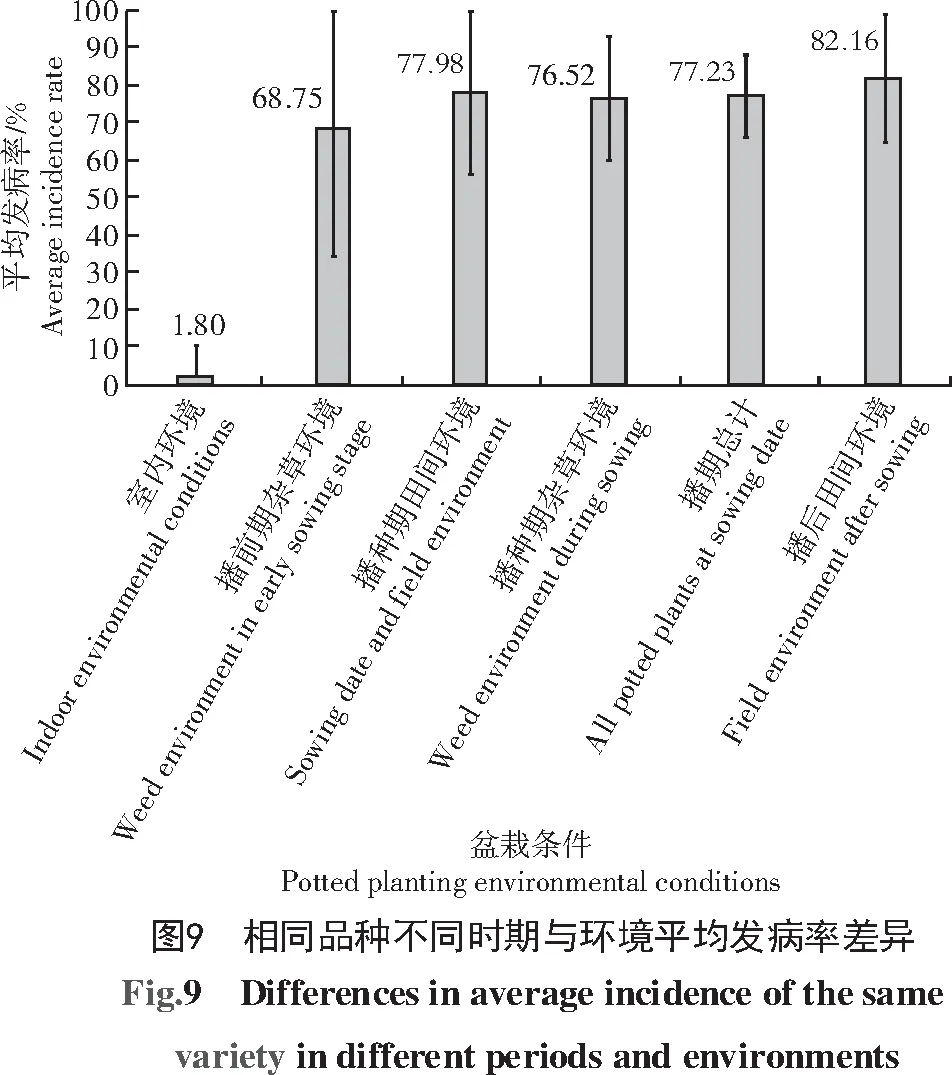
通过对不同品种不同时期发病率进行方差分析与差异显著性检验,分析不同播期蚜虫传播玉米矮花叶病差异、不同生长环境蚜虫传播玉米矮花叶病差异。对盆栽隔离蚜虫与不隔离蚜虫试验结果表明(表3、图9),无蚜虫取食的18个玉米品种发病率仅为1.8%,而有蚜虫取食的18个玉米品种在不同种植时期、不同种植环境中其平均发病率分别为68.75%、77.98%、76.52%、77.23%和82.16%,结果表明,无蚜虫取食的盆栽植株,其发病率符合前人研究的矮花叶病自然发病率范围[17];通过分析图5中的检测结果与播种前植株发病率,表明春季麦蚜具备传播SCMV病毒的能力,并从非玉米植物上获取病毒;分析不同时期植株受侵染效率,结果表明,随着时间递增蚜虫传播SCMV能力持续增长,随播种时期推迟,同一周期内植株发病率变高;对比同一时期不同环境下植株发病率,杂草环境发病率略低于田间环境,多重比较分析结果表明,8月2日至9月1日间蚜虫传播SCMV的效率显著高于4月10日至5月10日,由4月份到6月份,终至9月份,蚜虫对于SCMV的传播效率递增。

表3 不同条件下植株发病率差异显著性分析Tab.3 Analysis of the significance of plant incidence differences under different conditions
3 结论与讨论
玉米矮花叶病可由种子带毒、农事操作、玉米锈菌携毒及包括麦二叉蚜、麦长管蚜、禾谷缢管蚜、玉米蚜等小麦—玉米轮作田中常见的蚜虫以非持久性的方式传播[18],本研究通过设计几个不同的种植时期与环境盆栽及田间试验,证明了蚜虫在SCMV病毒传播中的重要作用。在干种子中并未检测到病毒可能是干种子不带病毒或其中存在的病毒量未达到RT-PCR的检测最低水平。前人研究表明,绝大多数病毒在种子脱水、贮藏、越冬过程中丧失活性或被降解[19],故本研究追加了对鲜种子的RT-PCR检测,结果显示,有3个品种的新鲜种子中可检测到SCMV,说明本试验的种子极有可能具有较高种传率,但无法避免脱水带来的病毒损耗。通过对干种子萌发后生长的幼苗进行RTPCR检测,结果表明,在未检测到含有SCMV的干种子萌发后,其含有的极微量病毒重新开始复制并达到RT-PCR检测范围,故病毒检测结果呈阳性。上述结论证明,SCMV以种子带毒的形式将亲本体内含有的SCMV,于母体成熟籽粒中传播给子代,籽粒经脱水、干燥、贮藏损失了大部分病毒,使绝大多数种子内的病毒失去复制能力,仅有0.05%~2.20%的种子中携带完整的SCMV粒子,并随寄主萌发生长开始复制,于子代中恢复活性,造成初期的田间矮花叶病。
对比温室盆栽的自然发病率与室外盆栽的自然发病率,温室条件下无蚜虫取食植株叶片,其发病的唯一条件为种子带毒,其发病率为1.8%,3个不同时期室外盆栽的发病率分别为68.75%、77.23%和82.16%,蚜虫传毒使玉米植株发病率提高了36~46倍,表明蚜虫传播SCMV是田间玉米矮花叶病流行中最重要的因素。蚜虫以非持久性方式传播SCMV,病毒仅能在蚜虫口针上存留数分钟到1 h[20],这种特殊的传播方式表明病毒无法储备于蚜虫体内进行越冬。根据PCR检测结果,冬前玉米蚜与残留的麦蚜体内存在大量病毒,而春季麦蚜体内存在少量病毒,可以推断,冬前玉米蚜体内病毒随时间或蚜虫的死亡被降解或流入环境,可能保存于多年生杂草中[5]或更多的寄主体内,春季麦蚜重新从环境中获得该病毒,检测其取食的叶片表明,春季播种的玉米植株可受到麦蚜的取食并感染SCMV,春季麦蚜具备传播SCMV的能力,检测未被蚜虫取食的叶片结果呈阴性表明,蚜虫传毒是使健康植株患矮花叶病毒的原因。由此推断设计试验,在同一时期种植2组分别放置在杂草茂盛区域与田间未播种区域的盆栽,结果表明,杂草区发病率并未高于田间未播种区盆栽的发病率,表明杂草环境中蚜虫传播效率与田间环境中蚜虫传播效率差异较小,可能存在其他重要条件影响蚜虫的传播效率。此前,我国学者杨士华等[8]通过检测田间蚜虫消长与矮花叶病的发病规律,从另一角度也证实蚜虫大面积发生与矮花叶病的流行存在显著的因果关系。
本试验分别于玉米播种前、播种期、播后田间大面积发生矮花叶病时期种植植株检测蚜虫传毒效率,结果表明,随玉米种植时间推迟,同一周期内植株发病率递增,直至显著水平。并通过设计多种盆栽试验,以控制多个变量,包括蚜虫变量、区域变量、时期变量探究了玉米矮花叶病的有利发病条件。研究结果表明,蚜虫传毒是矮花叶病高效传播中最重要的因素,其将矮花叶病的发病率可提高至种传的36~46倍;在对不同状态的种子带毒率测定结果,验证了马占鸿等[21]对于SCMV由母体可传给子代的设想,并同时证实了学者李莉[19]的研究,即种子在脱水过程中病毒存在一定损耗。由于本试验侵染周期仅为30 d,随时间推移,侵染植株数量仍将持续增长,为确保试验不受盆栽数量的限制,本盆栽及田间试验确定在30 d,避免由于盆栽过少导致所有植株均产生矮花叶病,无法比较差异。本试验结果可能预示着玉米矮花叶病毒的越冬场所不仅只有种子与杂草,可能还存在其他的越冬环境,如土壤微生物等,并推测这种可能存在的中间寄主通过自身抵抗或躲避低温的手段同样保护了其携带的病毒。但试验在设计中发现,选取杂草环境时有一定困难,不能确定准确的杂草环境病毒源,只能以杂草丰富度作为选择的优先级。根据本试验结论,SCMV可由上年冬季种子、蚜虫传播至包括杂草的环境因素保存越冬,至来年春季带毒种子萌发、蚜虫取食杂草和植株与其他病毒越冬场所等造成田间矮花叶病大面积发生,其中,种传仅占小部分发病因素,绝大多数发病是由蚜虫传毒造成的,因此,预防玉米矮花叶病主要依赖于播种前后蚜虫的防治。如后续研究需要进一步分析是否存在其他越冬环境时,试验应准确控制环境中杂草种类,避免未鉴定的潜在杂草寄主影响试验结果。
