S100A14在乳腺癌紫杉烷类新辅化疗疗效中的表达差异及临床意义
2022-03-17刘易陇覃小貌郑卓婷曾珍万润宇
刘易陇 覃小貌 郑卓婷 曾珍 万润宇
摘要: 目的 分析S100A14在乳腺癌紫杉烷类新辅化疗中的表达情况及临床价值。方法 收集紫衫烷类新辅化疗乳腺癌患者的基因表达谱数据和临床信息,分析S100A14的表达差异以及与临床特征的相关性,并采用多因素logistic回归分析其临床价值。结果 与pCR组相比,RD组患者ER、PR阳性状态比例以及S100A14表达水平更高,ER、PR阳性状态组患者S100A14表达水平显著提高,且S100A14高表达是乳腺癌紫衫烷新辅助化疗疗效的独立危险因素(P<0.05)。结论 S100A14可能是乳腺癌紫衫烷类新辅助化疗结局的潜在预测分子和治疗靶点。
关键词:S100A14;乳腺癌;紫衫烷;表达差异;疗效
【中图分类号】 R737.9 【文献标识码】 A 【文章编号】2107-2306(2022)03--02
Abstract:Objective To investigate the differential Expression and clinical significance of S100A14 in taxane-based neoadjuvant chemotherapy in breast cancer. Methods Data sets and clinical information of expression profiles were collected. The correlations between variables and multivariate logistic regression analysis were used to identify risk factors. Results Higher proportions of ER-positive, PR-positive and the higher expression level of S100A14 were discovered in the pathologic complete response group. The expression level of S100A14 in ER-positive, PR-positive group was significantly increased. High S100A14 expression was an independent risk factor for taxane-based neoadjuvant chemotherapy in breast cancer(P<0.05). Conclusion S100A14 could be a potential predictive biomarker and therapeutic target in taxane-based neoadjuvant chemotherapy in breast cancer.
Key words:S100A14; Breast cancer; Taxane; Differential expression;Efficacy
乳腺癌是女性最常見肿瘤,也是女性癌症死亡的主要原因[1]。以紫杉烷和蒽环类为基础的新辅助化疗方案是晚期乳腺癌的重要治疗选择之一。然而,不同分子亚型以及临床特征的患者具有不同的紫衫烷类治疗响应及预后[2]。因此,提前预测紫衫烷类药物的化疗敏感性,是实现乳腺癌个体化药物治疗的基础。
S100A14基因位于染色体1q21.3位点,编码低分子量的EF手型钙结合蛋白,其异常表达与多种肿瘤不良预后密切相关[3]。据报道,S100A14在乳腺癌中过度表达,并调节乳腺癌的转移、侵袭、分化等生物学功能[4]。然而,S100A14在乳腺癌紫衫烷类化疗结局中的表达差异及临床价值鲜有报道。
本研究通过分析基因表达数据库 (Gene Expression Omnibus,GEO)中的公共数据集,以探究S100A14在乳腺癌紫杉烷类新辅化疗疗效中的表达差异以及对化疗结局的影响,为进一步研究S100A14在紫衫烷类耐药中的作用机制提供参考。
1 材料与方法
1.1 数据集下载及预处理
从GEO检索并下载GSE25066数据集的表达谱芯片原始数据及临床信息,利用R语言affy包中的RMA算法进行芯片数据背景信号校正、标准化,impute包中的KNN算法补充缺失值,sva包中的ComBat算法去除批次效应,利用芯片注释文件进行探针注释,并对同一个基因的多个探针表达值取均值,获得GSE25066数据集基因表达谱矩阵用于后续分析。
1.2 S100A14与乳腺癌临床特征及化疗响应的相关性分析
从经过预处理的GSE25066数据集中提取S100A14表达数据,以及年龄、雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体2(HER2)、T分期、N分期、Stage分期以及化疗后病理响应临床信息,分析S100A14表达水平与临床病理特征的相关性,并采用多因素logistic回归分析确定S100A14表达水平对化疗结局的影响。
1.3 统计方法
采用SPSS19.0和R4.0.3统计软件进行数据分析。计数资料采用构成比表示,组间比较采用两独立样本卡方检验。正态性计量资料采用均数±标准差表示,组间均数比较采用单因素方差分析,P<0.05为差异具有统计学意义,并进行多因素Logistic回归分析(自变量纳入标准α=0.05,删除标准α=0.10)。
2 结果
2.1 基本信息
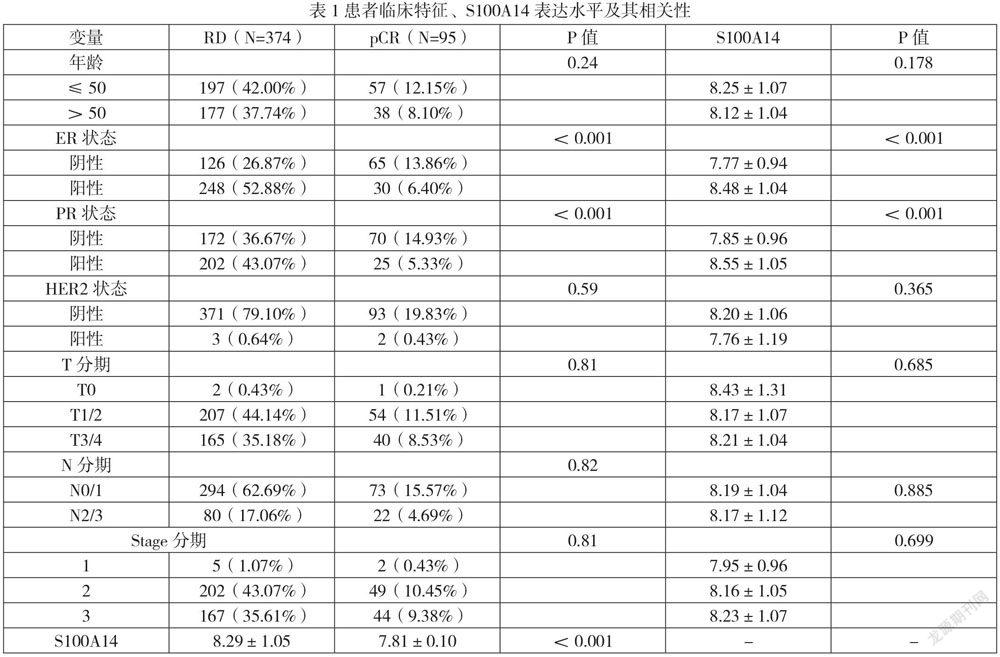
在GSE25066数据集中,包括508例使用紫衫烷-蒽环类新辅助化疗方案(ER阳性患者加内分泌治疗)的乳腺癌患者。剔除临床信息缺失患者后,最终共纳入469例患者用于分析,包括化疗后病理完全缓解(Pathologic complete response,pCR)患者95例(20.26%),残留病灶(Residual disease,RD)患者374例(79.74%),且化疗后RD组患者ER、PR阳性状态比例更高(P<0.05),提示ER、PR状态与乳腺癌紫衫烷类新辅化疗后病理响应结局相关。患者临床特征信息见表1。
2.2 S100A14表达水平与化疗响应及临床特征相关性
经化疗后RD、ER阳性以及PR阳性组患者的S100A14表达水平显著高于其他组患者(P<0.05),提示S100A14表达水平与乳腺癌紫衫烷类新辅化疗疗效、ER状态、PR状态相关,结果见表1。
2.3 S100A14是乳腺癌紫衫烷类新辅化疗疗效的独立危险因素
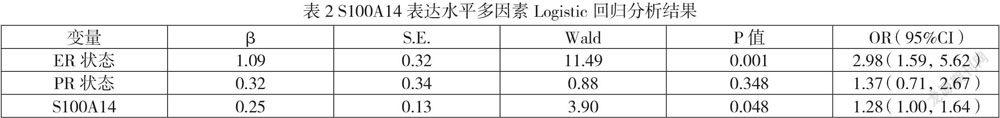
以紫衫烷类新辅化疗疗效为因变量,以ER状态、PR状态、S100A14表达量为自变量,采用进入法(Enter)进行多因素Logistic回归分析,结果显示在校正其他临床因素后,S100A14表达水平与化疗疗效差异具有统计学意义(P<0.05),且OR值大于1,提示S100A14高表达水平是乳腺癌紫衫烷类新辅化疗疗效的独立危险因素,结果见表2。
3 讨论
紫杉烷类药物作为乳腺癌新辅助化疗一线药物,化疗响应率约50%,而作为二线或三线化疗药物时,响应率降至20%-30%[5],本研究中,紫衫烷类新辅助化疗后患者病理完全缓解率仅占20.26%。紫杉烷类药物的原发或获得性耐药是乳腺癌新辅化疗失败的主要原因[6]。因此,识别影响紫衫烷类化疗疗效的相关风险因素,有助于实现乳腺癌患者的新辅助精准治疗。
傳统上,组织学特征,如ER、HER2、Ki67的表达和组织学分级已被用作紫衫烷类化疗预后和疗效预测标志物[7]。本研究发现,ER、PR阳性状态患者新辅助化疗病理响应结局更差。但这些组织学特征在预测在具有相同组织学特征和疾病亚型的患者中个体对治疗的响应方面的能力有限。
紫杉烷类药物耐药机制是复杂的,与多种耐药相关基因有关,比如免疫相关基因[8]。然而,介导紫衫烷类耐药的主要机制仍然是难以确定的。S100A14蛋白,是低分子量的钙结合蛋白S100家族的成员,在恶性肿瘤中的表达也具有组织器官特异性[9]。有研究发现异常表达的S100A14可能参与以铂类为基础的卵巢癌化疗抵抗[10],提示异常表达的S100A14在肿瘤细胞抵抗药物化疗过程中可能起着重要作用。本研究确认了S100A14的表达水平与患者的ER、PR状态密切相关,同时研究发现高表达S100A14乳腺癌患者紫衫烷类新辅化疗后RD比例更高,而且S100A14高表达是乳腺癌患者紫衫烷类新辅化疗结局的独立危险因素,提示S10014基因有望成为乳腺癌患者紫衫烷类新辅化疗疗效和预后评估的新靶点,但其介导的紫衫烷类化疗耐药的具体生物学机制有待进一步研究,同时有待进一步在乳腺癌新辅化疗患者中对S100A14进行更多的临床研究,以证明其潜在的临床预测价值。
参考文献:
[1] 潘海玲,陈洪雷,陈福春.肝X受体与乳腺癌研究进展[J].中华肿瘤防治杂志,2016,23(13):893-896.
[2]王晓红,丁耘峰,张明,沈俊俊.多西他赛注射液对不同分子亚型乳腺癌患者的临床研究[J].中国临床药理学杂志,2018,34(16):1945-1948.
[3]姚丽,张玲,赵素月,郑莹,王乾合,朱克祥.S100A14在消化系统肿瘤中的研究进展[J].中国普通外科杂志,2021,30(04):482-487.
[4]李旭坤. S100A14在乳腺癌转移中的功能及机制研究[D].北京协和医学院,2019.
[5]Jones S E, Erban J, Overmoyer B, et al. Randomized phase III study of docetaxel compared with paclitaxel in metastatic breast cancer.[J]. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 2005,23(24):5542-5551.
[6]Jiang Y, Yu K, Peng W, et al. Enriched variations in TEKT4 and breast cancer resistance to paclitaxel.[J]. Nature communications, 2014,5:3802.
[7]Andre F, Mazouni C, Liedtke C, et al. HER2 expression and efficacy of preoperative paclitaxel/FAC chemotherapy in breast cancer.[J]. Breast cancer research and treatment, 2008,108(2):183-190.
[8]Fu C, Liu Y, Han X, et al. An Immune-Associated Genomic Signature Effectively Predicts Pathologic Complete Response to Neoadjuvant Paclitaxel and Anthracycline-Based Chemotherapy in Breast Cancer.[J]. Frontiers in immunology, 2021,12:704655.
[9]Basnet S, Sharma S, Costea D E, et al. Expression profile and functional role of S100A14 in human cancer.[J]. Oncotarget, 2019,10(31):2996-3012.
[10] Qian J, Ding F, Luo A, et al. Overexpression of S100A14 in human serous ovarian carcinoma.[J]. Oncology letters, 2016,11(2):1113-1119.
【基金项目】四川省卫计委普及应用项目(编号:18PJ557);四川省医学科研课题(编号:S17062);乐山市重点科技计划项目(编号:18SZD113)
