沉默miR-208a对急性心肌梗死大鼠心室重构的影响及机制研究
2022-03-16刘国星杜见霞刘秀红杜亚军但国梅王浩董振松
刘国星 杜见霞 刘秀红 杜亚军 但国梅 王浩 董振松
急性心肌梗死是一种由冠状动脉急性、持续性供血、供氧不足而导致的心肌组织细胞坏死症状[1,2]。急性心肌梗死患者主要临床表现为胸骨后持久、剧烈疼痛,对患者生活质量、身体健康造成严重的威胁[3,4]。据世卫组织统计数据显示,老年人为急性心肌梗死的高发群体,近年来我国人口老龄化现象愈发严重,急性心肌梗死新增病例连年上升[5,6]。目前临床医学尚无特效的针对急性心肌梗死的药物、治疗手段,急性心肌梗死症状的发生发展对患者生命安全造成严重威胁,因此探究急性心肌梗死发病机制,寻找新的治疗靶点,对急性心肌梗死的治疗具有重要意义。本研究建立急性心肌梗死大鼠模型,靶向调控miR-208a表达,报告如下。
1 材料与方法
1.1 材料 选取40只SD健康雄性大鼠,由吉林大学动物实验中心提供,年龄9~10个月,平均(9.5±0.4)个月;体重219~232 g,平均体重(226.1±5.2)g。在相对湿度45%~55%、温度(24.1±2.2)℃的环境中喂养大鼠1周,光照12 h/d。本研究医我院伦理委员会批准。主要试剂:兔抗大鼠miR-208a抗体(Hyclone公司);兔抗小鼠Bcl-2抗体(Invitrogen公司);大鼠抗小鼠Caspase-3、TGF-β1抗体(Gibco公司);小鼠抗大鼠谷胱甘肽过氧化物酶(GSH-Px)抗体(BD公司);小鼠抗兔过氧化脂质(LPO)、丙二醛(MDA)抗体(Sigma公司);大鼠抗小鼠Smad2、Smad3抗体(Selleck公司)。
1.2 方法
1.2.1 建模及分组:随机选取10只大鼠作为正常组,不做任何处理。其余30只大鼠建立急性心肌梗死模型:麻醉干预后,使用剪刀将左侧第3、4段肋间皮肤剪开,打开大鼠胸腔,使大鼠心脏组织暴露于术野之中。剪开心包膜后对冠状动脉前支进行穿线结扎,之后清创缝合。对所有大鼠进行心电图检查,ST段上抬至弓背向上为建模成功。最终建模成功25只,将25只急性心肌梗死大鼠随机分为沉默miR-208a组(n=9)以及模型组(n=8)、过表达miR-208a组(n=8)。过表达miR-208a组大鼠尾部静脉注射30 mg/kg agomiR-208a,沉默miR-208a组大鼠尾部静脉注射30mg/kg antagomiR-208a,正常组、模型组大鼠尾部静脉注射等量0.9%氯化钠溶液。
1.2.2 心功能检测:对大鼠麻醉处理后,左倾30°仰卧固定,剃毛后将超声探头置于左胸骨,与中线夹角20°,观察记录4组大鼠左心室舒张末期内径(LVEDd)、左心室舒张末期容积(LVEDV)、左心室收缩末期内径(LVESd)水平。
1.2.3 标本制备:取4组大鼠尾部静脉血2 ml,2 000 r/min离心处理15 min后分离上清液,在-80℃环境中保存待检。对各组大鼠进行麻醉处理后,断头法处死,取大鼠心脏,清洗后观察外观,之后固定在4%甲醛中,完全浸泡,于24 h后行常规石蜡包埋及连续切片。
1.2.4 HE染色:首先将切片烤干后进行脱蜡处理,之后顺序置入不同浓度的乙醇中各复水3 min。使用苏木精染色15 min后清洗3次,使用盐酸乙醇分化处理30 s,充分清洗之后使用1%伊红染色,使用乙醇进行脱水处理后进行脱蜡处理,封片后使用显微镜进行观察。
1.2.5 心肌梗死面积、心肌细胞凋亡情况检测:在1% TTC溶液中孵育大鼠心肌组织切片20 min(孵育环境:避光,温度保持在37℃),使用BI-2000医用图像分析系统计算大鼠心肌梗死面积。使用TUNEL法检测大鼠心肌细胞凋亡情况,计算心肌细胞凋亡指数,并进行组间比较。
1.2.6 miR-146a表达检测:RT-PCR检测miR-146a表达。提取细胞总RNA,检测RNA纯度、含量,逆转录处理后获得cDNA,设计引物序列,采用2-△△Ct方法计算miR-146a表达。
1.2.7 B淋巴细胞瘤-2基因(Bcl-2)、半胱氨酸天冬氨酸蛋白酶3(Caspase-3)、转化生长因子-β1(TGF-β1)、果蝇MAD类似基因2(Smad2)、果蝇MAD类似基因3(Smad3)相对表达量检测:蛋白质印迹法检测Bcl-2、Caspase-3、TGF-β1、Smad2、Smad3的表达:取150℃的Ripa裂解液,1.5℃ PMSF冰中孵育30 min,4℃ 1 500 r/min离心15 min,取上清。每个样品取15 g蛋白,聚丙烯酰胺凝胶电泳,转入PDVF膜,5%脱脂牛奶常温下密封2 h。加入抗体过夜。取出后使用TBST液冲洗,结合二抗,60 min后清洗、显色,对Bcl-2、Caspase-3、TGF-β1、Smad2、Smad3相对表达量行检测。
1.2.8 免疫透射比浊法检测GSH-Px、LPO、MDA水平:准备3个试管,记为标准管、测定管、空白管,均添加缓冲液350 μl,标准管加入20 μl GSH-Px、LPO、MDA标准液,测定管中加入20 μl血清,空白管中加入20 μl蒸馏水3个试管分别摇晃均匀,常温环境静置5~10 min后使用分光光度计进行比色,在500 nm波长处以空白管调零,记录吸光度,计算血清GSH-Px、LPO、MDA水平。
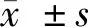
2 结果
2.1 4组大鼠心脏外观、心肌组织病理学观察情况 正常组大鼠心脏外观颜色较为红润,形态正常,病理切片中心肌组织细胞排列规则且紧密;模型组、过表达miR-208a组大鼠心室腔变大,且出现大面积的梗死区域,心肌组织细胞排列杂乱,出现较多胶原纤维;沉默miR-208a组大鼠心室腔扩大现象出现缓解,梗死区域明显缩小,心肌组织细胞排列较为杂乱,炎性细胞减少。见图1、2。
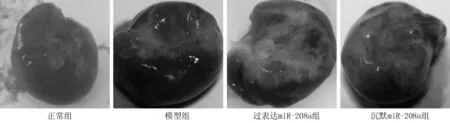
图1 4组大鼠心脏外观情况

图2 4组大鼠心肌组织病理学图片(HE×200)
2.2 4组大鼠miR-208a、Bcl-2、Caspase-3表达比较 与正常组比较,模型组、过表达miR-208a组大鼠miR-208a、Bcl-2、Caspase-3表达较高,且过表达miR-208a组大鼠miR-208a、Bcl-2、Caspase-3表达高于模型组,差异均有统计学意义(P<0.05);与模型组、过表达miR-208a组比较,沉默miR-208a组大鼠miR-208a、Bcl-2、Caspase-3表达较低,差异均有统计学意义(P<0.05)。见表1,图3。

表1 4组大鼠miR-208a、Bcl-2、Caspase-3表达比较

图3 Bcl-2、Caspase-3表达Western blot图;A 正常组;B 模型组;C 过表达miR-208a组;D 沉默miR-208a组
2.3 4组大鼠LVEDd、LVEDV、LVESd水平比较 与正常组比较,模型组、过表达miR-208a组大鼠LVEDd、LVEDV、LVESd水平较高,且过表达miR-208a组大鼠LVEDd、LVEDV、LVESd水平高于模型组,差异均有统计学意义(P<0.05);与模型组、过表达miR-208a组比较,沉默miR-208a组大鼠LVEDd、LVEDV、LVESd水平较低,差异均有统计学意义(P<0.05)。见表2。

表2 4组大鼠LVEDd、LVEDV、LVESd水平比较
2.4 4组大鼠心肌梗死面积、心肌细胞凋亡指数比较 与正常组比较,模型组、过表达miR-208a组大鼠心肌梗死面积、心肌细胞凋亡指数较高,且过表达miR-208a组大鼠心肌梗死面积、心肌细胞凋亡指数高于模型组,差异均有统计学意义(P<0.05);与模型组、过表达miR-208a组比较,沉默miR-208a组大鼠心肌梗死面积、心肌细胞凋亡指数较低,差异均有统计学意义(P<0.05)。见表3。

表3 4组大鼠心肌梗死面积、心肌细胞凋亡指数比较
2.5 4组大鼠GSH-Px、LPO、MDA水平比较 与正常组大鼠相比,模型组、过表达miR-208a组大鼠GSH-Px水平较低,LPO、MDA水平较高,差异均有统计学意义(P<0.05);与模型组、过表达miR-208a组相比,沉默miR-208a组大鼠GSH-Px水平较高,LPO、MDA水平较低,差异均有统计学意义(P<0.05)。见表4。

表4 4组大鼠GSH-Px、LPO、MDA水平比较
2.6 4组大鼠TGF-β1、Smad2、Smad3表达比较 与正常组比较,模型组、过表达miR-208a组大鼠TGF-β1、Smad2、Smad3表达较高,且过表达miR-208a组大鼠TGF-β1、Smad2、Smad3表达高于模型组,差异均有统计学意义(P<0.05);与模型组、过表达miR-208a组比较,沉默miR-208a组大鼠TGF-β1、Smad2、Smad3表达较低,差异均有统计学意义(P<0.05)。见表5,图4。

表5 4组大鼠TGF-β1、Smad2、Smad3表达比较

图4 TGF-β1、Smad2、Smad3表达Western blot图;A 正常组;B 模型组;C 过表达miR-208a组;D 沉默miR-208a组
3 讨论
急性心肌梗死为一种临床较为常见的心内科疾病,会导致机体心肌组织坏死,严重威胁患者身体健康[7,8]。目前临床较为常用的治疗急性心肌梗死的手段包括药物治疗、介入治疗、溶栓治疗等,但是临床疗效并不理想,因此许多专家学者开始致力于急性心肌梗死临床治疗的研究[9,10]。目前为止,临床医学尚未将急性心肌梗死的发病机制研究透彻,许多专家学者通过分子生物学、基础医学等途径对急性心肌梗死发病机制进行研究[11,12]。微小RNA(miRNA)在大多数生物中大量存在,miRNA与机体炎性反应、免疫状态、微生物感染等多种病理学变化具有密切联系。大量研究表明,miRNA的异常表达与心血管疾病的发生发展密切相关,miR-208a为miRNA家族的组成成员,在急性心肌梗死中表达出现明显异常,但是关于调控miR-208a表达对急性心肌梗死干预效果的研究还鲜有报道[13,14]。
有研究表明,miR-208a作为miRNA家族的重要成员,在机体心脏组织病变中具有一定的特异性[15]。Bcl-2是线粒体细胞凋亡通路中的重要基因,其表达的变化与细胞凋亡密切相关[16]。Caspase-3作为caspase家族重要成员,与细胞凋亡密切相关[17]。有学者在研究中表示,急性心肌梗死症状的发生发展与心肌组织细胞凋亡密切相关,Bcl-2、Caspase-3的异常表达在其中发挥重要作用[15]。本研究结果显示,与正常大鼠比较,急性心肌梗死大鼠miR-208a表达较高,说明miR-208a在急性心肌梗死中呈现异常高表达。本研究还发现急性心肌梗死大鼠Bcl-2、Caspase-3表达较高,沉默miR-208a表达的大鼠miR-208a表达下调,同时Bcl-2、Caspase-3表达表达也出现下调,出现这一研究结果的原因可能是沉默miR-208a表达能够靶向调控Bcl-2、Caspase-3表达,从而起到抑制急性心肌梗死大鼠心肌组织细胞凋亡的作用。
急性心肌梗死症状的发生发展会导致心室重构,对机体心功能造成严重的影响[18,19]。LVEDd、LVEDV、LVESd是常用的评价机体心功能的指标。本研究结果显示,相比正常大鼠,急性心肌梗死大鼠LVEDd、LVEDV、LVESd水平异常上升,说明急性心肌梗死大鼠伴随着心室重构状况,沉默miR-208a表达的大鼠LVEDd、LVEDV、LVESd水平出现明显的下降,说明沉默miR-208a表达能够调控LVEDd、LVEDV、LVESd水平,改善大鼠心室重构状况,对大鼠心功能的改善具有积极作用。
急性心肌梗死症状的发生发展伴随着机体心肌组织氧化应激损伤[20,21]。减轻机体心肌组织氧化应激损伤对急性心肌梗死患者的临床治疗、预后改善具有重要意义。GSH-Px、LPO、MDA水平变化情况与机体抗氧化防御系统的失衡、氧化应激损伤严重程度密切相关。本研究结果显示,相比正常大鼠,急性心肌梗死大鼠GSH-Px水平较低,LPO、MDA水平较高,说明急性心肌梗死的发生发展伴随着氧化应激损伤;沉默miR-208a表达的大鼠GSH-Px水平上调,LPO、MDA水平下调,说明沉默miR-208a表达,能够提升急性心肌梗死大鼠抗氧化能力,减轻氧化应激损伤,从而发挥干预效果。
急性心肌梗死的发生发展通常伴随着心肌纤维化,心肌纤维化严重程度与急性心肌梗死严重程度以及患者预后密切相关[22-24]。TGF-β/Smads信号通路相关蛋白与心肌纤维化关系密切。本研究结果显示,急性心肌梗死大鼠TGF-β1、Smad2、Smad3表达较高,沉默miR-208a表达后,急性心肌梗死大鼠TGF-β1、Smad2、Smad3表达出现下调,说明沉默miR-208a表达能够调控TGF-β/Smads通路蛋白,减轻急性心肌梗死大鼠心肌纤维化,从而起到心肌保护作用。
综上所述,沉默急性心肌梗死大鼠miR-208a表达,能够靶向调控Bcl-2、Caspase-3表达,抑制心肌细胞凋亡,改善大鼠心室重构,能够减轻心肌组织氧化应激损伤以及心肌纤维化,为急性心肌梗死的临床治疗提供一定的参考依据。
