葡萄糖改性尿素的反应特征及其对尿素转化率的影响
2022-03-16张英强张水勤李燕婷王立艳赵秉强
张英强,袁 亮,张水勤,李燕婷,王立艳,赵秉强*
[1 中国农业科学院农业资源与农业区划研究所/农业农村部植物营养与肥料重点实验室,北京 100081;2 中国矿业大学(北京)化学与环境工程学院,北京 100083]
尿素是农田氮肥的主要品种,占我国氮肥总量的近65%[1]。尿素施入土壤后很快水解为氨和水,大量的铵极易通过氨挥发、硝化反硝化和淋溶等途径损失,成为环境氮污染的主要来源[2]。
将增效材料与尿素科学配伍,对尿素进行改性以降低尿素的转化速率,提高尿素肥料利用率是当前的一个研究热点。常用的增效剂主要为腐殖酸、海藻酸等天然活性有机高分子。如袁亮等[3]将腐殖酸、海藻酸和氨基酸加入到熔融尿素中制得系列改性尿素,其氮肥表观利用率较普通尿素提高了3.1~15.6个百分点,小麦籽粒产量增加了3.7%~13.6%。Zhang等[4]将腐殖酸与尿素熔融制得腐殖酸改性尿素,其在玉米上施用的增产效果较普通尿素增加了5.6%~8.7%,玉米氮素吸收量提高了11.5%~29.5%。小分子有机物葡萄糖的化学结构简单,同样含有较高反应活性的羟基和醛基官能团。已有研究表明葡萄糖改性尿素可降低尿素损失[5–6]。王彬[7]通过将葡萄糖与尿素在130℃熔融条件下制备出葡萄糖改性尿素,在室内培养试验中,葡萄糖改性尿素短期(1天)内的水解速率低于尿素,在田间试验中,较尿素提高了土壤矿质态氮含量、玉米产量和氮肥表观利用率。陈栓虎等[8]、张蕾等[9]、Viswanathan 等[10–11]研究发现,葡萄糖在加热条件下水解得到的5-羟甲基-2-糠醛 (HMF) 的醛基可能与尿素的胺基发生聚合反应。王彬等[6]通过傅里叶变换红外光谱表征发现葡萄糖加入到熔融尿素中,会与尿素分子发生结合,减少尿素结构中伯酰胺氮含量。赵蕊[12]利用傅里叶红外变换光谱表征发现,尿素胺基可能与糖类醛基发生交联反应,将部分氨基保护起来,减少尿素损失。上述研究表明,葡萄糖中的活性官能团(羟基/醛基)可与尿素发生化学反应。但对葡萄糖与尿素熔融时的反应特征及其产物的具体化学结构研究相对较少,产物的化学结构与减缓尿素水解之间的关系尚不明晰。因此,我们通过傅里叶变换红外光谱法(FTIR)、X射线光电子能谱法(XPS)和液相色谱-质谱联用(LC-MS)等方法,研究了葡萄糖与尿素的反应位点及其产物化学结构,通过生物脲酶法探究葡萄糖对尿素转化调控效应与反应产物结构之间的关系,旨在为高效氮肥研发提供理论和技术依据。
1 材料与方法
1.1 试验仪器与试剂
Nicolet IS10红外光谱仪(FTIR,美国Nicolet公司),ESCALab250型X射线光电子能谱仪(XPS,美国 Thermo Scientific 公司),安捷伦 Agilent 1100高效液相色谱仪(HPLC,日本岛津公司)–Thermo Scientific TSQ Quantum Ultra 质谱联用 (LC-MS,安捷伦Agilent公司和美国Thermo Scientific公司)。
葡萄糖(Glucose,Glu,分析纯,国药集团化学试剂有限公司),尿素(Urea,分析纯,含量≥99.0%,国药集团化学试剂有限公司),脲酶试剂(活力:~1 U/mg,Sigma公司)。
1.2 葡萄糖改性尿素的制备
将葡萄糖(Glu)按照10%的添加量加入到130℃熔融尿素中,搅拌30 s,冷却后粉碎,过0.15 mm筛,制得葡萄糖改性尿素(GluU)[6]。同时制备仅熔融不添加葡萄糖的普通尿素(U)作为对照。将以上样品利用FTIR、XPS和LC-MS等仪器表征其特征。预试验表明,当葡萄糖添加量较小时,葡萄糖改性尿素中葡萄糖与尿素的反应产物含量过低,未达到仪器检测阈值范围,因此,选择添加10%的葡萄糖与尿素熔融反应后所得产物进行结构表征,以明晰葡萄糖与尿素之间的反应特征,而添加量的变化对结构表征过程中反应产物的结构无影响。
同时参考上述肥料制备方式,分别制备葡萄糖添加比例分别为0.2%、0.5%和1.0%,反应时间30 s的葡萄糖改性尿素系列,分别记为GluU0.2、GluU0.5和GluU1.0,同时制备仅熔融不添加葡萄糖的普通尿素(U)作为对照。供试尿素性质见表1。
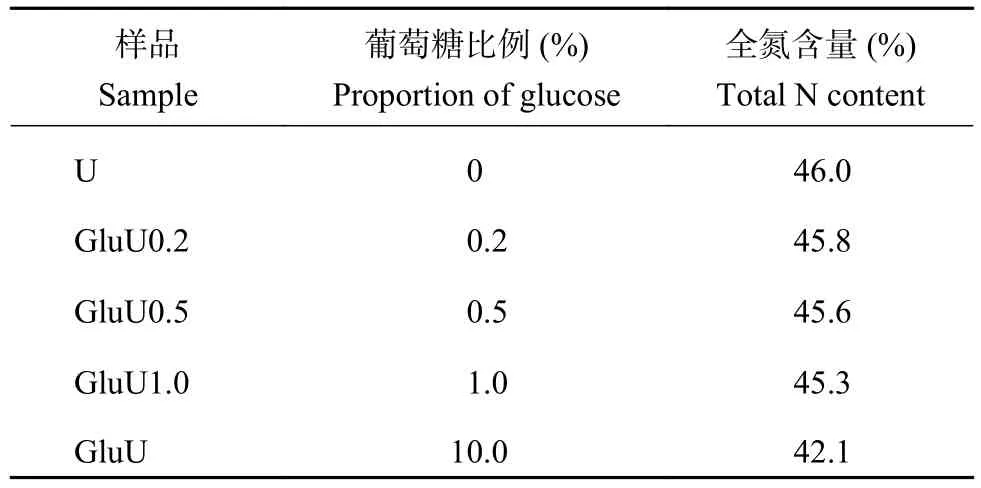
表1 供试尿素中葡萄糖添加比例及含氮量Table 1 Additive proportion of glucose and N content in prepared urea
1.3 材料结构表征
1.3.1 官能团结构测定试验通过美国尼高力公司的IS10型红外光谱仪对材料官能团结构分析。测试条件:将2 mg样品和200 mg光谱纯溴化钾混合后,在红外灯的烘烤下进行研磨、压片,通过傅里叶红外光谱仪记录 4000 cm–1~400 cm–1波段内样品的红外光谱特征。每个样品扫描32次,分辨率为4 cm–1。
1.3.2 供试肥料表面原子成键测定试验通过美国赛默飞公司的ESCALab250型X射线光电子能谱仪对材料表面元素组分、化学价态和形式进行表征。测试条件:激发源为单色化Al Kα X射线,功率为150 W。分析时的基础真空约为 6.5×10–10mbar。结合能用烷基碳 C 1s峰 (284.8 eV)校正。
1.4 供试尿素有机组分测定
试验通过安捷伦公司的1100高效液相色谱仪和赛默飞TSQ Quantum Ultra质谱联用分析样品的物质组成。测试过程中流动相为乙腈∶水= 95∶5,流速为0.3 mL/min;质谱的离子源为电喷雾离子源,模式为ESI positive,电离电压为8 kV,鞘气压力为45 psi,辅助气压力为15 psi,毛细管温度为350℃,以液相色谱进样方式进入,不流入色谱柱,进入质谱仪进行分析。
1.5 尿素转化率测定
依据GB/T 35113—2017标准,将制得的GluU0.2、GluU0.5、GluU1.0和U分别加入脲酶溶液(活力 ~1 U/mg),置于(25±2)℃恒温箱中培养30 min后,在分光光度计上比色,计算尿素分解率[13]。
尿素分解率 (%) = (初始尿素态氮含量–转化后剩余尿素态氮含量)/初始尿素态氮含量×100
1.6 数据处理方法
傅里叶变换红外光谱图用OMNIC 9.0软件进行基线校正和数据平滑校正,所有数据采用Origin 2021进行绘图,采用SPSS 17.0和Duncan新复极差法进行方差分析和处理间差异显著性分析(P<0.05),采用XPS PEAK41软件对XPS数据进行分峰拟合。
2 结果与讨论
2.1 葡萄糖改性尿素的官能团结构
由傅里叶变换红外光谱(图1)可知,与Glu和U相比,GluU保留了更多的普通尿素U特征,表现为在3441 cm–1左右出现了伯胺NH2反对称伸缩振动,3348 cm–1左右出现了NH2对称伸缩振动,1680 cm–1处出现了伯酰胺 C=O 伸缩振动,1625 cm–1左右出现了NH2变角振动,1466 cm–1左右出现了伯胺C―N伸缩振动,1154 cm–1左右出现了脂肪族伯铵C―N伸缩振动。不同的是,与U相比,GluU在1599 cm–1并没有出现伯酰胺NH2变角振动,且GluU 在 3441 cm–1~3348 cm–1范围伯胺 NH2双峰伸缩强度减弱,推测葡萄糖与尿素胺基发生反应,影响了―NH2的振动强度,这与王彬等[6]发现10%的葡萄糖添加量熔融尿素在1600 cm–1处伯酰胺NH2变角振动消失的结果相吻合[6,14]。与Glu相比,GluU同样在1078~1034 cm–1左右出现糖类C―OH伸缩振动,这与Mohsin等[15]表征葡萄糖结构结果一致,但不同的是 Glu 在 3441 cm–1~3348 cm–1的糖类 O―H 伸缩振动峰的振动强度和峰宽均低于GluU,这可能是GluU同时含有―OH和―NH2,二者在此处的特征峰发生堆叠,形成一个较宽的特征峰。红外光谱对材料官能团结构进行了初步的分析但是由于特征峰的重叠,不能准确地判定葡萄糖与尿素发生反应的官能团结构,还需要通过XPS和LC-MS等手段对材料做进一步分析。
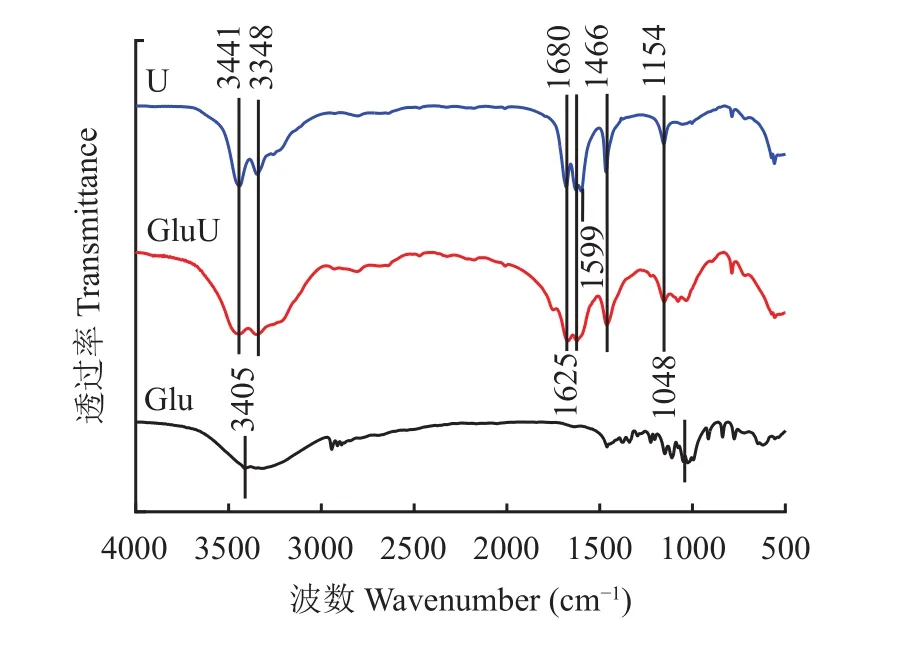
图1 傅里叶变换红外光谱Fig. 1 FTIR spectra of samples
2.2 葡萄糖改性尿素的表面原子成键
由U、GluU和Glu的XPS全谱图(图2)可知,GluU和U中主要含有C、N、O 3种元素,Glu中主要含有C、O两种元素。XPS测得的各元素相对含量为测试材料表面10 nm以内的相对原子百分比含量。对GluU、U和Glu所含各元素所在区间进行窄扫,其分峰拟合图见图3、图4和图5,各材料表面元素及元素不同形态的相对含量见表2、表3和表4。由表面元素含量(表2、表3和表4)对比可知,与普通尿素相比,葡萄糖与尿素熔融后,葡萄糖改性尿素中碳元素和氮元素所占比例有所降低,而氧元素所占比例有所增加,这是由于葡萄糖不含氮元素,其碳元素含量为51.2%,低于普通尿素13个百分点;葡萄糖氧元素含量为48.8%,高于普通尿素30.9个百分点。
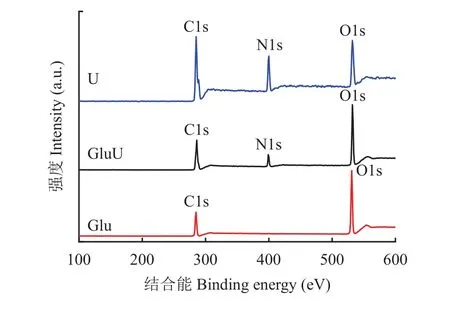
图2 XPS全谱图Fig. 2 The XPS full spectra of samples
由XPS C 1s分峰拟合结果(图3和表2)可知,普通尿素U中有两个不同碳类型的峰,结合能分别为289.0和284.8 eV,其中位于284.8 eV处的峰属于空气中污染碳,不参与尿素分子中碳类型的认定,因此普通尿素中的碳是以酰胺态碳(N―CO―N,289.0 eV)的形式存在[16]。Glu存在3个不同碳类型的峰,结合葡萄糖分子结构判断,这3种碳类型分别是醛基碳(―CHO,286.6 eV)、羟基碳(C―OH,285.2 eV)和亚甲基碳/次亚甲基碳(C—C/C―H,284.8 eV),这3种形式的碳占所有含碳键比例分别为15.0%、35.1%和49.9%;葡萄糖与尿素熔融后的GluU除了含有上述的酰胺态碳(N―CO―N,289.1 eV)、羟基碳(C―OH,286.7 eV)和亚甲基碳/次亚甲基碳(C—C/C―H,284.7 eV)外,还检测到了结合能为286.1 eV的碳,该碳可能是葡萄糖与尿素熔融反应结合的碳(―CX),这4种形式的碳占所有含碳键比例分别为9.0%、45.6%、20.1%和25.2%[17–19]。

表2 肥料表面碳原子含量及C 1s峰中各形态碳的比例 (%)Table 2 Surface carbon atoms content in fertilizer and the contribution of each carbon form to C 1s peak
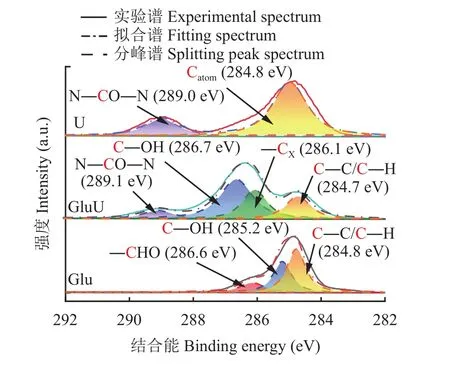
图3 XPS C 1s分峰拟合图Fig. 3 XPS C 1s peak fitting spectra of samples
进一步分析发现,与含有15.0%醛基碳(结合能286.6 eV)的Glu相比,GluU并未检测到醛基碳(―CHO)的存在,该碳的结合能由286.6 eV偏移至286.1 eV,说明该碳的化学环境发生改变,与该碳相连的新原子电负性低于醛基碳中与碳相连的氧原子,该原子对碳原子吸电子能力变弱,导致该碳结合能降低[20],推测醛基碳与尿素发生化学反应,生成另一种类型的碳形态(―CX),同时发现羟基碳(C―OH)的结合能由 285.2 eV (Glu)偏移至 286.7 eV,说明GluU中羟基碳周围的电子云密度增加[21–22],这表明葡萄糖与尿素发生反应的位置与羟基碳相邻。综合以上结果认为,葡萄糖的醛基与尿素发生反应过程中,葡萄糖中与羟基碳相邻醛基上的碳氧双键发生断裂,形成电负性低于醛基碳的结构―CX,导致葡萄糖改性尿素中羟基碳周围电子云密度高于葡萄糖[23]。
由XPS O 1s的分峰拟合结果(图4和表3)可知,U中只含有羰基碳(C=O,531.8 eV),Glu含有两个不同氧形态的峰,根据葡萄糖分子结构可知,这两种氧类型分别是羟基氧(C―OH,531.4 eV)和醛基氧(―CHO,530.7 eV),其占所有含氧键总量分别为51.1%和48.9%。需要指出,对O 1s谱图中531.4和530.7 eV进行峰归属时通过对比羟基氧与醛基氧的负电性,发现羟基氧的负电性较低,相应的结合能相对较高,对比二者的相对含量,发现峰归属结果一致[21,24],同时葡萄糖的羟基氧(C―OH)结合能(531.4 eV)与 Chen 等[25]发现羟基氧 (C―OH)的结合能位于531.4 eV结果吻合。此外,GluU中的氧以羟基氧 (C―OH,532.9 eV)和羰基氧 (C=O,532.3 eV)的形态存在,其占所有含氧键总量分别为50.65%和49.35%。

表3 肥料表面氧原子含量及O 1s峰中各形态氧的比例Table 3 Surface oxygen atoms content in fertilizer and the contribution of oxygen species to O 1s peak
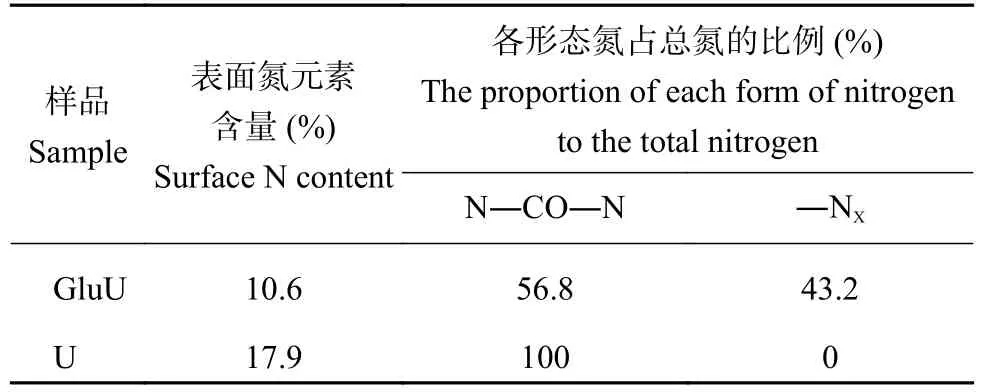
表4 肥料表面氮原子含量及N 1s峰中各形态氮的比例Table 4 Surface nitrogen atoms content in fertilizer and the contribution of each nitrogen form to N 1s peak
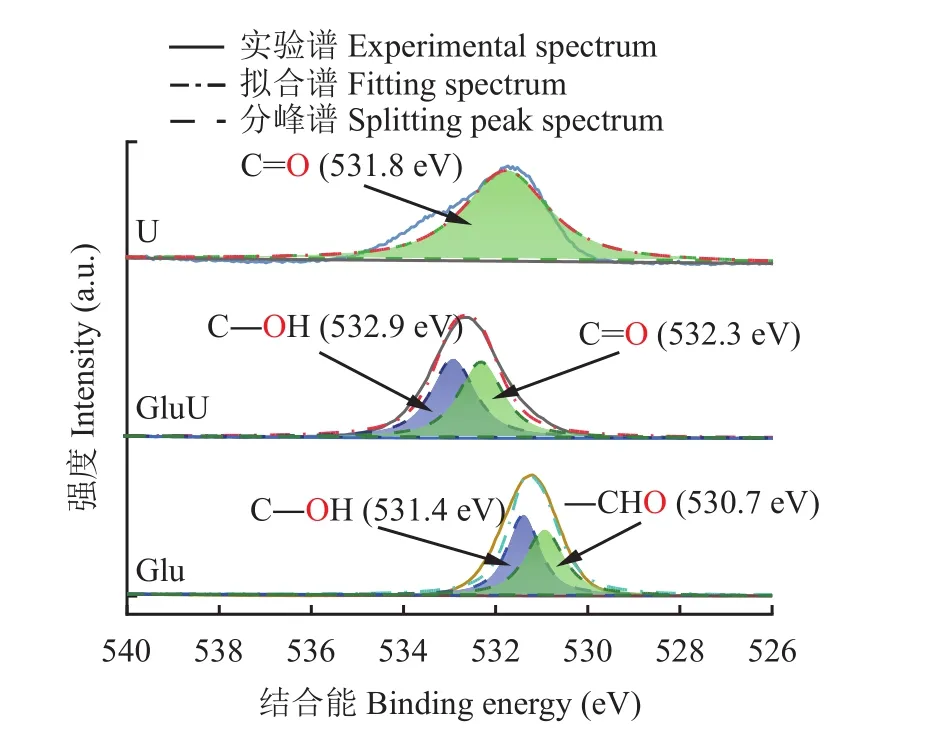
图4 XPS O 1s分峰拟合图Fig. 4 XPS O 1s peak fitting spectra of samples
对Glu和GluU中羟基氧(C―OH)和羰基氧(C=O)相对含量分析发现,葡萄糖与尿素熔融后并没有大幅度提升羰基氧(C=O)相对含量,同时GluU羟基氧(C―OH)含量与Glu含量相当,这可能是由于尿素分子虽然含有羰基氧(C=O),但葡萄糖在与尿素熔融时,葡萄糖中的醛基氧(―CHO)参与反应,C=O化学键发生断裂,与尿素反应生成新物质,导致羰基氧相对含量并未大幅提高[8–9]。该结果与 XPS C 1s中并未检测到醛基碳 (―CHO),同时检测出另一种未知碳形态(―CX)的结果吻合,推测是葡萄糖的醛基与尿素发生反应。
由XPS N 1s的分峰拟合结果(图5和表4)可知,U中的氮形态是以酰胺态氮的形式(N―CO―N,399.7 eV)存在,在GluU中的氮主要是以酰胺态氮的形式(N―CO―N,400.1 eV)存在,同时还检测到了结合能为399.4 eV的氮,该氮可能是葡萄糖的醛基与尿素的胺基反应结合的氮(―NX),其占所有含氮键总量的43.2%[19]。结合GluU C 1s图谱中检测到含有未知的碳结构(―CX),醛基碳(―CHO)结构消失,O 1s谱图结果表明部分羰基C=O化学键发生断裂,从这两个依据进行推测,可能是葡萄糖的醛基与尿素的酰胺基发生了反应,导致未知氮结构(―NX)的结合能降低。该结果与FTIR图谱(图1)中GluU位于3441 cm–1处伯胺NH2反对称伸缩振动强度减弱,在1599 cm–1并没有出现伯酰胺NH2变角振动结果相一致。然而葡萄糖醛基与尿素胺基发生反应后产物的物质组成和产物结构尚不明晰,还需通过LC-MS进一步分析。

图5 XPS N 1s分峰拟合图Fig. 5 XPS N 1s peak fitting spectra of samples
2.3 葡萄糖改性尿素的物质组成
液相色谱–质谱联用可以很好地根据物质的相对分子质量来推测物质的化学结构。采用LC-MS方法在正离子模式下对U和GluU进行分析,其质谱图如图6所示,根据相对分子质量的大小在质谱库中寻到对应的产物。
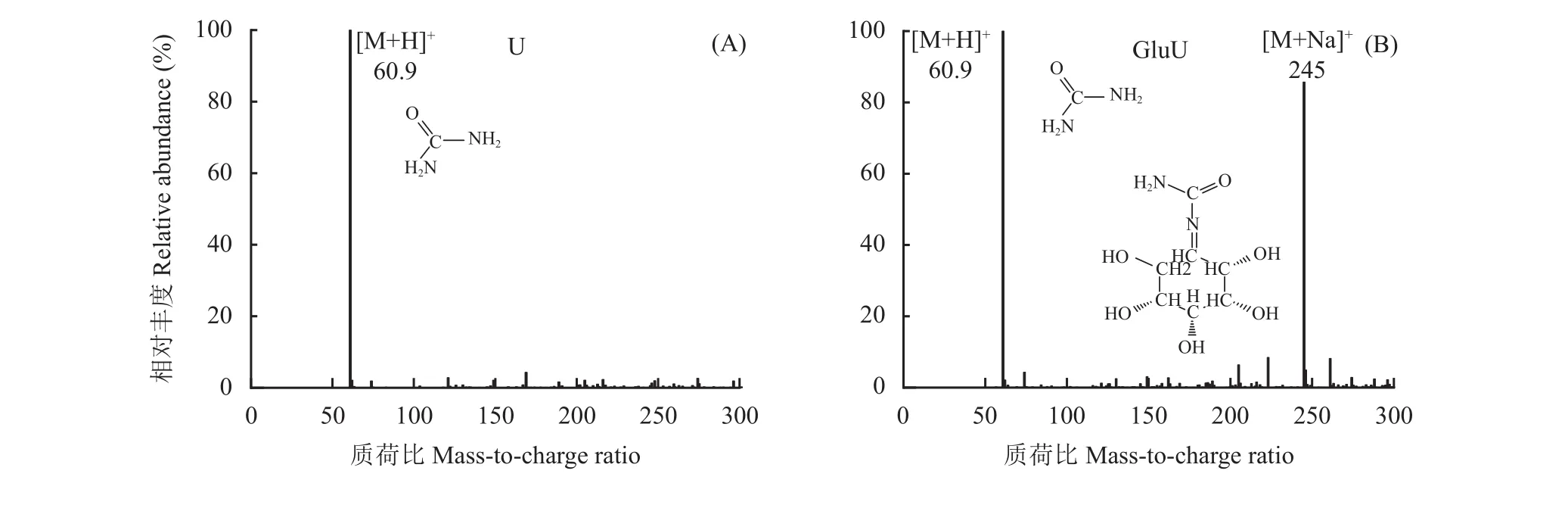
图6 尿素(A)和葡萄糖改性尿素(B)特征峰质谱图Fig. 6 MS spectra of urea (A) and glucose-modified urea (B) characteristic peaks
正离子条件下U出现准分子离子峰[M+H]+,离子碎片质荷比为60.9,结合表5中该离子碎片分子式为CH4N2O分析,这是U中尿素成分的体现,相对丰度为100%。正离子条件下GluU出现[M+H]+和[M+Na]+两种准分子峰离子峰,离子碎片质荷比分别为60.9和245,相对丰度分别为100%和85%。结合表5离子碎片分子式分析,CH4N2O为GluU中尿素的成分,C7H14N2O6为尿素与葡萄糖反应的产物。该物质有较高的超离域度和完整的共轭体系,强配位的氧原子和合适的空间构型,易与Na+形成金属络合物[26]。推测葡萄糖在与尿素反应过程中,葡萄糖中的醛基和尿素的胺基发生了反应,生成C=N的同时脱去一分子水,其结构式如图6 B所示。LC-MS测试结果表明葡萄糖的醛基(―CHO)与尿素的胺基(―NH2)发生反应,发生亲核加成反应,生成含有C=N结构的新物质,这充分印证了FTIR和XPS的结果,即尿素的伯胺(―NH2)与葡萄糖的醛基发生反应,尿素伯胺发生变化,葡萄糖的醛基(―CHO)双键发生断裂,与尿素胺基结合生成含有新的碳形态(―CX,286.1 eV)的物质。3种测试结果相互佐证和支撑,证明葡萄糖的醛基与尿素的胺基发生了反应,生成了含有C=N结构的物质,该结果印证了XPS C 1s测试结果,即与碳相连的新原子电负性低于醛基碳中与碳相连的氧原子。同时XPS发现的未知碳形态 (―CX,286.1 eV)结合能与 Chiang 等[27]发现C=N的C 1s结合能位于286.1~286.3 eV结果相吻合,XPS发现未知氮结构(―NX,399.4 eV)的结合能小于尿素态氮(400.1 eV)与Dong等[28]和Steffan 等[29]发现 C=N―C (398.5 eV)结合能小于C―N―H (401.2 eV)结果相一致。
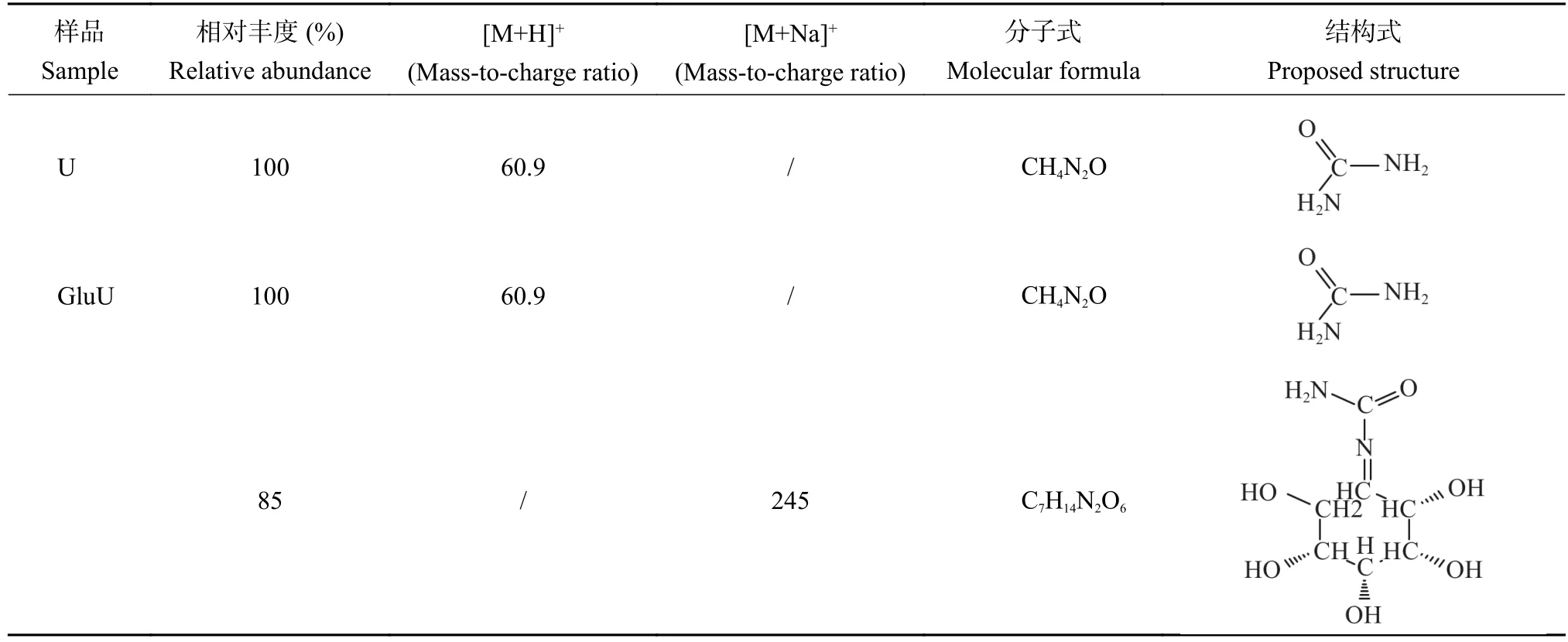
表5 U和GluU的质谱数据Table 5 Date for the MS spectra of U and GluU
2.4 不同葡萄糖添加量对尿素转化的影响
一般来说,增效剂可能会影响脲酶活性,从而影响尿素在土壤中的转化速率,改变土壤供氮强度[30]。将一定量的脲酶溶液分别加入系列尿素溶液中,模拟尿素在土壤中被脲酶分解的过程,通过检测溶液中剩余的尿素态氮含量,进而计算此过程中的尿素转化率。本研究中,葡萄糖以不同比例添加到熔融尿素中制备得到葡萄糖改性尿素(GluU0.2、GluU0.5和GluU1.0)和仅熔融不添加葡萄糖的普通尿素(U)的尿素转化率结果(图7)。

图7 不同葡萄糖添加量下3类尿素的转化率Fig. 7 Urea conversion rates of glucose-modified urea products as affected by inclusion rate of glucose
本试验条件下,普通尿素转化率为20.16%,GluU0.2、GluU0.5、GluU1.0 3个葡萄糖改性尿素的尿素分解率分别为15.5%、3.3%、11.0%,均显著低于普通尿素,降低幅度为4.6~16.9个百分点。这可能是葡萄糖醛基与尿素发生反应,醛基能够结合尿素的―NH2,降低尿素的转化速度,同时葡萄糖改性尿素中存在C=N不饱和键,C=N不饱和键在一定程度上能够抑制脲酶活性,进而影响尿素转化[31–32]。3个葡萄糖添加量处理之间的尿素转化率也差异显著,以葡萄糖添加量为0.5%时最低,添加0.2%最高,这可能是葡萄糖在高添加量时会使GluU1.0溶液中pH下降,对脲酶产生一定的激活效应,对脲酶的抑制作用减弱,导致GluU1.0尿素转化率高于GluU0.5[33],但不饱和键对脲酶抑制作用和pH对脲酶激活效应之间的关系有待进一步研究。不同葡萄糖添加量的葡萄糖改性尿素之间差异显著,表明在中低添加量(0.2%和0.5%)已达到显著降低尿素转化率的效果,为高效氮肥研发提供理论和技术依据。
本研究,葡萄糖改性尿素制备过程中,葡萄糖的添加量较低,基本不改变尿素原有的理化性质[34],但是能够显著延缓尿素分解(图7),抑制尿素转化的效果以添加0.5%的葡萄糖最好[7]。田间试验增加玉米产量的效果也以0.5%葡萄糖添加量最好。王彬等[6]对葡萄糖改性尿素的土培试验结果发现,在培养至3~14 天时葡萄糖改性尿素较普通尿素提高土壤脲酶活性6.9%~8.5%,这可能因为葡萄糖改性尿素在土壤中分解后,葡萄糖为微生物提供了碳源,促进了微生物的活性[35]。张威等[36]研究表明葡萄糖与氮素配施加速了土壤有机氮的矿化速率,从侧面证明了葡萄糖作为有机碳源可提高土壤微生物活性,在一定程度上促进氮肥转化。因此,还需开展更加系统的土壤培养试验,更全面深入地研究葡萄糖改性尿素在短期内抑制、在后期促进尿素转化的机制。
3 结论
葡萄糖的醛基与尿素的胺基发生亲核加成反应,具体表现在葡萄糖醛基的C=O化学键断裂,碳原子与尿素的氮原子发生结合,生成含有C=N结构的物质。该结构解释了葡萄糖改性后尿素分解在培养前期显著降低的原因。不同葡萄糖添加量对葡萄糖改性尿素的转化率影响显著,以0.5%的葡萄糖添加量降低尿素转化率的效果较为适宜。
