三台麦冬块根毒理学评价与抗营养因子分析△
2022-03-16苏芳芳钱丹陈敏杨光高峰李敏杨以明
苏芳芳,钱丹,陈敏*,杨光*,高峰,李敏,杨以明
1.中国中医科学院 中药资源中心,北京 100700;
2.河北中医学院 药学院,河北 石家庄 050200;
3.中国中医科学院 西苑医院,北京 100091;
4.成都中医药大学 药学院,四川 成都 611137;
5.三台县麦冬产业化办公室,四川 绵阳 621100
“药食同源”是我国劳动人民在总结食物和药物的食用特性后留下的智慧结晶,体现了食物在保健和治疗方面的功能。随着现代生活水平的不断提高,人们的养生意识日益加强,对饮食健康的要求也逐渐提高。为了保障食品供给的安全和来源的可持续性,早在2007 年原卫生部就颁布了《新资源食品管理办法》[1],后经多次修订和完善,最终于2018 年通过修正后的《新食品原料安全性审查管理办法》[2]。随着国家对食品安全问题的不断重视,作为食品来源的物品均要经过食用历史考证、生产工艺核查、安全性评价、全成分检测、食用风险评估等一系列环节的科学评估才能获得相关管理部门的认可。
麦冬又名麦门冬,为我国大宗常用中药之一,《神农本草经》列之为上品。2002 年原卫生部将麦冬列入《可用于保健食品的物品名单》中,其保健功效得到认可。近年来,中华人民共和国国家卫生健康委员会多次发布药食同源和新食品原料的征求意见稿,越来越多的中药经过食用历史考证和安全性评价等审核后被开发应用为食品,如人参、当归等常用大宗中药材已先后列入新资源食品和药食同源物品名录中。四川省卫生健康委员会在2019 年针对麦冬须根出台了《食品安全地方标准 麦冬须根》(DBS 51/007—2019)[3],这为麦冬在食品领域的发展提供了参考标准。从食用历史来看,早在唐代就出现有关麦冬食用的记载,在民间,麦冬也已成为广东、四川等地区的传统食品,四川居民常将麦冬加入牛奶、火锅等日常食物中共同熬煮[4],因此将麦冬作为食品来源也符合社会发展需求。
本研究针对道地药材三台麦冬进行毒理学实验和抗营养因子成分分析,为三台麦冬的食用安全性提供实验依据。
1 材料
1.1 实验动物与菌株
SD 大鼠(雌鼠110 只、雄鼠60 只),SPF 级,体质量180~200 g;离乳SD 大鼠(雌鼠50 只、雄鼠50 只),SPF 级,体质量60~90 g;昆明种小鼠(雌鼠25 只、雄鼠75 只),SPF 级,体质量18~22 g;实验动物均由西安交通大学医学院实验动物中心提供,实验动物生产许可证号:SCXK(陕)2012-0003;动物饲养于SPF 级实验动物房,室温20~25 ℃,湿度45%~65%,在新环境适应饲养3 d,给药前禁食8~12 h,不限制饮水。
鼠伤寒沙门氏菌突变型TA97、TA98、TA100、TA102均由国家(成都)中药安全性评价中心提供。
1.2 试药
麦冬采自四川省绵阳市三台县10 个不同地区,样品采集时间为2017 年3 月21 日—4 月30 日,经成都中医药大学李敏教授鉴定为百合科植物麦冬Ophiopogon japonicus(L.f.)Ker-Gawl.的块根,采用球磨仪进行打粉处理,备用,用蒸馏水做溶剂配制样品。毒理学实验中所用麦冬粉末为10 批样品的混合品,样品产地信息见表1。

表1 麦冬样品取样地信息
环磷酰胺(CP)、2-氨基芴、1,8-二羟基蒽醌(Sigma-Aldrich 公司);敌克松(Chemservice 公司);叠氮化钠(中国北京鼎国生物技术有限责任公司);大鼠肝微粒体酶(美国Moltox公司)。
1.3 仪器
BS-420 型全自动生化分析仪、BC-2800Vet 型血细胞分析仪(深圳迈瑞生物医疗电子股份有限公司);Uritest-200B 型尿液分析仪(桂林优利特医疗电子有限公司)。
2 方法
2.1 安全性及毒理学实验
2.1.1 大鼠急性毒性实验 取SD 大鼠20 只,雌雄各半。按限量法设定灌胃给药剂量为17.0 g·kg-1(相当于人体推荐量的340 倍),给予0.425 mg·mL-1样品溶液2次,灌胃体积为20 mL·kg-1。灌胃后连续观察14 d内大鼠的中毒症状及死亡情况,记录实验开始、第7天及第14天大鼠体质量[5]。
2.1.2 遗传毒性实验
2.1.2.1 细菌回复突变实验 采用平板掺入法[5]。选用经鉴定符合要求的鼠伤寒沙门氏菌突变型TA97、TA98、TA100、TA102 4 种菌株,以多氯联苯诱导的大鼠肝微粒体酶(S9)作为体外代谢活化系统,将菌株接种于营养肉汤琼脂培养基内。加入麦冬块根溶液0.1 mL,使麦冬块根终剂量分别为5000.0、1000.0、200.0、40.0、8.0 μg/皿。并设溶剂(蒸馏水)对照组、自发回变组和阳性对照组。自发回变组不做处理。每组做3 个平行皿。-S9 阳性对照药物:TA97 采用敌克松50.0 μg/皿;TA98采用敌克松50.0 μg/皿;TA100采用叠氮化钠1.5 μg/皿;TA102 采用敌克松50.0 μg/皿。+S9 阳性对照药物:TA102采用1,8-二羟基蒽醌50.0 μg/皿,其余3 个菌株均采用2-氨基芴10.0 μg/皿。每皿加入阳性对照的体积为0.1 mL。37 ℃培养48 h,计数每皿回变菌落数。
2.1.2.2 哺乳动物红细胞微核实验 采用30 h 2 次灌胃给药法进行实验。选用昆明种小鼠50 只,雌雄各半,随机分为5 组,设对照组(蒸馏水)、CP(40 mg·kg-1)阳性对照组及麦冬块根10.0、5.0、2.5 g·kg-1组,给药量为20 mL·kg-1。末次给药6 h后,颈椎脱臼处死小鼠,取股骨骨髓于小牛血清中涂片、固定、染色,观察计数[5]。
2.1.2.3 小鼠精原细胞畸变实验 选用雄性昆明种小鼠50 只,随机分为5 组,每组10 只。分组及给药剂量同2.1.2.2 项下,连续灌胃5 d。在处死前5 h按5 mg·kg-1剂量给小鼠腹腔注射秋水仙素溶液,脱颈椎处死小鼠,取双侧附睾制片,染色、观察。每只动物计数100 个中期分裂相细胞,记录染色体畸变类型、数量和畸变细胞率[5]。
2.1.3 大鼠致畸实验 取SD 大鼠雌性100 只、雄性50 只,按雌性-雄性2∶1 同笼,次晨查阴栓确定受精鼠并随机分到各组。将受精鼠称体质量、编号、记录受精日期,作为受孕0 d。设置麦冬块根5.00、2.50、1.25 g·kg-1组和溶剂(蒸馏水)对照组。课题组曾用CP 做阳性药开展过致畸实验,在SD 大鼠中有阳性结果发现,所以本实验略去阳性对照组。在大鼠受孕的第6~15 d,按10 mL·kg-1的灌胃量每日1 次进行灌胃,溶剂对照组灌胃等体积蒸馏水,并记录大鼠在孕期第0、6、9、12、15、20 天体质量,观察记录动物的一般行为、表现及有无中毒体征;在孕第20 天处死母体,剖腹取出子宫,检查黄体数、胚胎着床数、吸收胎数、活胎数及死胎数。逐一记录胎鼠性别、体质量、身长,检查有无外观畸形。分别将每窝各1/2左右的胎鼠作内脏及骨骼检查[5]。
2.1.4 90 d 喂养实验 选用离乳SD 大鼠100 只,雌雄各半,随机分成5 组,设溶剂(蒸馏水)对照组和麦冬块根5.00、2.50、1.25 g·kg-1(分别相当于人体推荐量的100、50、25倍)组。另设5.00 g·kg-1作为高剂量组和溶剂(蒸馏水)对照组做卫星组,每组10 只大鼠,雌雄各半,用于中期血液指标测定。按10 mL·kg-1每日经口灌胃1 次,连续90 d,每周称1次体质量和2次饲料量,记录给食量和剩食量,计算每周及总增质量、进食量和食物利用率。实验中期和结束后采血进行血液学检查,动物进行大体解剖,观察脏器变化[5]。
2.2 抗营养因子实验
2.2.1 胰蛋白酶抑制剂的测定 参考付煊赫等[6]的方法,采用分级盐析的方式进行胰蛋白酶抑制剂提取。称取麦冬样品1.00 g于10 mL去离子水中,室温磁力搅拌2 h(400 r·min-1),离心(4 ℃,4000 r·min-1,30 min,离心半径为13.5 cm)。沉淀用去离子水5 mL重复以上操作,合并2次上清液。上清液用65 ℃水浴加热10 min,迅速冷却后离心(4 ℃,4000 r·min-1,30 min,离心半径为13.5 cm),上清液加固体硫酸铵至饱和度为35%,4 ℃静置过夜,离心(4 ℃,4000 r·min-1,30 min,离心半径为13.5 cm);继续取上清,加固体硫酸铵至饱和度为55%,4 ℃静置8 h,离心(4 ℃,4000 r·min-1,30 min,离心半径为13.5 cm),取沉淀,用去离子水800 μL 溶解,在去离子水中充分透析24 h,离心(4 ℃,10 000 r·min-1,10 min,离心半径为13.5 cm),上清液即为胰蛋白酶抑制剂粗提物。胰蛋白酶活性测定方法参照《中华人民共和国药典》2020 年版(二部)N-苯甲酰-L-精氨酸乙酯(BAEE)法测定。
2.2.2 凝集素的测定 称取麦冬块根粉末1 g,加0.9%氯化钠溶液8 mL提取10 h,离心(4 ℃,5000 r·min-1,20 min,离心半径为13.5 cm);取上清液,加入硫酸铵达到饱和度为50%,4 ℃过夜;离心(4 ℃,5000 r·min-1,30 min,离心半径为13.5 cm)后收集沉淀,用pH 7.40 的磷酸盐缓冲液(PBS)溶解,离心(4 ℃,4000 r·min-1,10 min,离心半径为13.5 cm),上清液在PBS 中透析过夜,之后继续在蒸馏水中透析2~4 h,置于聚乙二醇中吸水浓缩,得到粗凝集素。用二喹啉甲酸(BCA)法测定麦冬块根的凝集素含量[7]。
2.2.3 植酸的测定 称取麦冬粉末1 g 于50 mL 离心 管。加0.01 mol·L-1HCl 20 mL,离心(4 ℃,6000 r·min-1,10 min,离心半径为13.5 cm),上清液用20 mL 量瓶定容。称取FeCl3·6H2O 磺基水杨酸30 mg定容至100 mL,做反应液。以不同质量浓度植酸钠做对照品,按样品-反应液-水5∶5∶4 混匀,离心(4 ℃,3000 r·min-1,10 min,离心半径为13.5 cm),室温静置20 min,于500 nm处测吸光度[8]。
2.2.4 非淀粉多糖的测定 称取麦冬样品0.5 g 于15 mL 离心管中,加80%乙醇5 mL,水浴90 ℃加热30 min;离心(4 ℃,6000 r·min-1,2 min,离心半径为13.5 cm)。上清液用氮气吹干。加pH 为5的醋酸缓冲液5 mL,金属浴100 ℃加热30 min,取出即加入15 U·mL-1的α-淀粉酶375 μL,加醋酸缓冲液,补足样品液至10 mL,混匀,离心(4 ℃,9000 r·min-1,2 min,离心半径为13.5 cm)。上清液备用。以无水葡萄糖为对照品,按照样品-苯酚-浓硫酸4∶2∶10室温放置25 min进行反应,在490 nm处测吸光度。根据标准曲线计算供试品溶液中葡萄糖含量[9]。
2.2.5 多酚类化合物的测定
2.2.5.1 槲皮素的测定 称量麦冬粉末1.00 g,加80%乙醇8 mL浸泡24 h。超声提取1 h,离心(4 ℃,3500 r·min-1,15 min,离心半径为13.5 cm),上清液烘干得到块状固体。精密称取块状固体0.05 g,加60%乙醇溶解定容至50 mL,作为供试品溶液。采用紫外分光光度法,以60%乙醇作为空白对照,以不同质量浓度的槲皮素为对照品,在371 nm 测定样品吸光度[10]。
2.2.5.2 没食子酸的测定 精密称取麦冬粉末0.2 g,加50%乙醇4 mL,浸提24 h,超声提取30 min,离心(4 ℃,3500 r·min-1,10 min,离心半径为13.5 cm),取上清液2 mL,定容至25 mL量瓶中。取上述定容液体0.1 mL,加福林酚试剂50 μL,反应3 min,再加6%碳酸钠溶液3 mL,加蒸馏水稀释至5 mL,混匀,避光保存2 h。采用紫外-可见分光光度法,以相应试剂作为空白对照,以不同质量浓度的没食子酸为对照品,760 nm测样品吸光度[11]。
2.2.5.3 阿魏酸的测定 称量麦冬粉末0.2 g 置具塞锥形瓶中,精密加入70%甲醇20 mL,浸提24 h,超声1 h,离心取上清液,采用紫外-可见分光光度法,以相应试剂作为空白对照,以不同质量浓度的阿魏酸为对照品,在316 nm处测样品吸光度[12]。
2.3 数据统计
哺乳动物红细胞微核实验采用u检验。小鼠精原细胞畸变实验采用二项分布统计处理。90 d 喂养实验数据进行单因素方差分析。在统计分析时,先对数据进行方差齐性检验,若方差齐,采用单因素方差分析进行总体比较,发现差异再用Dunnett检验进行多剂量组与对照组均数间的两两比较。若方差不齐则对数据进行适当的变量转换,满足方差齐性检验后,用转换后的数据进行统计;若转换后的数据仍未达到方差齐要求,改用秩和检验进行统计分析。上述统计均用SPSS 20.0软件处理。
3 结果与分析
3.1 安全性及毒理学评价
3.1.1 急性毒性实验 结果显示,按限量法以17.0 g·kg-1剂量给药后,大鼠生长良好,未见体质量受到影响。雌性大鼠初始、给药第7 天、给药第14 天体质量分别为(193.0±7.3)、(230.0±13.1)、(259.6±14.1)g,雄性大鼠初始、给药第7天、给药第14 天体质量分别为(199.3±10.5)、(199.3±10.5)、(199.3±10.5)g。雌、雄大鼠均未见有明显中毒症状,无死亡。实验结束解剖大鼠,大体观察未见明显异常。结果表明,三台麦冬对雌、雄大鼠急性经口毒性半数致死量(LD50)均大于17.0 g·kg-1。根据急性毒性分级标准,三台麦冬属于无毒级。
3.1.2 遗传毒性实验
3.1.2.1 细菌回复突变实验 由表2~5 可见,在加或不加S9 的情况下,样品各剂量组的回变菌落数均未超过自发回变菌落的2 倍,亦无剂量-反应关系,表明该样品细菌回复突变实验结果为阴性。
表2 三台麦冬块根TA97细菌回复突变实验结果(,n=3)

表2 三台麦冬块根TA97细菌回复突变实验结果(,n=3)
注:-S9组阳性药为敌克松;+S9组阳性药为2-氨基芴;表3同。
3.1.2.2 哺乳动物红细胞微核实验 由表6 可见,麦冬各剂量组小鼠的红细胞微核率与溶剂对照组比较,差异均无统计学意义,而CP阳性对照组的微核率与溶剂对照组差异有统计学意义(P<0.01),各剂量组的未成熟红细胞(PCE)与成熟红细胞(NCE)的比值在正常范围内,哺乳动物红细胞微核实验结果为阴性。
3.1.2.3 小鼠精原细胞畸变实验 由表7 可见,与溶剂对照组比较,麦冬3 个剂量组畸变细胞率差异无统计学意义,而CP阳性对照组畸变细胞率则显著升高(P<0.01)。染色体畸变类型主要表现以断裂、断片为主。结果表明,小鼠精原细胞畸变实验结果为阴性。
表3 三台麦冬块根TA98细菌回复突变实验结果(,n=3)

表3 三台麦冬块根TA98细菌回复突变实验结果(,n=3)
表4 三台麦冬块根TA100细菌回复突变实验结果(,n=3)

表4 三台麦冬块根TA100细菌回复突变实验结果(,n=3)
注:-S9组阳性药为叠氮化钠;+S9组阳性药为2-氨基芴。
表5 三台麦冬块根TA102细菌回复突变实验结果(,n=3)

表5 三台麦冬块根TA102细菌回复突变实验结果(,n=3)
注:-S9组阳性药为敌克松;+S9组阳性药为1,8-二羟基蒽醌。
表6 三台麦冬块根的哺乳动物红细胞微核实验结果(,n=5)
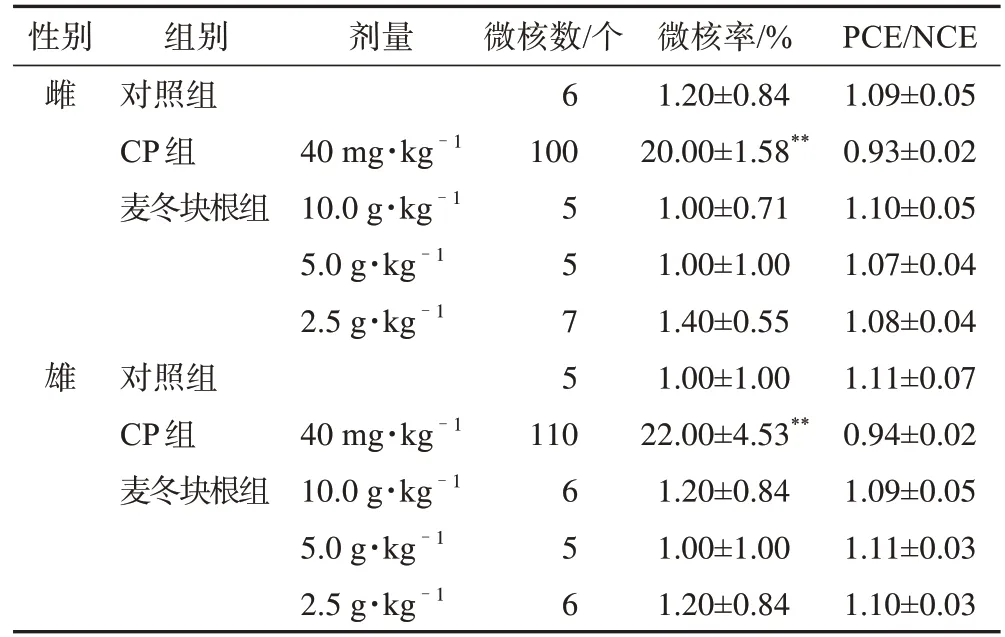
表6 三台麦冬块根的哺乳动物红细胞微核实验结果(,n=5)
注:每组检查PCE数均为5000个;与对照组比较,**P<0.01。
表7 三台麦冬块根对小鼠精原细胞畸变实验结果(,n=10)

表7 三台麦冬块根对小鼠精原细胞畸变实验结果(,n=10)
3.1.3 90 d 喂养实验 90 d 喂养实验结果表明,与溶剂对照组比较,三台麦冬各剂量组对大鼠体质量增长、进食量、食物利用率差异无统计学意义;血液学指标、血液生化学指标、脏器湿质量、脏器质量/体质量差异均无统计学意义(表8~10)。实验前对所有大鼠进行眼部检查,实验后对高剂量组和溶剂对照组大鼠进行眼部检查,均未见明显异常改变;大体解剖观察和组织病理学检查未见与样品有关的异常改变。在受试剂量范围内均未见该样品对大鼠各项观察指标产生影响。
表8 三台麦冬块根对大鼠血液学指标的影响(,n=10)

表8 三台麦冬块根对大鼠血液学指标的影响(,n=10)
3.1.4 致畸实验 结果表明,与溶剂对照组比较,三台麦冬各剂量孕鼠体质量及增质量差异均无统计学意义(表11);胎仔外观、活胎总数、胎鼠体质量、体长、骨骼、内脏检查差异均无统计学意义。各剂量组孕鼠均未见明显致畸作用。
注:受检细胞数均为1000个;与对照组比较,**P<0.01。
表9 三台麦冬块根对大鼠血液生化学指标的影响(,n=10)

表9 三台麦冬块根对大鼠血液生化学指标的影响(,n=10)
表10 三台麦冬块根对大鼠脏器质量与体质量比值的影响(,n=10)

表10 三台麦冬块根对大鼠脏器质量与体质量比值的影响(,n=10)
表11 三台麦冬块根对孕鼠体质量的影响(,n=16)
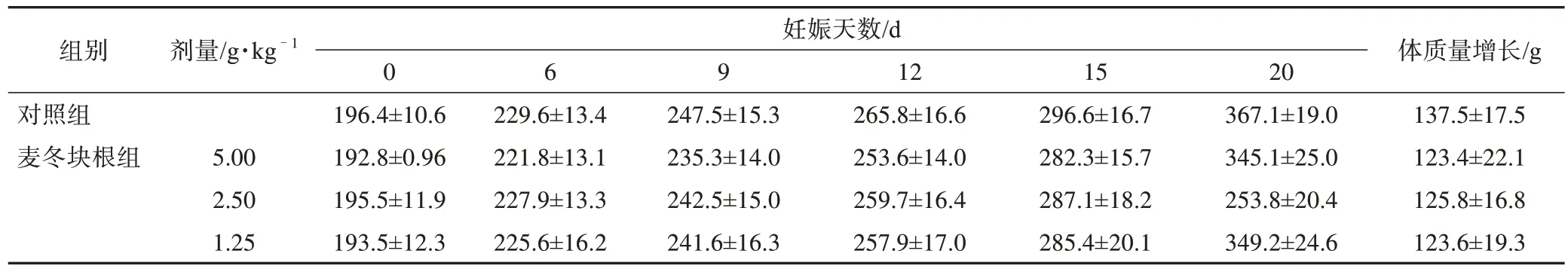
表11 三台麦冬块根对孕鼠体质量的影响(,n=16)
3.2 抗营养因子实验
3.2.1 胰蛋白酶抑制剂、凝集素、植酸、非淀粉多糖 三台麦冬块根中胰蛋白酶抑制剂对胰蛋白酶的平均抑制率为35.19%(表12)。因文献针对常见食品的胰蛋白抑制剂的描述较少,故缺少对比说明。凝集素的平均质量分数为2.737 mg·g-1,据文献报道,大豆中凝集素的质量分数最高为37.5 mg·g-1,最低为1.88 mg·g-1,大部分集中在4.22~13.13 mg·g-1[13],由此可见,三台麦冬中凝集素质量分数低于大豆。植酸的平均质量分数为0.120 8 mg·g-1,文献报道中显示,植酸在豆制品中如腐竹、青豆、黄豆等食物中质量分数分别为20.78、14.27、13.74 mg·g-1[14],均高于三台麦冬的植酸含量。三台麦冬中非淀粉多糖质量分数均值为0.115 g·g-1。文献显示,在几种常用中药的非淀粉多糖含量研究中,芦荟的非淀粉多糖质量分数为41.55 g·kg-1,黄芪中为610.6 g·kg-1[15],远高于在三台麦冬中的含量。

表12 三台麦冬块根的胰蛋白酶抑制剂的测定结果(n=3)
3.2.2 多酚类化合物 三台麦冬块根中槲皮素平均质量分数为0.044 g·g-1,没食子酸平均质量分数为5.098 mg·g-1,阿魏酸的平均质量分数为4.875 mg·g-1(表13)。
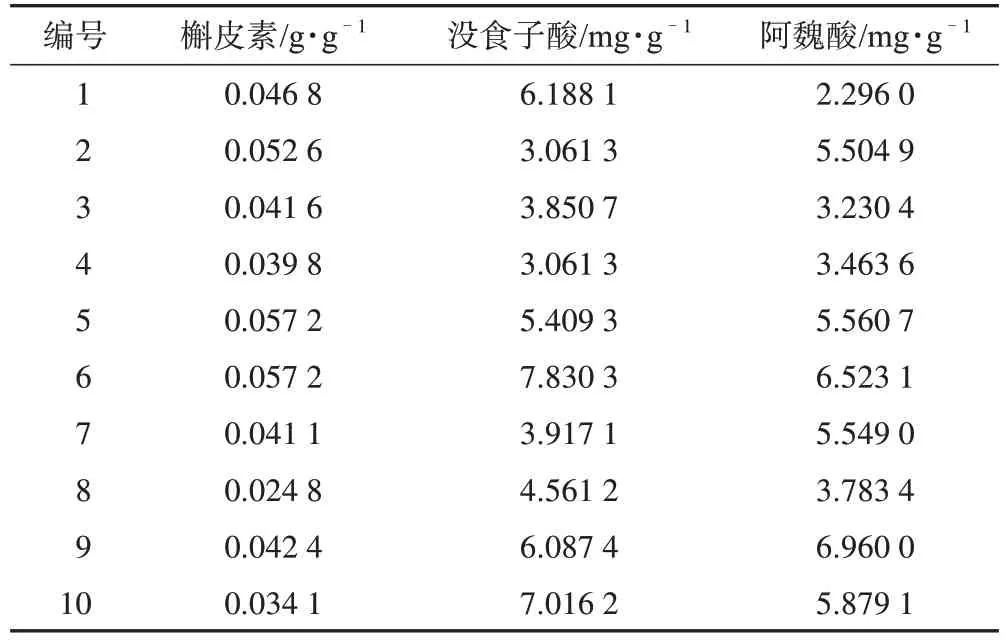
表13 三台麦冬块根中多酚类化合物质量分数(n=3)
4 讨论
麦冬虽然在我国使用历史悠久,但关于其毒理学评价的研究较少。本研究从多维度评价了三台麦冬的毒性,在急性经口毒性实验、遗传毒性实验、大鼠致畸实验和90 d 经口毒性实验中均未观察到三台麦冬对大鼠及小鼠的各项指标产生不良影响。尽管在体外条件下麦冬水煎液可能会引起细胞位点突变,但经体内代谢活化后并未显示遗传毒性[16]。有学者在观察麦冬水浸提液对大鼠胚胎/胎儿的发育毒性中发现,在相当于人临床最大用量的135 倍条件下,其仍表现出极好的安全性[17]。在对麦冬须根的安全性评价中,也未发现其对实验鼠健康造成影响[18]。这些都表明麦冬在临床剂量范围内服用是安全的。
麦冬块根中的抗营养因子为植物中常见的几类物质,主要包括胰蛋白酶抑制剂、凝集素、植酸、非淀粉多糖、多酚化合物等。豆类、花生及谷实类、块根、块茎等食品中都含有微量的抗营养因子,在加工、加热等工艺过程中可以消除和破坏大部分的抗营养因子。本研究表明,三台麦冬的抗营养因子在推荐剂量下无健康风险。
我国已步入老龄化社会,市场上面临着巨大的养生保健需求。“药食同源”和饮食疗法是中华民族最古老的治病强身方法,中医药具有许多可作为食品食用的中药材。现代研究表明,麦冬具有降血糖、保护心血管系统、增强免疫等活性,具有潜在的食用开发价值[19]。但是,限于《中华人民共和国食品安全法》等政策规定,麦冬尚不能作为普通食品使用,这严重地制约了麦冬产业的进一步发展。将麦冬推荐为食用来源,有助于满足我国在养生保健和养老方面的诉求,丰富中医药大健康产业的内涵。
