2013—2021年药品抽检中药质量分析及抽检模式探讨
2022-03-16王莹刘丽娜许玮仪左甜甜王赵李静金红宇马双成
王莹,刘丽娜,许玮仪,左甜甜,王赵,李静,金红宇,马双成
中国食品药品检定研究院,北京 102629
国家药品评价性抽检工作(以下简称“国抽”)自2008 年实施以来,在药品质量评价、监管及质量控制水平提高等方面发挥了重要作用。在抽检工作中,对不合格药品及时发布质量公告并进行严厉查处,有力震慑了药品市场的不法行为。一般情况下,“国抽”项目包括2 个部分,即标准检验和探索性研究。标准检验指检验部门根据国家药品标准对药品进行的全项目或部分项目检验,是行政监管的法律依据;探索性研究指以问题为导向,发现药品存在的质量风险,有利于深入分析药品质量[1]。本文对2013—2021 年中国食品药品检定研究院中药民族药检定所天然药物室(以下简称天然药物室)完成的“国抽”进行总结,通过对市场抽检结果的分析,对中药监管及质量标准提出相应建议;同时,梳理了近9 年围绕“国抽”完成的中药质量标准提高和能力建设相关工作,对“国抽”模式如何在中药质量体系完善中发挥更大作用进行讨论。
1 “国抽”完成情况
在“国抽”安排下,2013—2021 年天然药物室抽检重点工作主要围绕2 个方面开展:1)中药饮片外源性有害残留物的检测;2)以中药提取物投料的成方制剂及中药配方颗粒质量研究。对抽样情况、标准检测项目及抽检结果进行汇总。
1.1 抽样情况
根据“国抽”要求,样品应具有代表性。2013—2021 年抽取的中药饮片及成方制剂基本覆盖了全国31 个省级行政区及中药生产、流通、医疗等使用单位。样品覆盖面广、代表性强。
1.2 执行标准
抽检药品质量评价标准一般包括《中华人民共和国药典》(以下简称《中国药典》)标准、卫生部部颁标准、国家药品监督管理局局颁标准和补充检验方法。近9 年抽检工作中涉及的饮片及中成药品种均为《中国药典》收录品种,执行《中国药典》标准;对于有补充检验方法的品种,同时按补充检验方法对样品进行检测;2018 年完成的2 个品种为配方颗粒,因缺乏国家标准,故采用各企业标准进行检验,具体执行标准见表1。
1.3 标准检验情况
2013—2021 年,“国抽”共收集样品3300 批,包括饮片2639 批、配方颗粒226 批和成方制剂435 批。按照“国抽”任务中规定的项目完成标准检验,合格2717 批,总合格率为82.3%。其中,中药饮片合格率为77.9%,成方制剂和配方颗粒合格率均为100%。然而,一些药材品种部分指标合格率较低。例如:2013 年完成的粉葛中二氧化硫残留量检验,抽样批数为83 批,合格率仅为16.3%;2017 年完成的人参中有机氯农药残留量检测,抽样批数为86 批,合格率仅为44.2%。具体饮片品种及合格情况见表2。
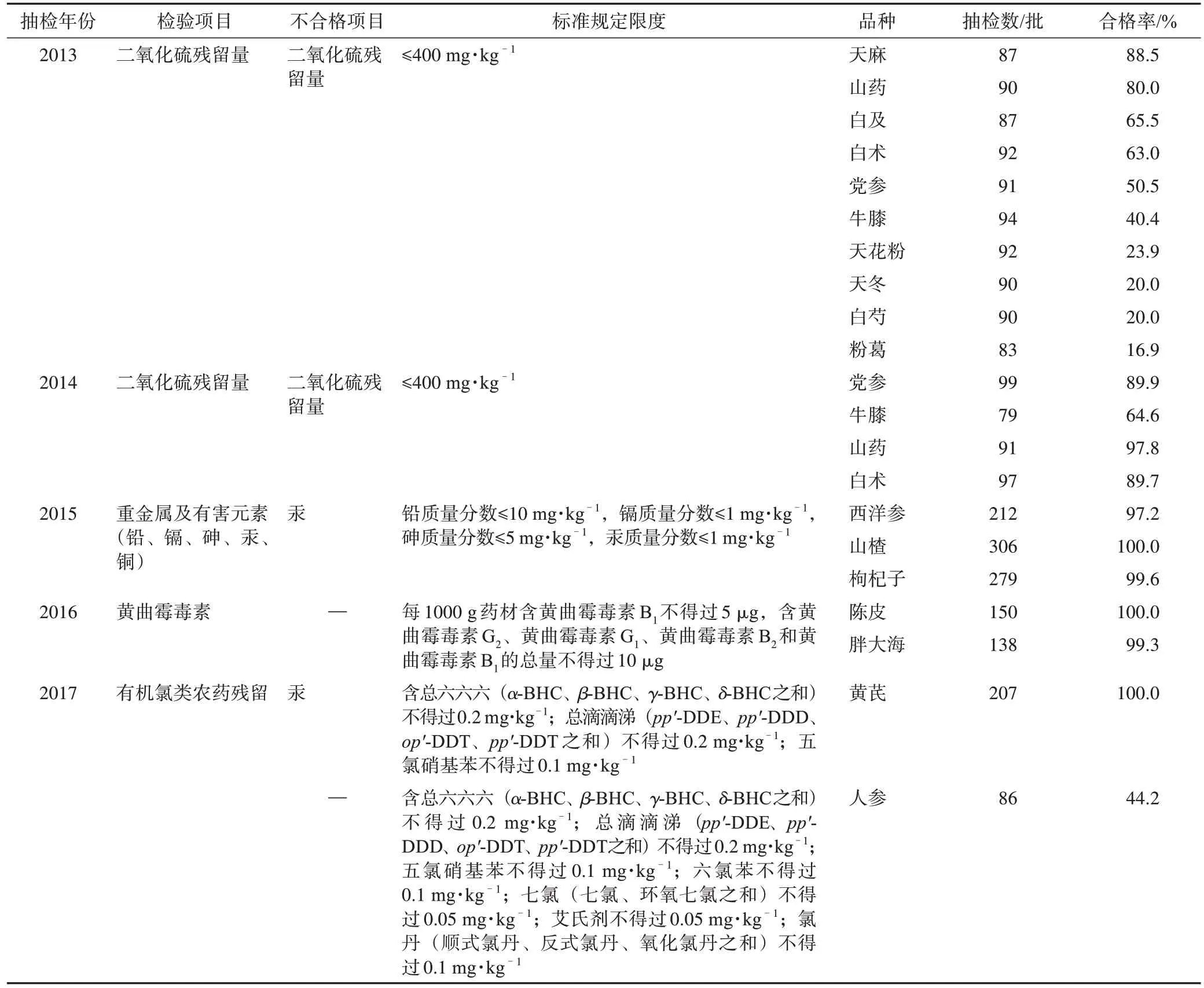
表2 2013—2017年中药饮片检验情况
2 抽检结果分析
2.1 中药外源性有害残留抽检分析
近年来,随着中药种植品种及种植面积不断扩大,中药外源性有害残留污染已成为社会关注的焦点问题。一般情况下认为,中药外源性有害残留物主要包括农药、重金属、黄曲霉毒素、二氧化硫残留及辐照等。自《中国药典》2000 年版开始,中药标准正文及附录中陆续收录了有机氯类农药残留、重金属及有害元素、黄曲霉毒素、二氧化硫等检测方法和限度要求。鉴于中药外源性有害残留可能对用药安全性造成影响,国家监管部门对中药有害残留高度关注。天然药物室于2013—2017 年分别围绕21 个中药材品种开展有害残留研究。值得关注的是,为达到“国抽”发现药品中存在风险的目的,所选择的21 个品种皆为前期调研或日常检验中发现的可能存在风险的品种,且大多为药食同源类品种,旨在通过全国性大范围抽检工作,掌握市场中此类中药品种污染现状,为下一步标准和监管政策制定提供参考。
通过抽检结果分析发现以下问题:1)2013—2014 年中药二氧化硫污染情况研究显示,白芍、天花粉、天冬、粉葛、牛膝5 个品种二氧化硫残留量超标现象较严重,合格率均小于50%,且其中有39 批(约占测定总量的4%)样品二氧化硫残留量>2000 mg·kg-1,即规定限量值的5倍,其中以党参和牛膝熏蒸超限度值最为明显[2];2)2015 年,3 个药食同源品种(西洋参、山楂和枸杞子)中重金属及有害元素抽检合格率高达99%,且通过初步风险评估认为这3 种药材因重金属残留带来的健康风险较小,质量满意,但其中8 批不合格样品的风险评估结果表明,不合格品种人体健康风险较大,不容忽视[3];3)2016 年陈皮和胖大海黄曲霉毒素检验结果显示,其合格率均在99%以上,初步认为市场情况良好[4];4)2017 年黄芪和人参有机氯农药检验结果显示,黄芪合格率可达100%,整体质量良好,人参合格率仅为44.2%,不合格项目为五氯硝基苯超标,整体质量评价为差。通过初步风险评估认为,除五氯硝基苯外,其他农药均处于痕量残留,风险评估表明安全风险较小[5]。
2.2 中药提取物投料制剂抽检结果分析
中药中部分成方制剂以提取物投料制备,如《中国药典》2020 年版中收录的银杏叶片/胶囊以银杏叶提取物作为原料、益心酮片以山楂提取物作为原料、心脑健胶囊以茶叶提取物为原料。此类药品中提取物原料的质量直接关系到制剂的质量,而不同提取物原料质量和生产工艺均可能存在一定差异,最终对制剂质量产生影响。为掌握此类产品质量现状及存在的问题,天然药物室于2019—2021 年对此类产品进行抽检,包括银杏叶片/胶囊、益心酮片、心脑健胶囊。抽检的435 批样品检验结果显示,标准检验样品合格率为100%,说明产品质量良好。同时,通过建立不同产品指纹图谱对药品整体质量及产品差异性进行研究。结果发现,益心酮片指纹图谱相似度可达0.95 以上,说明不同企业、不同批号的产品批间一致性较好[6];银杏叶片指纹图谱研究发现,不同厂家之间质量存在较大差异,尤其体现在有机酸和双黄酮含量差异较大[7]。
2.3 配方颗粒研究总结
中药配方颗粒是由单味中药饮片经水提、浓缩、干燥、制粒而成,在中医临床配方后,供患者冲服使用。中药配方颗粒从2001 年12 月1 日起纳入中药饮片管理范畴,实行批准文号管理。从近20 年中药配方颗粒的政策发展来看,国家鼓励中药配方颗粒的发展。为初步了解中药配方颗粒质量情况,选择金银花和大黄2 个配方颗粒品种,对其进行标准检验。通过企业标准检验发现,这2 个品种合格率为100%,说明产品质量良好。探索性研究通过建立指纹图谱对配方颗粒整体质量进行研究发现,不同企业产品之间存在较大差异,同一企业批间一致性较好[8-9],而不同企业生产的金银花、大黄配方颗粒在指标性成分含量限度规定上差异较大。安全性指标(农药残留、掺加山银花、重金属残留、辐照残留、微生物)检查结果显示,这2 个品种安全性风险较低。
3 围绕抽检工作对中药监管的建议
3.1 完善质量标准项目
抽检结果显示,虽然标准检验合格率较高,但在探索性研究中仍发现部分品种质量控制指标设定不够全面,缺乏关键质量控制指标。例如,银杏叶片研究中发现萜类内酯含量测定项未设置上限,难以确保药效的一致性;未设置指纹图谱项目,不能全面反映产品的均匀性和有效性;双黄酮有潜在免疫毒性且可能引发接触性过敏,尚未进行控制,建议对以上指标开展增修订工作。配方颗粒研究中发现,不同生产企业质量标准项目和限量要求差异较大。以金银花颗粒为例,各企业含量测定项绿原酸含量限度差异很大,检查项中只有个别企业包含山银花检查。标准的差异导致无法对各企业配方颗粒质量优劣进行统一评判[10]。故建立中药配方颗粒统一质量标准是配方颗粒质量可靠、安全可控的重要保障。
3.2 科学制定标准限度值
在近年“国抽”中尝试采用风险评估模式对中药标准中有害残留物限度值的合理性进行判断。例如,在西洋参等药材重金属检验工作中,通过风险评估模式对植物药的重金属及有害元素的限量进行评价,结果认为按照现行标准限度对药材进行检查,镉、汞风险较小而铅、砷限量可能会对部分人群健康产生一定风险。在中药材二氧化硫抽检工作中,通过风险评估模式对《中国药典》2015 年版中400、150 mg·kg-12 个限量值进行评价,结果认为现有二氧化硫限度值所产生的风险基本可接受,限度制定合理[11]。在人参抽检工作中发现人参饮片五氯硝基苯超标严重的同时,通过水煎煮、水浸泡及醇提方式对五氯硝基苯在中药加工中的转移率进行分析,最终得出研粉吞服、原粉入药及乙醇提取工艺下的含人参药品风险较高,应引起关注,必要时应增加五氯硝基苯限度检查[12]。
3.3 加强质控体系建设
在抽检工作中同时加强实验室分析质量控制体系建设对保证结果的准确性至关重要。特别是有害残留这一痕量分析,常发生检测结果出现假阳性、假阴性及重复性不佳的情况。例如,有的样品常存在黄曲霉毒素污染不均匀现象,即在霉变部位黄曲霉毒素检出量很高,而其他部位可能未检出;而硫熏药材中由于亚硫酸盐含量不稳定、易分解,故随着检测时间的变化,可能检测结果有较大差异。面对这些问题,建议尽快建立适宜的分析质量控制体系,规范取样、留样、测定、结果验证等操作,以保证结果准确、可重复。
3.4 加强源头治理
中药材是中药生产的源头,中药种植、贮藏过程是中药生产的最初环节。要解决中药外源性有害残留污染问题,必须从药材的种植及贮藏过程着手[13]。例如,抽检工作中发现人参中五氯硝基苯超标严重,结合产地调研发现其超标原因主要是种植过程农药滥用;部分药材二氧化硫残留量超标严重,也与此类药材产地硫黄熏蒸较为严重相关;有的药材黄曲霉毒素超标主要来源于药材加工及贮藏不当,导致霉变。建议在建立中药种植、加工及贮藏规范的同时加强药材种植过程农业投入品监管,研究低成本、有效的干燥和防腐技术并加以推广应用,从源头上减少有害残留污染的风险。
4 围绕抽检工作已完成的标准研究及能力建设
4.1 促进了标准的完善与提高
根据近9 年来“国抽”工作中发现的问题,已完成的标准增修订工作包括:1)2017 年完成人参抽检工作中发现,标准检测前处理步骤较为复杂且净化效果欠佳,鉴于此,对人参中有机氯类农药残留检测法进行修订,修订后的方法已经国家药典委员会(以下简称药典委)采纳,于《中国药典》2015年版第一增补本人参项下收录[14];2)围绕“国抽”工作对中药材中黄曲霉毒素进行筛查及初步风险评估,筛选出高风险品种,建议《中国药典》2020 年版增加柏子仁、肉豆蔻、莲子、使君子、槟榔、马钱子、土鳖虫、决明子、延胡索等药材中黄曲霉毒素限量检查,药典委已采纳该建议并在《中国药典》2020 年版中增加了以上药材中黄曲霉毒素限量检查;3)2013—2017 年完成的有害残留抽检工作中,着重探索了采用风险评估方法来评价限度的合理性,基于研究成果对《中国药典》2015 年版四部中《中药有害残留物限量制定指导原则》进行修订,修订后的指导原则已被《中国药典》2020 年版收录[15]。
4.2 推动了实验室检验能力建设
随着近年“国抽”工作的开展,天然药物室中药标准项目检测能力逐渐提高并培养了一批相应的专业技术人员。鉴于中药中痕量分析对于实验室检验能力有更高的要求,天然药物室与质量管理处联合组织了相应的能力验证工作。例如,围绕2017 年人参中有机氯农药残留不合格率较高的现象,组织了“人参中有机氯类农药残留检测”能力验证项目。项目参与单位总计39 家,多数来自省级、地市级食品药品检验单位。通过总结此次能力验证中发现的问题促进了整个行业检测水平的提高[16]。同时,针对有害残留这一痕量分析易产生误判的情况,根据近年抽检工作中检测经验,结合《中国药典》2015 年版中《分析方法验证指导原则》及欧盟发布的《食品饲料中农药残留分析的质量控制及方法确认指导原则》,形成了《中药中有害物质痕量残留检测分析质量控制指导原则》,可用于日常实验室痕量分析结果判定。
4.3 创新质量评价方法及模式
围绕抽检工作发现的药品质量及标准存在的问题,进一步开展了探索性研究,特别是围绕中药中有害残留抽检工作,形成以下系统性科研成果:1)围绕2017 年人参农残测定,进一步建立了农药残留高通量测定方法,包括人参中240 余种农药的气相色谱-串联质谱法(GC-MS/MS)和液相色谱-串联质谱法(LC-MS/MS)[17],并以此为基础扩展应用到其他中药品种中[18],在3种药材重金属抽检工作中进一步建立了药材中多种重金属检测技术平台[19];2)采用风险评估方法对“国抽”样品中农药[20]、重金属、黄曲霉毒素及二氧化硫所产生的健康风险进行分析,探索风险评估模式在中药质量评价中的应用[21],最终结合中药使用特点,形成了符合中药服用频率和服用方式的风险评估模式[22-23]。此类技术和方法的探索,为中药质量评价提供了新的方法和思路,也为药品科学监管提供理论依据。
5 对抽检形式的探讨
5.1 加强质量情况跟踪,以体现抽检工作连续性
以发现药品质量风险为目的,天然药物室近年开展的部分抽检工作是有规划性、针对性地对前期已开展项目的追踪。例如,2013 年在10 个品种二氧化硫残留量抽检工作中发现,部分品种不合格率很高,反映了市场中此类药材硫熏情况严重。在这种情况下,2014 年继续开展了4 个硫熏严重品种的再度市场抽检工作,结果发现,党参、牛膝、山药和白术的二氧化硫残留量逐渐减少、合格率大幅提高(图1),说明随着《中国药典》2010 年版第二增补本的执行和抽检工作的持续开展,硫熏情况有所好转[24]。2019 年开展的银杏叶片/胶囊抽检工作是针对2015 年全国银杏叶药品专项治理工作的回顾。2015 年5 月,国家药品监督管理局通过飞行检查发现,部分银杏叶生产企业可能存在擅自更改生产工艺的情况,故在国家药品监督管理局部署下,天然药物室建立了银杏叶提取物及其制剂的补充检验方法,包括针对改变提取工艺或非法添加槲皮素、山柰素的游离槲皮素、山柰素、异鼠李素的补充检验方法及针对非法添加槐角的槐角苷补充检验方法,以加强对市场银杏叶制剂的监管[25-26]。时隔3 年,再次对市场银杏叶药品质量情况进行抽查,重点围绕补充检验方法对市场样品进行测定。相较于2015 年市售银杏叶药品不合格率高达19%的情况,2019 年开展的抽检工作显示其合格率达到100%,整体质量良好。此次抽检也体现了在补充检验方法执行后,银杏叶药品市场得到了有效规范,也体现了补充检验方法作为标准的重要补充,在药品质量监管中发挥了重要作用。鉴于此,建议国家评价性抽检工作规划中应考虑对已完成的药品抽检项目进行跟踪研究,尤其是存在风险的项目,通过掌握其质量现状,了解抽检工作对药品生产及质量的影响,最大限度发挥药品抽检的作用。
5.2 推进相关科研项目,推广“国抽”成果的应用
围绕“国抽”项目开展的探索性研究为标准检验以外的方法研究,其目的在于深入分析药品质量、发现药品存在的质量风险。探索性研究在深入发现药品质量的同时,应进一步针对质量风险开展相应的标准增修订及科研项目,以科研带动检验,提高药品质量控制水平,形成检验能力与科研项目的良性循环,加强“国抽”成果在药品监管中的推广和应用。
5.3 加强部门协作,弥补监管缝隙
中药从种植到成药,生产链条较长且属于跨部门监管,仅依靠药品监督管理部门并不能保证中药饮片安全[27]。例如,中药材农药残留量超标、重金属污染等问题的根源在于种植过程中为防治病虫害、保证产量而过度使用农药、化肥。中药材兼具农产品和药品双重属性,其种植主要由农业管理部门负责监管。在抽检工作中发现的农药、二氧化硫超标问题主要源于种植及产地加工的不规范。建议发现此类风险问题时应加强与农业部门的沟通与协作,如2017 年针对抽检发现的人参中农药超标问题,天然药物室以签报形式及时向国家药品监督管理局汇报,国家药品监督管理局对此高度重视,并通过部委间协调机制向地方政府及中华人民共和国农业农村部同时发送风险预警提示,以落实监管责任、加强企业监管。同时,经过各部门沟通,人参中相关农药残留标准陆续收入《中国药典》及《食品安全国家标准食品中农药最大残留限量》(GB 2763—2019)[28]。故建议“国抽”中发现重大风险问题时,应开展部门配合,从根源上治理中药种植加工环节存在的问题。
