藁本内酯神经保护作用的研究进展
2022-03-16武改丽霍志鹏
武改丽,霍志鹏,王 玉,何 毅
(1.天津中医药大学,天津 301617; 2.天士力医药集团股份有限公司研究院,现代中药开发中心,天津 300410; 3.天士力医药集团股份有限公司,创新中药关键技术国家重点实验室,天津 300410; 4.天津大学药物科学与技术学院,天津 300072)
藁本内酯(LIG)属于苯酞类成分之一,在中药当归、川芎等伞形科植物中含量较高,约为1%,是其主要活性成分之一[1]。中药当归、川芎应用广泛,LIG 存在顺反异构结构,Z-LIG 具有空间优势构象,比E-LIG更加稳定,在中药材中含量远高于E-LIG,相关研究多以 Z-LIG 为基础开展研究[2]。LIG 口服利用度为53.72%,药物半衰期为5.61 h,血脑屏障系数(BBB)为1.25,类药性指数为0.07,分子的极性表面积为30.21(小于60 表示其在渗透细胞膜时表现良好)[3],表明LIG 生物利用度较高,穿透力强,是药物开发的良好候选者,极具研究价值和开发潜力。
神经系统是维持机体稳态的重要环节之一,当神经系统受到脑血管疾病、神经退化疾病或神经损伤的破坏时,难以维持机体的正常运作,可能引发脑卒中、阿尔茨海默病、帕金森病等神经损伤疾病,不仅对人类健康造成损害,也给患者家庭和社会带来沉重的心理和经济负担。现代药理研究表明,LIG 主要通过抗氧化、抗炎、抗凋亡、改善记忆损伤、改善血脑屏障通透性等作用,对脑卒中、阿尔茨海默病、帕金森病等中枢神经损伤疾病有潜在的防治作用。本文就近年来LIG 神经保护作用的研究进展予以综述,为LIG 或含LIG 的相关中药和制剂的开发研究以及我国中药宝库的挖掘利用提供参考。
1 LIG 对神经损伤疾病的的药效研究
1.1 LIG 可改善脑卒中的神经损伤 脑卒中是神经系统的常见疾病,是由血管原因引起的急性中枢神经系统局灶性损伤导致的神经系统缺陷,是致残率最高的疾病,也是危害居民健康的主要疾病之一。LIG 分子量小,能够通过血脑屏障,可显著减少小鼠缺血再灌注后脑梗死面积,显著降低缺血脑组织中的丙二醛(MDA)水平,提高缺血脑组织抗氧化酶谷胱甘肽过氧化物酶(GSH-PX)和超氧化物歧化酶(SOD)活性。LIG能显著增加B 淋巴细胞瘤-2 基因(Bc1-2)的表达,降低兔抗人单克隆抗体(Bax)和胱天蛋白酶3(Caspase-3)的免疫反应活性,保护大脑神经元及其他组织[4]。
Li 等[5]研究使用 LIG(10 mg/kg)干预脑内注射自体血诱导的脑出血模型小鼠,与假手术组比较,LIG(10 mg/kg) 干预组给药 3 d 后神经功能评分和Bederson 评分显著下降,给药1~3 d 明显改善了平衡能力、肌肉能力和协调能力;与模型组比较,LIG(10 mg/kg)给药3 d 后可显著降低脑水含量,减轻脑出血后的脑水肿,显著降低神经元密度缺失。研究结果表明,LIG(10 mg/kg)能够显著改善脑出血模型小鼠神经损伤,对出血性中风具有有效的保护作用。
Ren 等[6]研究给予 LIG(65.3±10.8)pg/mg 干预小鼠微血管内皮细胞后,5 溴-2'-脱氧尿苷(BrdU+)细胞数量、细胞迁移、伤口愈合能力、细胞血管数量显著增加;LIG 干预脑缺血模型大鼠试验中,LIG 组给予(52.1±7.1)pg/mg,与模型组比较,血管内皮生长因子(VEGF)和磷酸化蛋白p-eNOS 表达水平显著增加(P<0.05),表明LIG 可促进缺血区域的血管生成和改善脑血管功能来减轻缺血损伤。
Wu 等[7]研究结果显示,LIG 干预糖氧剥夺/复氧(OGD/R)诱导的HT-22 细胞,显著增加了基质金属蛋白酶MMP 和腺嘌呤核苷三磷酸(ATP),降低了活性氧(ROS),进一步诱导了线粒体裂变;LIG 干预短暂性大脑中动脉阻塞(MCAO)大鼠试验结果表明,LIG可激活单磷酸腺苷(AMP)活化蛋白激酶(AMPK)通路,进而抑制动力蛋白相关蛋白1(Drp1)和线粒体锚定蛋白Fis1 的表达来诱导线粒体裂变,从而保护缺血性脑卒中神经损伤。
Li 等[8]研究显示,与模型组比较,LIG(15 mg/kg)可明显减少MCAO 大鼠的脑梗死体积(P<0.01)并减轻神经功能障碍(P<0.01),还可显著降低MCAO 大鼠的 MMP-2 和 MMP-9(MMP-2 和 MMP-9 属于基质蛋白金属酶)水平;机制研究表明,鼻内给药LIG 通过转录因子NF-E2 相关因子(Nrf2)和热休克蛋白70(HSP70)信号通路增强对缺血后神经损伤的保护,提示LIG 可能通过恢复供血供氧、抑制缺血部位炎症反应及维持神经元结构和功能的完整性改善脑卒中症状,是一种潜在的脑卒中治疗药物。
1.2 LIG 对阿尔茨海默病具有神经保护作用 阿尔茨海默病是一种神经退行性疾病,是指随着年龄的增长而出现的认知和功能衰退的神经病理学改变,记忆能力缺陷是最初阶段的特征,后期阶段伴随着认知和行为的逐渐变化。其发病机制包括淀粉蛋白假说(Aβ)、Tau 假说、氧化应激假说、突触强度降低、突触丢失和神经变性等,最终导致神经损伤。
Zhu 等[9]研究使用 LIG 干预衰老模型 SAMP8 小鼠,通过莫里斯水迷宫、对象识别、旷场试验行为测试,LIG 干预组可明显缩短时间、焦虑行为,且高剂量组(20 mg/kg)比低剂量组(10 mg/kg)改善现象明显;LIG 高剂量组(20 mg/kg)神经元相关蛋白突触后致密物 95、93(PSD95、PSD93)和脑源性神经营养因子(BDNF)表达升高到正常水平,LIG 低剂量组(10 mg/kg)略低于正常水平;LIG 干预组Drp1 蛋白表达水平降低,线粒体融合相关蛋白1 和2(Mfn1 和Mfn2)表达水平增加,表明LIG 可以改善SAMP8 小鼠的学习和记忆能力;同时LIG 还可改善SAMP8 小鼠线粒体功能,改善SAMP8 小鼠的神经退化。
Zhao 等[10]研究发现,LIG 可降低细胞凋亡、促进Bcl-2、自噬效应蛋白1(Beclin1)和细胞自噬标志物LC3-Ⅱ表达和LC3-Ⅱ免疫反应性和自噬体数量增加、降低Bax 的表达,有效地促进OGD/R 诱导的PC12 细胞的自噬,保护其免受凋亡,结果表明LIG 通过肝激酶B1(LKB1)-AMPK-哺乳动物雷帕霉素靶蛋白(mTOR)信号通路促进自噬,保护PC12 细胞免受OGD/R 诱导的凋亡。
Wei 等[11]研究显示,LIG 有显著的神经保护作用,与模型组比较,LIG 在 1~30 μmol/L 提高了 Aβ25-35诱导的干预人类神经母细胞瘤细胞系(SH-SY5Y)活力(P<0.05),抑制了乳酸脱氢酶(LDH)的产生(P<0.01),显著抑制了 Aβ1-42诱导的毒性(P<0.01),机制研究结果表明LIG 可能通过抑制p38,同时激活PI3-K/Akt信号通路保护Aβ 纤维诱导的神经毒性。这些结果不仅为LIG 的神经保护机制提供了新的见解,也表明LIG 在预防和治疗阿尔茨海默病可能是一种很有前景的临床前研究的候选药物。
2 LIG 对神经保护作用活性的机制研究
现代药理研究表明,LIG 分子量小、口服利用度高、易于通过血脑屏障等优点,对脑卒中、阿尔茨海默病等神经损伤疾病具有潜在预防和治疗作用,也决定了其药物价值。LIG 可能的神经保护作用的主要机制,见图1。
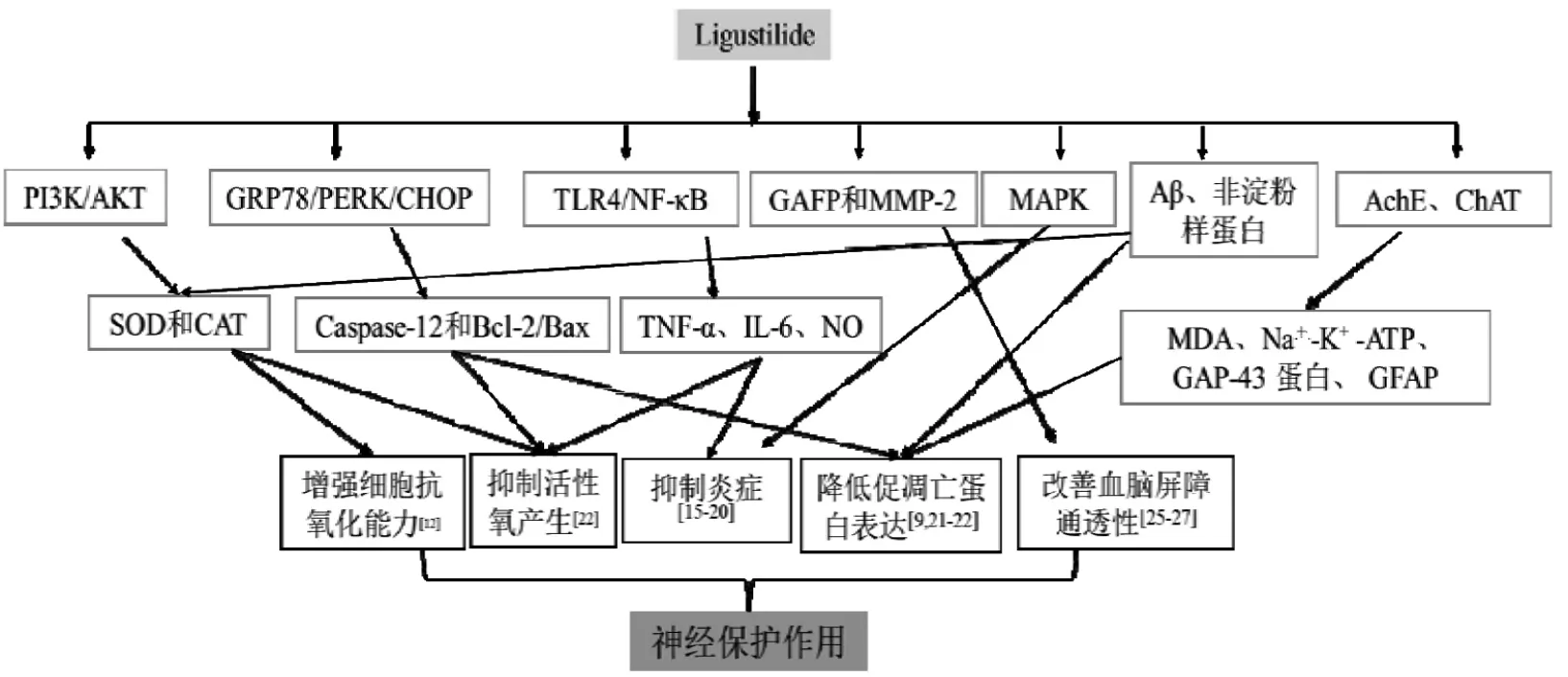
图1 LIG 可能的神经保护作用机制
2.1 抗氧化应激作用 氧化应激是细胞凋亡、神经炎症、代谢紊乱和神经元生物能量衰竭的中枢介质。氧化应激诱导的大脑损伤对中枢神经系统功能有很强的潜在负面影响。线粒体是细胞代谢的重要介质,是ROS 的产生者和靶点。正常情况下,低、中浓度的ROS 促进神经元的发育,产生的ROS 会被内源性抗氧化酶如SOD 转化为过氧化氢(H2O2),并经由过氧化氢酶和谷胱甘肽还原酶的作用转化为水以维持氧化还原的动态平衡。当机体受内外因素干扰时,导致ROS 形成增加或抗氧化物水平降低时,氧化还原平衡被破坏,使体内聚集较高水平的ROS 及自由基,诱导氧化损伤,破坏了细胞的抗氧化防御机制,导致细胞和神经元损伤,并导致疾病和衰老[12]。LIG 抗氧化能力主要表现在抑制活性氧产生和增强细胞抗氧化能力方面。
Zhu 等[9]研究显示,与对照组比较,使用 LIG 预处理通过增加Mfn1、Mfn2 和P-AMPK 水平,下调Drp1水平来保护被H2O2损伤的HT22 细胞;LIG 干预组显著减少了SAMP8 小鼠的脂质过氧化产物MDA 的含量,增加了SOD 和GSH-PX 的活性,表明LIG 可降低SAMP8 小鼠的氧化应激。
吴倩等[13]研究显示,LIG(1、5 和 15 μmol/L)作用于OGD/R 损伤后的PC12 细胞,细胞存活率分别提高到80.03%、86.36%和84.11%,且贴壁细胞数目明显增多,抑制了OGD/R 损伤后PC12 细胞内ROS 的聚集、细胞线粒体膜电位的下降,试验结果表明,LIG 具有神经保护作用,其机制可能与促进线粒体分裂有关。
Long 等[14]研究显示,与假手术组比较,手术组[双侧颈动脉闭塞模型组(BCCAO)]缺血脑组织中MDA含量升高,LIG 干预组减少了MDA 的产生;通过探索LIG 抑制大脑抗氧化应激的机制试验,结果表明LIG可能通过抑制丝氨酸-酪氨酸激酶(Akt)/转录因子(FoxO1)通路发挥抗氧化作用。
2.2 抑制神经炎症作用 神经炎症发生在中枢神经系统损伤和脑感染的反应中,是中枢神经疾病的一个显著的病理学特征,神经炎症发生时小胶质细胞和星形胶质细胞被激活,血脑屏障完整性被破坏,伴随大量促炎症因子如细胞因子、黏附因子等的释放,从而产生细胞毒性,引起神经损伤。星形胶质细胞和小胶质细胞是介导中枢神经系统先天免疫的主要细胞。由小胶质细胞或星形胶质细胞激活介导的神经炎症存在多种神经退行性疾病,如阿尔茨海默病和帕金森病等。激活的胶质细胞会释放促炎介质,如肿瘤坏死因子(TNF-α)、白介素-6(IL-6)、一氧化氮(NO)等,这些细胞因子都参与了神经炎症的进程,最终导致神经元的死亡[15]。
刘晓娇等[16]研究显示,LIG 干预脂多糖(LPS)诱导的神经炎症小鼠,与模型组比较,LIG 组细胞分泌NO 显著减少(P<0.05 或 P<0.01),TNF-α、IL-6、一氧化氮合成酶(iNOS)的表达均明显下调(P<0.05);LIG能显著降低小鼠海马区胶质纤维酸性蛋白(GFAP)、TNF-α 的表达(P<0.01),表明 LIG 能够抑制 LPS 诱导的体外神经炎症。
Toll 样受体(TLR)在免疫反应的调节中发挥关键作用,核转录因子-κB(NF-κB)是参与炎症的关键调控因子。TLR4/NF-κB 是脑内神经炎症应答重要通路之一[17],TLR 信号的调节阻止一些促炎分子产生,增强免疫介质的产生,是一种潜在的治疗方法。史梦琪等[18]研究显示,LIG(10 mg/kg、20 mg/kg)干预LPS 诱导的炎症大鼠,LIG(10 mg/kg、20 mg/kg)对 LPS 诱导产生的 TNF-α 和膜辅蛋白-1(MCP-1)浓度有抑制作用,且与模型组比较,LIG(20 mg/kg)组有显著差异(P<0.05);经 LIG 治疗后的大鼠 TLR4 信号通路活性及 NF-κB 转录因子活性有明显降低,PPARγ 转录因子活性有明显提高,且LIG(20 mg/kg)组与LPS 组比较有显著差异(P<0.05、P<0.01),结果表明 LIG 通过抑制TLR4/NF-κB 信号通路减轻LPS 诱导的神经炎症,并且提高PPARγ 的活性,也可抑制TLR4/NF-κB信号通路。
Li 等[5]采用脑内注射自体血方法诱导小鼠脑出血模型,LIG(10 mg/kg)干预脑出血模型小鼠,通过免疫染色分析,与模型组比较,LIG(10 mg/kg)可明显降低 GFAP、凋亡诱导因子(AIF-1)表达(P<0.01),显著下调了 TLR4、p-NF-kB p65、TNF-α 和 IL-6 的表达,结果表明LIG 可有效抑制炎症介质的表达和释放,保护脑免受脑出血的损伤,且机制研究表明LIG(10 mg/kg)神经保护作用与TLR4/NF-κB 信号通路的抑制有关。
2.3 抗凋亡作用 细胞凋亡是机体正常的生理现象,消除多余的组织并维护成熟组织的稳态,当发生大量细胞凋亡或不正常形式凋亡,将会影响机体的正常,在神经系统上可能会表现为神经元的损伤,引起神经系统疾病。LIG 可通过降低促凋亡蛋白的表达,增加抑凋亡蛋白的表达,改善细胞抑制线粒体凋亡通路而产生保护神经细胞的作用。Caspase 蛋白的激活在细胞凋亡中至关重要,涉及Bcl-2 原凋亡家族,可促进细胞骨架蛋白和核酸的水解,因此减少细胞凋亡的主要方法是防止 Caspase 蛋白激活[19]。
Zhao 等[10]使用 LIG 治疗 OGD/R 诱导的 PC12 细胞,与模型组比较,LIG 可增加Bcl-2、Beclin1 表达,降低 Bax 表达(P<0.05 或 P<0.01),结果表明 LIG 通过上调Bcl-2 和下调Bax 表达抑制OGD/R 诱导的PC12 细胞凋亡。
Gao 等[20]用 Aβ25-35干预 SH-SY5Y 细胞构建阿尔茨海默病细胞模型,LIG 浓度在 200~400 μmol/L 时,细胞活性显著下降,LIG 浓度为 12.5、25 和 50 μmol/L时显著增强细胞活性,通过细胞染色试验发现LIG 可减轻Aβ25-35诱导的SH-SY5Y 细胞的形态损伤,有效减少细胞凋亡的发生,表明LIG 通过抑制葡萄糖调节蛋白 78(GRP78)/蛋白激酶 R 样内质网激酶(PERK)/核转录因子(CHOP)信号通路的过度激活上调了Bcl-2的表达,下调了Bax 和Caspase-12 表达,从而起到抑制细胞凋亡作用。
Wu 等[7]研究显示,LIG 处理 OGD/R 诱导的 HT-22细胞,显著增加了MMP 和ATP,降低了ROS,进一步诱导了线粒体裂变;LIG 干预MCAO 大鼠,表明LIG可激活AMPK 通路,进而抑制Drp1 和Fis1 的表达来诱导线粒体裂变,从而保护缺血脑卒中神经损伤。
Wu 等[21]研究显示,LIG(1、2 和 4 μmol/L)干预OGD/R 诱导的海马体神经元,细胞凋亡率分别为25.59%、21.54%和17.20%,而模型组的细胞凋亡率为32.73%,LIG 干预组 Bax/Bcl-2 比例降低,表明 LIG 通过激活PI3-K/Akt 信号通路抑制OGD/R 诱导的细胞凋亡;LIG 干预缺血再灌注(I/R)大鼠,LIG(20 mg/kg)组明显减低脑梗死体积,减轻I/R 所致的脑水肿,神经功能评分明显降低,并且体内海马体神经元核仁及其膜保持完好,结果表明LIG 在减轻脑梗死体积、神经损伤、海马体神经元损伤方面具有神经保护作用。
2.4 改善血脑屏障通透性 在中枢神经系统疾病中,BBB 存在于血液和脑之间,能够选择性地阻止有害物质进入大脑,对其内环境的稳定具有重要作用;BBB 结构和功能的完整性与多种神经系统疾病密切相关,其完整性的破坏通常是临床症状出现之前首先发生的病理改变,参与疾病的发生、发展,并影响治疗预后[22-23]。
Wu 等[24]研究显示,与模型组比较,LIG(5、10 和20 μmol/L,24 h)干预组抑制了 OGD 诱导的缺氧诱导因子-1(HIF-1α)和 VEGF 的表达(P<0.01),显著抑制了 OGD 诱导的 HIF-1α 和 mRNA 的上调,抑制了水通道蛋白 4(AQP-4)的表达(20 μmol/L,P<0.01);LIG(20 μmol/L)可抑制OGD 诱导的细胞旁通透性增加(P<0.01),结果表明LIG 容易穿过血脑屏障,可通过抑制 HIF-1、VEGF 和 AQP-4 表达,通过抑制 HIF/VEGF通路降低OGD 诱导的体外血脑屏障的通透性。
鼻腔给药是一种潜在的给药途径,可以将药物转移到大脑,具有高生物利用度的特点。Li 等[8]研究显示,LIG 可防止缺血损伤后的BBB 破坏,与模型组比较,LIG 鼻内预处理可显著降低MCAO 大鼠的伊文思蓝染料渗出量(P<0.01)。
2.5 改善神经元功能 LIG 通过抑制乙酰胆碱酯酶的活性和增加胆碱乙酰转移酶的活性,改善东莨菪碱所致小鼠记忆功能损伤;还可通过抗氧化及增加类胆碱功能活性对慢性脑缺血再灌注导致的认知缺陷和脑损伤起到保护作用。
Xu 等[25]连续使用 LIG(10 mg/kg、40 mg/kg)8周干预APP/PS1 双转基因小鼠,莫里斯迷宫和Y 形迷宫试验结果显示,与空白组比较,LIG(10 mg/kg、40 mg/kg)APP/PS1 双转基因小鼠的记忆缺陷得到了改善(莫里斯迷宫:P<0.05,P<0.05,Y 形迷宫:P<0.05,P<0.05);从 LIG(10 mg/kg、40 mg/kg)干预的小鼠海马和皮质分离的线粒体显示脑内ATP 水平升高,细胞色素C 氧化酶(CCO)和琥珀酸脱氢酶(SDH)活性增加,增强PSD-95、突触素(SYN)和 SYN1 的表达,表明 LIG(10 mg/kg、40 mg/kg)可改善 APP/PS1 双转基因小鼠线粒体动力学和形态学问题,减轻线粒体功能障碍,保护脑突触,降低大脑中Aβ 水平,改善APP/PS1 小鼠记忆缺失。
Kuang 等[26]研究显示,使用 LIG 干预 APP/PS1 转基因小鼠时,行为测试表明,与对照组比较,长期服用LIG(30 mg/kg,14 周)明显增强了小鼠的短期记忆(P<0.05)和长期记忆(P<0.05);免疫组化分析试验结果表明LIG 可预防APP/PS1 小鼠模型神经元丢失。
2.6 其他 藁本内酯除上述神经保护作用外,还可通过其他途径对神经损伤起到保护作用。自噬是降解和清除有毒蛋白质的重要途径,脑内自噬-溶酶体系统缺陷是阿尔茨海默病神经系统疾病的可能病因之一[27]。Gao 等[20]研究用 Aβ25-35干预 SH-SY5Y 细胞构建阿尔茨海默病细胞模型,LIG 治疗后降低了LC3B-Ⅱ/Ⅰ比值和选择性自噬接头蛋白(P62/SQSTM1)的表达,显著上调溶酶体酸度和组织蛋白酶D 的表达,挽救溶酶体功能,促进自噬通量。LIG 可调节自噬-溶酶体通路,改变溶酶体功能,促进自噬通量发挥神经保护作用。
Klotho 是一种抑制衰老的基因,其编码一种蛋白质,在大脑海马和脉络膜、肾脏、眼睛中表达,这种蛋白质可能起到神经保护因子的作用。Long 等[14]研究利用立体定位技术和慢病毒系统成功下调了Klotho在BCCAO 后小鼠脉络膜丛中的表达,LIG 干预后,经免疫组织化学测定法测定发现LIG 可上调Klotho 在脉络膜丛中的表达,经免疫分析表明Klotho 的下调可减弱LIG 对BCCAO 后小鼠CA1 和Cpu 区域神经元的保护作用,提示Klotho 表达上调有助于LIG 对缺血性脑损伤的神经保护。
促生长因子(IGF-1)信号通路诱导PI3-K 的激活,进而诱导Akt/mTOR,下调mTOR 活性,激活自噬,清除错误折叠的蛋白质,包括 Aβ 斑块[28]。Kuang等[26]研究显示 LIG 可显著减少 APP/PS1 双转基因小鼠中Akt 和mTOR 的表达;并通过小干扰RNA(siRNA)敲除Klotho 基因表达显著增加APP/PS1 双转基因小鼠的IGF-1R 磷酸化,增加了Akt 和mTOR的磷酸化,结果表明抑制Klotho 基因表达可导致LIG介导的IGF-1 通路抑制消失,这表明LIG 对IGF-1通路的抑制是通过上调内源性Klotho 介导的。
成人中枢神经系统与周围神经系统不同,不能自行修复,因此也可通过干细胞移植达到修复目的,最终达到治疗目的。Chi 等[29]研究显示经 LIG 预处理的脂肪间充质干细胞植入脑卒中小鼠的治疗效果优于未经LIG 预处理的脂肪间充质干细胞植入脑卒中小鼠,且LIG 浓度为2.5 μg/ml 为最佳浓度,既防止对细胞生长的抑制,又增加神经元分化促进基因表达,抑制免疫反应;脂肪干细胞移植和LIG 注射联合治疗对中风小鼠的运动活动和卒中后恢复也有改善,表明LIG 还有助于提高脑卒中干细胞治疗。
苯酞类成分是伞形科植物的特征性成分之一。LIG 具有预防和治疗神经损伤的前景,苯酞类成分丁苯酞最初是从伞形科植物芹菜籽中提取而得,其制剂在治疗缺血性脑卒中疾病疗效显著[30]。也有研究表明,对其他神经损伤疾病有潜在的应用前景[31]。研究[5]显示,LIG 的代谢物洋川芎内酯H、洋川芎内酯Ⅰ具有神经保护作用。Zhang 等[32]研究对 LIG 进行结构修饰,合成高度稳定的LIG 衍生物,并用LIG 衍生物干预大鼠,口服 LIG 衍生物(90 mg/kg、45 mg/kg)的绝对生物利用度分别为72.57%和83.97%;组织分布试验表明,LIG 衍生物易通过血脑屏障,广泛分布在各个器官;并通过小鼠的急性毒性试验对LIG 衍生物进行了初步的安全性评价,试验结果表明LIG 衍生物剂量为5.0 g/kg 时,小鼠健康状况良好,主要脏器未见组织病理改变。此研究为LIG 的充分利用奠定了基础。Zou 等[33]研究显示苯酞类衍生物 CD21 干预 MCAO 大鼠,在12 h 治疗时间窗以剂量依赖方式显著改善梗死体积和神经功能缺损,给予CD21[5 mg/(kg/d)]24 h内可显著减轻其病理损伤,抑制PRX1 表达,降低TLR4/NF-κB 活化,抑制炎症反应,CD21 在缺血性脑卒中的治疗中具有一定的神经保护和抗炎作用,且具有较宽的时间窗。Li 等[34]研究含川芎的通窍活血汤肝血干预脑缺血模型大鼠,与模型组比较,给药通窍活血汤上调了闭锁小带蛋白(ZO-1)(P<0.05;3、6和 12 g/kg)、紧密连接蛋白(occludin)(P<0.01;3、6和12 g/kg)、血脑屏障紧密连接蛋白(Claudin-5)(P<0.01;6 和 12 g/kg)的表达,下调AQP-4(P<0.01)和 MMP-9(P<0.05)的表达,试验数据表明通窍活血汤可保护海马体神经元,减少紧密连接的开放,降低血脑屏障的通透性;在脑缺血模型大鼠脑脊液中检测到藁本内酯、麝香酮和羟基红花A,表明这些化合物为通窍活血汤保护血脑屏障的主要活性成分。这些试验结果提示含有苯酞类成分的当归、川芎等伞形科植物在神经保护方面存在潜在的治疗价值。
综上,LIG 在体内试验、体外试验以及不同生物或细胞模型中均表现出不同程度的神经保护作用,LIG神经保护作用并不是单一的,可以调节神经系统中多个细胞因子和通路,共同作用于神经损伤,从而改善神经损伤,起到治疗作用。目前国内外对LIG 保护神经系统的报道主要集中在抑制氧化应激、抑制炎症反应、神经保护作用等方面,也是今后对LIG 研究的重点所在,这些机制阐明LIG 对缺血性脑卒中、阿尔茨海默病等神经损伤良好的调节与治疗作用,是一种潜在的神经损伤治疗药物。本文综述了LIG 在神经损伤保护作用方面的作用,利用LIG 在治疗神经损伤疾病的开发和发展提供了基础理论依据,同时也为含LIG 的中药在神经损伤方面的开发应用提供参考。
