一种数字免疫检测系统的设计与性能测试
2022-03-16窦雪晨杜耀华
王 冠,窦雪晨,张 宁,李 抄,邓 橙,杜耀华
(军事科学院系统工程研究院卫勤保障技术研究所,天津 300161)
0 引言
随着现代制药、微电子、高分子材料等领域的飞速发展,由病原微生物引发的疾病种类日趋复杂,部分致病菌能在短时间内对环境、水质、生产产品造成污染[1]。微生物检测刻不容缓。具有高灵敏检测能力的数字免疫技术应运而生,并且在医学诊疗等方面得到了成功应用[2]。2014年,美国Quanterix公司将数字免疫技术与酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)方法结合,成功设计了单分子免疫阵列,将微生物检测下限降低为原来的千分之一[3]。
在数字免疫技术诞生之前,传统免疫检测方法的原理是将抗原或抗体随机固定在二维载体上,捕获目标物的效率较低且不稳定,导致检测灵敏度偏低且精密度较差[4]。此外,酶联免疫吸附、免疫层析、化学发光等方法检测的是样本体系中待测目标物与检测试剂反应信号的总和,并通过信号的总体强度来估算目标物浓度,导致检测灵敏度较低[5-6]。而数字免疫检测方法一般在均匀液相体系下完成免疫反应[7-8],反应充分且重复性好,并通过不同的技术手段将目标物固定下来,再利用高分辨力荧光成像技术对其进行检测,可实现目标物的“逐个”精确计数,从而实现精准定量,因此能够达到较高的分辨力[9-11],并在实现精确定量的同时提高检测灵敏度[12-14]。
2017年,Farka等[10]提出了数字夹心免疫测定法,使用检测体系为38 nL的96孔微量滴定板进行细菌检测,达到优于商业ELISA的检测灵敏度;同年,Scheler等[15]设计了ddCFU结构来定量检测细菌,检测体系为3μL,可实现对106cfu/mL以上浓度样本的检测。本研究基于数字免疫技术原理,设计开发一套高灵敏度的病原微生物检测系统,以105μL的试剂体系可以实现最低浓度为103cfu/mL样本的检测,可为研制新一代检测设备提供技术支持。
1 硬件设计
本系统的硬件部分主要包括数字免疫流体芯片和成像检测系统。其中数字免疫流体芯片用于试剂反应与检测,成像检测系统用于获取样本检测图像。
1.1 数字免疫流体芯片设计
数字免疫技术可实现对目标微生物的高灵敏度定量检测,但目前国内针对该技术的研究较少。基于该技术所设计的自动检测设备一般集成多自由度精密定量移液结构,以确保在试剂添加和样本清洗过程中试剂体系的精确定量和最终检测结果的准确性,因此通常体积较大,制造成本较高[16]。为解决这些问题,本文设计了一种数字免疫流体芯片,以简化样本处理流程,同时该芯片设计增加了试剂检测体系,便于实现低浓度样本中目标微生物的检测。
如图1(a)所示,数字免疫流体芯片由石英玻璃(上层)、有机玻璃(中层)、石英玻璃(底层)3层组成,上层打出2个圆孔作为清洗液进入和废液排出的通道,中部打空,将密封后的3层玻璃区域作为试剂反应和磁吸附的密闭区域。其中中层有机玻璃厚度为1 mm,圆孔直径为3.5 mm,两圆孔间距为30 mm。如图1(b)所示,将3层玻璃密封后,可形成105μL的试剂反应区间。相对于38 nL的96孔微量滴定板[10]、ddCFU结构的3μL[16]的检测体系,该芯片105μL的试剂体系有利于提高检测灵敏度。
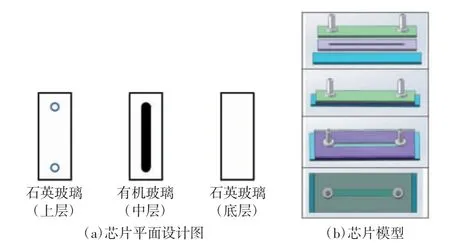
图1 数字免疫流体芯片设计图
1.2 成像检测系统设计
伤寒沙门氏菌、大肠埃希菌、金黄色葡萄球菌等常见致病菌的外形尺寸为1~2μm,检测这些细菌所使用的量子点荧光标记物的粒径为100~120 nm,因此细菌在经过免疫荧光标记后,外形尺寸不会发生明显变化。相对于传统的免疫层析检测,数字化免疫检测需要更高的成像分辨力。首先使用尼康Eclipse Ti2荧光显微镜对样本进行成像性能效果评估,将106cfu/mL的样本加入腔室厚度为30μm的细胞计数板进行荧光成像。图2分别为4×、10×和20×物镜条件下的荧光显微图像,4×物镜无法对荧光标记后的单细菌进行成像,10×和20×物镜均可以实现单细菌荧光成像。20×物镜的荧光图像分辨力更高,但同时会导致成像视场等比例缩小,单次成像区域仅为0.6 mm×0.5 mm,而10×物镜条件下单次成像区域为1.2 mm×0.9 mm。

图2 不同放大率物镜荧光显微图像
针对数字免疫样本检测需求,本文设计了中继镜头,用于提高单次成像检测区域,并缩小成像模组体积,从而为后续样机的小型化奠定基础。图3为设计的镜头结构和成像分析,该镜头物像共轭距离为103.6 mm,成像波长范围为500~650 nm,物方数值孔径为0.28 mm(与常规的10×显微物镜相同),物方视场为3 mm。该镜头可以达到常规显微镜10×物镜的成像效果,但结构相对简化,物像共轭距离缩小约30%。
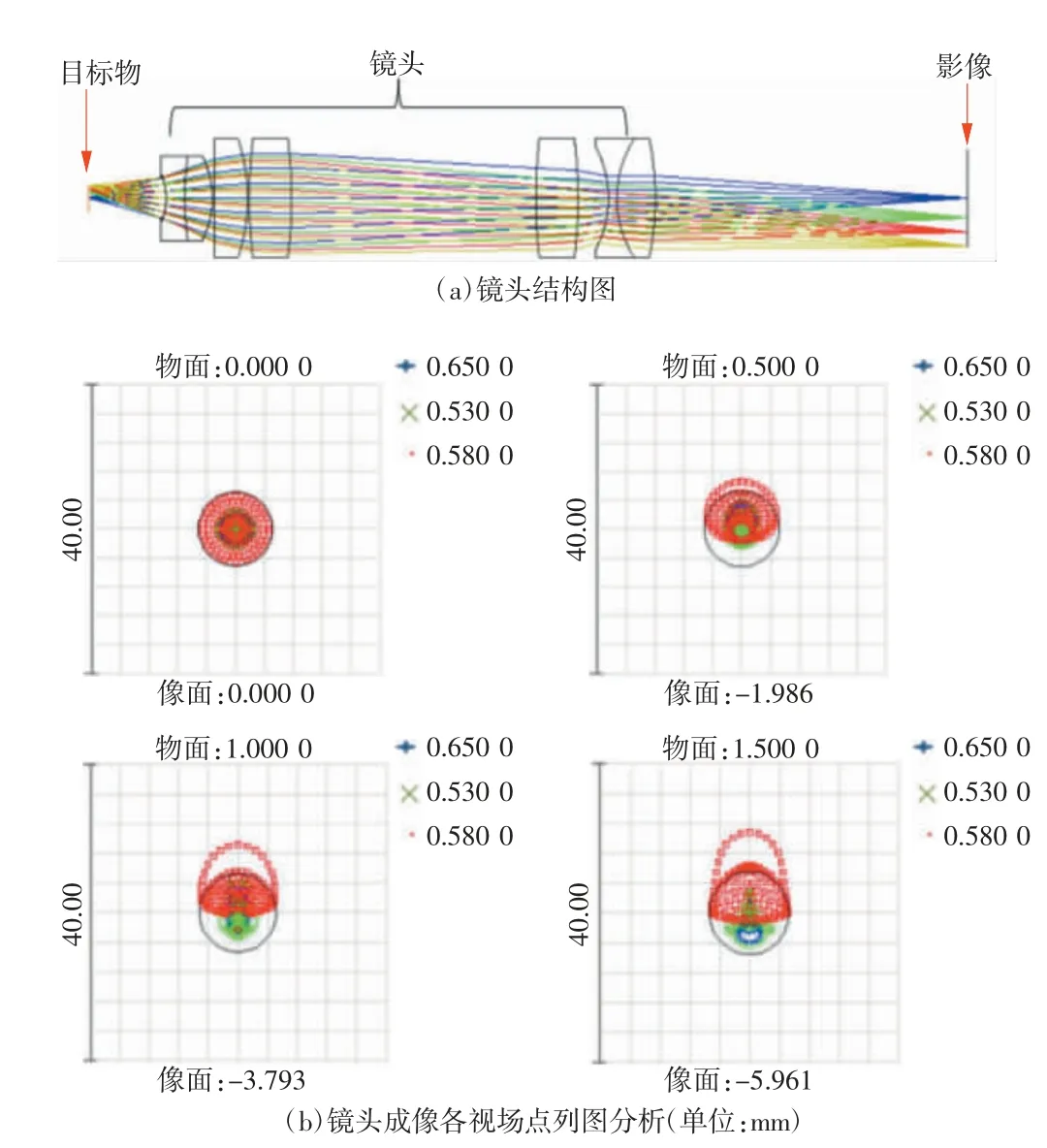
图3 镜头结构及成像分析
基于设计的中继镜头,完成成像检测系统设计,由中继镜头、光源、摄像机、分光片、滤光片等组成,如图4所示。光源为3 W级的大功率LED,中心波长为375 nm;相机为MV-CE200-10UC,分辨力为2 000万像素,单像素大小为2.4μm;照明采用同轴照明方式,二色分光片将照明光源发出的入射光和样本荧光信号发出的反射光进行区分,避免光线重合造成干扰,并在相机前设置荧光滤光片FL2,用以消除照明光散射干扰。
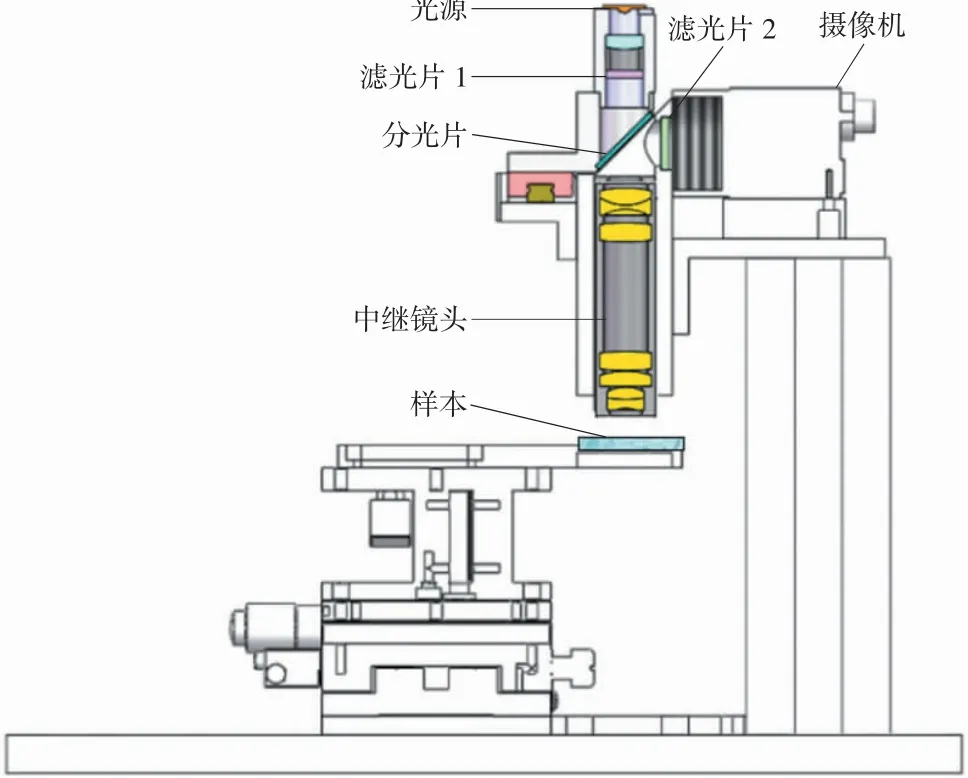
图4 成像检测系统组成图
2 算法设计
信号处理算法采用MATLAB编程编写。该算法对系统扫描所得到的荧光信号数据进行处理,通过噪点去除、荧光点筛选、信号增强等操作,达到对荧光信号准确提取的效果。首先进行灰度处理,将原本的RGB三重数据进行简化。然后对图像进行二值化操作,其原理是将图像上像素点的灰度值设置为0或255,也就是令整个图像呈现出明显的黑白效果,将256个亮度等级的灰度图像通过适当的阈值选取实现对图像的进一步处理,并且数据量的减少能更清晰地凸显出待测目标的轮廓。腐蚀算法通过去除最外围边界点,令边界向内部收缩,可实现随机噪点的去除,具体操作为:用3×3的结构元素扫描图像的每一个像素,用结构元素与其覆盖的二值图像进行“与”操作,如果二者都为1,则该像素值设置为1,否则为0。膨胀算法是将与物体接触的所有背景点合并到该物体中,从而实现从边界向外部扩张的过程,一方面可填补物体中的空洞,另一方面可还原腐蚀后的特征点,具体操作为:用3×3的结构元素扫描图像的每一个像素,用结构元素与其覆盖的二值图像进行“与”操作,如果都为0,则该图像的像素值为0,否则为1。算法具体流程如图5所示。
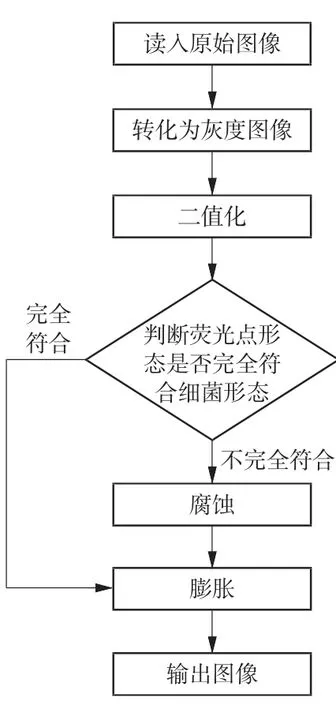
图5 算法具体流程图
3 实验流程
实验操作具体流程如图6所示。先将反应试剂加入流体芯片中,并在芯片上层小孔中分别连接进样和排样软管。再将流体芯片置于观测台上,控制底部磁铁垂直上升至观测台底,实现对夹心免疫复合物的吸附。单片机驱动蠕动泵匀速转动,从左侧将清洗液缓缓推入密闭反应区,控制清洗液输入速度适中,既保持夹心免疫复合物的均匀分布,又能够将反应区的杂质清洗干净。清洗后的废液经右侧软管排出。该清洗过程重复3次。
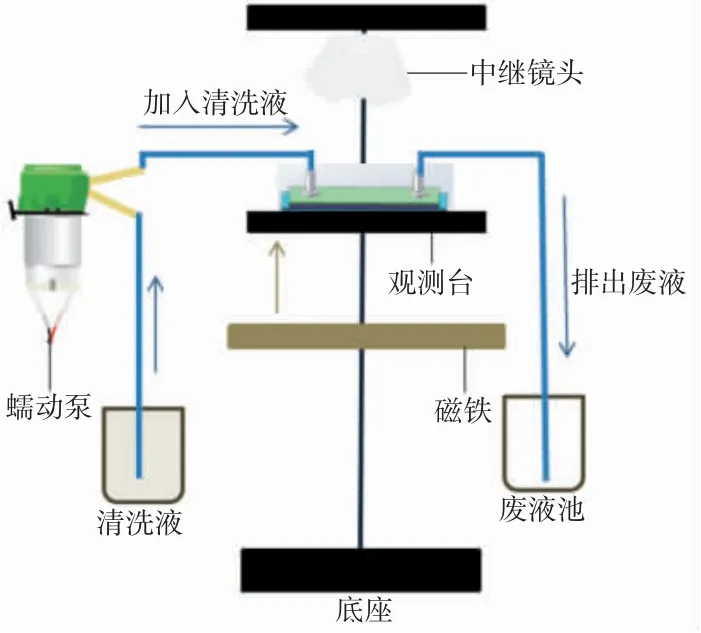
图6 实验流程图
在此实验流程的基础上,针对系统扫描成像控制需求,编程实现样本自动化冲洗和荧光计数检测。整体实验流程如图7所示。添加试剂后,将磁铁平移至芯片底部进行吸附,通过单片机驱动蠕动泵的方式加入清洗液对反应区间进行清洗,再将磁铁移开令试剂静置,该步骤重复3次;随后打开激发光源进行荧光图像采集;为了防止灯光直射令荧光信号淬灭,在每次采集后将激发光源关闭,调整视角后再将其重新打开,按此步骤分区域成像15次,以完成对反应区的全面成像。
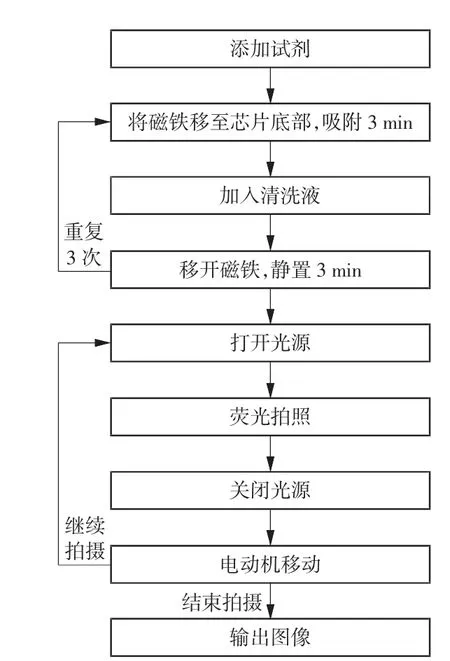
图7 整体实验流程图
4 性能测试
4.1 材料
伤寒沙门氏菌[北京生命科学研究所CMCC(B)50071],营养肉汤(北京奥博星生物技术有限责任公司),AS316011型氨基磁珠(洛阳惠尔纳米科技有限公司),FM610C型量子点标记物(北京纳诺金生物科技有限公司)。SPX-100B-Z型生化培养箱(上海博迅实业有限公司医疗设备厂),tbbl-1玻璃涂布棒(海门维平实验器材厂),HH-2型数显恒温水浴锅(常州越新仪器制造有限公司)。
4.2 检测样本制备方法
本实验基于数字免疫技术原理,以伤寒沙门氏菌为样本,选取具备特异性吸附能力的磁珠和具有荧光染色能力的量子点试剂制备3层夹心免疫复合物,以此作为检测系统性能评价的样本。
以10倍为梯度制备102~105cfu/mL浓度的4组伤寒沙门氏菌菌液,并取磷酸缓冲盐溶液(phosphate buffer saline,PBS)制备对照组。将90μL菌液、PBS分别和10μL氨基磁珠、5μL量子点试剂加入流体芯片中,于37℃条件下反应30 min。
取102~105cfu/mL浓度的4组伤寒沙门氏菌菌液,每组各200μL进行平板培养:无菌环境下取菌液滴加在固体培养基表面,使用玻璃涂布棒将其涂抹均匀,置于37℃的生化培养箱中培养12 h并计数。在实验过程中,同步制备2个平行样,平板计数结果取平均值。
将芯片内反应后的试剂进行3次冲洗后再进行检测。视野范围为3 mm×2 mm,选取10~15个视野并对视野中的荧光点进行计数,将计数结果求取平均值后,转化成单位为cfu/mL的数值。
4.3 系统性能评价
在成像方面,首先使用USAF 1951标准分辨率板[如图8(a)所示]对本系统的成像分辨力进行测试,图8(b)为图8(a)中心区域放大的效果,其分辨力为228 lp/mm;其次利用网格分划板对系统成像的视场进行测试,结果如图9(a)所示,网格间距为0.2 mm,因此单次成像视场为3 mm×2 mm;最后,针对实际样本进行荧光检测,结果如图9(b)所示,可以实现对单个细菌荧光的成像。

图8 标准分辨率板成像测试

图9 样本成像结果
对本系统进行样本测试后,部分检测图像如图10所示。PBS的检测结果为67 cfu/mL,与本系统102cfu/mL及以下浓度样本检测结果较接近,因此无法证明102cfu/mL及以下浓度样本可被准确检测。最终,确定本系统可准确检测的范围为103~105cfu/mL。

图10 不同浓度下不同视野的实验图像
对平板培养后的培养基内菌落数目进行统计,组别间取平均值,作为检测效率评估的重要参考,最终得到原菌液平板培养结果分别为3.5×103、2.1×104以及1.1×105cfu/mL,反应后的计数结果分别为3.3×103、1.9×104以及1.0×105cfu/mL。
将实验所得到的反应结果和对应浓度原菌液平板培养结果进行比值处理,可计算出检测效率分别为94.28%、90.47%以及90.90%,证明本系统对于伤寒沙门氏菌能够实现高效率、高灵敏度的检测。
5 讨论
本研究针对微生物检测的需求,基于数字免疫技术设计了可实现高灵敏度检测的数字免疫检测系统:设计并制备了数字免疫流体芯片,简化了样本前处理的操作流程;针对荧光显微成像要求,设计了荧光成像中继镜头,相对常规荧光显微镜,扩大了单次检测成像视野,并缩小了体积;利用单片机驱动蠕动泵实现试剂自动添加和清洗,简化了操作流程;利用MATLAB设计图像提取算法,完成了对荧光信号的准确提取。采用伤寒沙门氏菌作为检测样本,对系统性能进行评价,检测灵敏度为3.5×103cfu/mL。
Farka等[10]设计的96孔微量滴定板样本检测体系为38 nL,Scheler等[15]设计的ddCFU样本检测体系为3μL,两者均无法实现对低浓度样本的准确检测。本研究设置的105μL的试剂体系可以实现最低浓度为103cfu/mL样本的检测,降低了样本检测浓度下限,有利于提高检测灵敏度。Yang等[8]对于伤寒沙门氏菌的检测灵敏度为1.14×105cfu/mL,夏诗琪等[9]对沙门氏菌进行了检测,实验时间为8 h。本研究设计的系统检测时间缩短至30 min,检测灵敏度提升至3.5×103cfu/mL。
但本研究依旧存在一些不足:(1)仅选择了1种细菌作为检测样本,虽然进行了多批次大量数据的采集,但是仍然不能完全排除单一样本对系统性能评价结果的影响。(2)MATLAB属于比较陈旧的方法,在应用方面尚有提升空间。
总之,本系统可对荧光信号进行准确捕捉,从而实现对伤寒沙门氏菌的高灵敏度检测。与现有的数字免疫检测系统相比,本系统降低了成本,提高了检测灵敏度,在微生物检测及定量分析检测领域具有广阔的应用前景。在上述工作的基础上,下一步将开展基于多色量子点标记的病原微生物数字免疫检测方法研究,以实现未知病原的多靶标同步检测,并对算法进行分析优化,实现荧光信号的更精准采集。
