天然低共熔溶剂提取杜仲叶绿原酸及其抗氧化活性
2022-03-16王志宏张光耀杜志云彭密军
郁 峰, 王志宏, 张光耀, 杜志云, 彭密军*
(1.广东省科学院测试分析研究所(中国广州分析测试中心) 广东省化学危害应急检测技术重点实验室,广东 广州 510070; 2.广东工业大学 生物医药学院,广东 广州 510070)
杜仲又名思仲、思仙等,是我国名贵中药材,杜仲叶和皮有着相似的化学成分和药理特性。绿原酸为杜仲叶主要活性成分之一,为《中国药典》2020版中给出的杜仲叶标志性成分,具有抗氧化、抗紫外、抗辐射、抗菌、保护心血管、调节免疫等多种药理作用[1],在生物、医药、食品和化工等领域都具有广泛的应用。已有研究表明,癌症、衰老或其他疾病大都与过量自由基的产生有关,而绿原酸的抗氧化作用可以有效克服自由基所带来的危害。如何高效和绿色地从杜仲叶中提取绿原酸一直备受关注。传统有机溶剂如乙醇、氯仿和乙酸乙酯等作为提取剂广泛应用于制药、食品、化妆品等行业中,但大量使用有机溶剂会污染环境,并存在溶剂残留,所以选择一种天然、绿色的提取溶剂十分重要。天然低共熔溶剂(NADES)[2-3]是具有类似离子液体(ILs)物理性质的溶剂。目前已有报道由胆碱、尿素[3]、有机酸[4]和糖[5]等不同组分组成的NADES。与ILs和传统有机溶剂相比,NADES具有经济、环保等优势,如可生物降解、可回收、成本低、制备方法简单等。此外,NADES对非极性和极性化合物都具有很强的增溶能力,并对生物活性成分具有较高的提取效率[6],同时NADES可以溶解大分子[7]。因此,将NADES用作溶剂来提取有价值的生物活性成分在食品、化妆品和制药行业中具有巨大的发展前景。NADES替代传统溶剂对红花中酚类次生代谢物[8]、槐花中总黄酮[9]、丹参中生物碱[10]、沙棘籽粕中多酚[11]等的提取已有报道,但还没有NADES用于提取杜仲叶中绿原酸的报道。本研究以杜仲叶为原料,采用超声波辅助NADES提取杜仲叶中的绿原酸,通过单因素试验及响应面优化确定最佳提取工艺,进一步考察杜仲叶绿原酸提取物的抗氧化活性,以期为杜仲叶在制药、食品、化妆品等行业中的开发和利用提供理论基础。
1 实 验
1.1 材料、试剂与仪器
杜仲叶于2017年8月采于吉首大学张家界校区杜仲试验基地,经吉首大学谷伏安副教授鉴定为杜仲科杜仲属杜仲(EucommiaulmoidesOliver)样品,采集后于50 ℃烘干,粉碎、过筛,取粒径小于300 μm的部分装袋于常温下保存,备用。绿原酸标准物质(纯度大于99%)购于美国Sigma公司;氯化胆碱、甜菜碱、L-乳酸、山梨醇、尿素、DL-苹果酸、D-果糖、葡萄糖、柠檬酸、抗坏血酸(Vc)、无水乙醇均为市售分析纯;试验所用水均为超纯水。
LC-20A高效液相色谱(HPLC)仪,日本岛津公司;C18色谱柱(250×4.6 mm,5 μm),美国Boston公司;5840R高速离心机,德国艾本德公司;C-MAG HS7加热磁力搅拌器;BSA2245电子天平;AS20500BT超声波仪,天津奥特赛恩斯有限公司。
1.2 天然低共熔溶剂筛选
1.2.1溶剂体系的筛选 制备10种不同体系的天然低共熔溶剂(NADES)用于提取杜仲叶中绿原酸,以绿原酸得率为评价指标,筛选出合适的溶剂体系。采用加热搅拌的方法制备[7],将氯化胆碱/L-乳酸/水、氯化胆碱/葡萄糖/水、氯化胆碱/DL-苹果酸/水、氯化胆碱/D-果糖/水、氯化胆碱/尿素/水、甜菜碱/DL-苹果酸/水、甜菜碱/L-乳酸/水、甜菜碱/柠檬酸/水、柠檬酸/D-果糖/水和柠檬酸/D-山梨醇/水10种NADES按物质的量比1 ∶1 ∶4放入烧杯中,用磁力加热搅拌器在60 ℃下搅拌为澄清均一的液体(约20~50 min),即得制备好的溶剂。准确称取杜仲叶粉0.5 g于锥形瓶中,各加入10 mL的10种自制NADES、水和60%乙醇,混匀后超声波辅助提取,提取条件为超声波功率300 W、提取时间30 min、提取温度为40 ℃,提取后离心得上清液于4 ℃保藏待测。
1.2.2溶液配比 以甜菜碱/L-乳酸/水为溶剂体系,讨论3者用量对杜仲叶中绿原酸提取得率的影响。提取条件同1.2.1节。讨论水用量影响时,固定甜菜碱和L-乳酸用量为1 mol,水用量分别为1、 2、 4、 6、 10 mol。然后固定水用量为4 mol,讨论甜菜碱和L-乳酸用量的影响。
1.3 杜仲叶绿原酸提取工艺优化
1.3.1单因素试验 确定NADES溶剂体系后,考察不同因素对杜仲绿原酸提取的影响。设置的单因素分别是:液料比(5 ∶1、 10 ∶1、 20 ∶1、 30 ∶1、 40 ∶1,mL ∶g);提取时间(10、 30、 50、 70、 90 min);提取温度(30、 40、 50、 60、 70 ℃);超声波功率(100、 200、 300、 400、 500 W)。
1.3.2响应面优化工艺 在前期研究的基础上,选择影响较大的3个因素提取时间(X1)、超声波功率(X2)、NADES中水用量(X3)为自变量,绿原酸得率(Y)为响应值,根据Box-Behnken中心组合实验原理,设计3因素3水平响应面分析试验。
1.4 杜仲叶绿原酸得率的测定
1.4.1HPLC分析条件 C18色谱柱;流动相为乙腈与0.4%磷酸(体积比13 ∶87,下同);柱温箱温度30 ℃;紫外检测器,检测波长327 nm;检测时间15 min,进样量10 μL。
1.4.2绿原酸标准曲线 精密称取20 mg绿原酸标准品,用乙腈与0.4%磷酸溶液定容至100 mL,制得母液。分别取0.5、 1.0、 2.0、 3.0、 4.0、 5.0 mL母液至10 mL容量瓶中定容至刻度,得到一系列对照品溶液,采用HPLC测定峰面积,以峰面积(y)对对照品质量浓度(x)作图,得到标准曲线y=30 656.43x-44 030.48(R2=0.999 1)。
1.4.3样品制备 绿原酸提取液稀释20倍过0.45 μm膜后进样分析,得到峰面积后代入标准曲线得到稀释液中绿原酸质量浓度。按下式计算绿原酸得率:
Y=C×V×N/M
(1)
式中:Y—绿原酸得率,mg/g;C—稀释液中绿原酸质量浓度,g/L;V—提取溶液体积mL;N—稀释倍数;M—杜仲叶原料质量,g。
1.5 绿原酸提取物抗氧化能力测试
1.5.1羟基自由基清除率 羟基自由基(·OH)是动物体内常见的活性氧,会对生物分子(如脂质、蛋白质和核酸)造成严重损害。试验使用·OH试剂盒测定杜仲叶绿原酸提取物对·OH的清除效果。测定原理为通过 Fenton反应产生·OH,提供供电子受体,电子转移后用griess试剂显色,可形成红色物质,据颜色深浅定量测定样本的抑制·OH产生的能力[12]。先配制不同质量浓度的杜仲叶绿原酸提取物(NADES提取物、水提取物和60%乙醇提取物)及阳性对照品Vc(100、 200、 300、 400和500 mg/L),分别取1 mL配制好的溶液于10 mL试管中,按试剂盒加入过氧化氢溶液、铁离子溶液后混匀,室温下反应1 min后,加入griess显色剂混匀,室温静置20 min后,在550 nm波长下检测吸光度,分别计算杜仲叶绿原酸提取物·OH清除率(R1,%),以未加样的试剂作为空白对照,计算公式如式(2):
R1=(A-B)/A×100%
(2)
式中:A—空白对照吸光度;B—样品吸光度。
1.5.2DPPH自由基清除率 1,1-二苯基-2吡啶酰肼自由基(DPPH·)有单电子,其醇溶液颜色呈紫色,在515 nm处有强吸收。当有抗氧化剂存在时,DPPH自由基被清除,溶液颜色变浅,515 nm处的吸光度下降,在一定范围内其吸光度的变化与自由基被清除的程度成正比[13]。首先配制不同质量浓度杜仲叶绿原酸提取物(NADES提取物、水提取物和60%乙醇提取物)及阳性对照品Vc(20、 40、 60、 80和100 mg/L),分别取2 mL配制好的溶液于10 mL试管中,加2 mL DPPH·的醇溶液后混匀,于黑暗中25 ℃ 水浴下保温30 min后,在515 nm波长下检测吸光度值,分别计算杜仲叶绿原酸提取物对DPPH·的清除率(R2,%),以未加样的试剂作为空白对照,计算公式如式(3):
R2=(Ai-Bi)/Ai×100%
(3)
式中:Ai—空白对照吸光度;Bi—样品吸光度。
1.5.3ABTS自由基清除率 按照Re等[14]的方法测定提取物的ABTS自由基(ABTS·)清除活性。ABTS·是通过ABTS储备溶液与过硫酸钾以体积比2 ∶1反应产生,混合物在使用前在室温下黑暗放置16 h。使用前用无水乙醇稀释ABTS储备溶液与过硫酸钾的混合液至吸光度为0.70±0.02,得到ABTS工作溶液。配制不同质量浓度杜仲叶绿原酸提取物(NADES提取物、水提取物和60%乙醇提取物)及阳性对照品Vc(10、 20、 30、 40和50 mg/L),分别取0.4 mL配制好的溶液于10 mL试管中,加入3.6 mL ABTS工作溶液后混匀,室温下反应6 min后,在734 nm波长下检测吸光度,分别计算杜仲叶绿原酸提取物对ABTS·的清除率,以未加样的试剂作为空白对照,计算公式如式(4):
R3=(Aii-Bii)/Aii×100%
(4)
式中:Aii—空白对照吸光度;Bii—样品吸光度。
1.6 数据分析
采用Excel 2007,GraphPad Prism 7.0进行数据处理分析,每组实验均设3次重复实验。
2 结果与讨论
2.1 天然低共熔溶剂筛选
2.1.1溶剂体系筛选 氯化胆碱/L-乳酸/水、氯化胆碱/葡萄糖/水、氯化胆碱/DL-苹果酸/水、氯化胆碱/D-果糖/水、氯化胆碱/尿素/水、甜菜碱/DL-苹果酸/水、甜菜碱/L-乳酸/水、甜菜碱/柠檬酸/水、柠檬酸/D-果糖/水、柠檬酸/D-山梨醇/水,以及水和60%乙醇提取杜仲叶绿原酸的得率分别为30.15、 16.02、 20.86、 17.75、 28.10、 22.79、 30.21、 23.59、 19.65、 17.86、 26.95和27.78 mg/g,其中甜菜碱、L-乳酸和水组成的NADES溶液体系提取绿原酸的得率最高,为30.21 mg/g,相比水提与醇提方法分别提高了12.10%和8.75%。因此选择甜菜碱/L-乳酸/水组成的NADES溶液体系进行后续实验。
2.1.2溶剂配比选择
2.1.2.1水用量 准确称取杜仲叶粉0.5 g于锥形瓶中,加入10 mL甜菜碱/L-乳酸/水NADES溶液,在提取温度40 ℃,提取时间30 min,超声波功率300 W的条件下考察NADES中甜菜碱和L-乳酸用量为1 mol时,水用量为1、 2、 4、 6和10 mol对绿原酸得率的影响。随着NADES水用量的增加,绿原酸得率分别为22.11、 26.44、 30.40、 30.39和30.27 mg/g,表明NADES中水用量的增加绿原酸得率呈现先增加后逐渐下降的趋势。其中,当NADES中水用量为4 mol时,提取得率最高为30.40 mg/g。这可能是因为随着NADES中水用量的增加,绿原酸可以充分地溶解,所以提取得率增加。当NADES中水用量达到4 mol 时,绿原酸已基本溶解完全,再增加NADES中水用量对提取得率几乎没有影响。因此,适宜的NADES中水用量为4 mol。
2.1.2.2甜菜碱和L-乳酸用量 确定水用量后,按2.1.2.1节实验条件,用10 mL不同甜菜碱和L-乳酸用量的甜菜碱/L-乳酸/水NADES溶液进行提取,考察各组分不同物质的量比对绿原酸得率的影响。由表1可知,当甜菜碱/L-乳酸/水中各组分的物质的量比为1 ∶1 ∶4 时绿原酸得率最高为31.27 mg/g,而物质的量比为2 ∶1 ∶4时绿原酸得率最低。这主要是由于低共溶溶剂中各组分的比例不同,会影响绿原酸在天然低共溶溶剂中溶解度,因此,适宜的NADES中各组分物质的量比为 1 ∶1 ∶4。

表1 溶剂中各组分配比对绿原酸提取得率的影响Table 1 Effect of the proportion of each component in the solvent
2.2 单因素试验
2.2.1液料比的影响 准确称取杜仲叶粉0.5 g于锥形瓶中,按液料比5 ∶1、 10 ∶1、 20 ∶1、 30 ∶1和40 ∶1(mL ∶g,下同)加入不同体积的甜菜碱/L-乳酸/水NADES溶液(各组分物质的量比1 ∶1 ∶4,下同),在提取温度40 ℃,提取时间30 min,超声波功率300 W的条件下考察液料比对绿原酸得率的影响,结果见图1(a)。
从图1(a)可知,液料比在5 ∶1~30 ∶1范围时绿原酸得率随液料比的增长而增长很快,当液料比达到30 ∶1之后绿原酸得率变化不大。在提取过程中,液料比的提高必然会在较大程度上提高传质推动力,有利于绿原酸得率的增加[15]。然而到达一定液料比时,传质推动力不再增加。因此,适宜的液料比为30 ∶1(mL ∶g),得率29.21 mg/g。
2.2.2提取时间 准确称取杜仲叶粉0.5 g于锥形瓶中,加入10 mL甜菜碱/L-乳酸/水NADES溶液,提取温度40 ℃,超声波功率300 W的条件下考察提取时间(10、 30、 50、 70、 90 min)对绿原酸得率的影响,结果见图1(b)。
从图1(b)可知,绿原酸得率随着提取时间的增加先增高后降低,当提取时间达到30 min时绿原酸得率最高,为30.06 mg/g。这可能是因为在超声波长时间作用下,其他杂质溶出干扰绿原酸的提取,绿原酸得率反而下降。因此,适宜的提取时间为30 min。
2.2.3提取温度 准确称取杜仲叶粉0.5 g于锥形瓶中,加入10 mL甜菜碱/L-乳酸/水NADES溶液,提取时间30 min,超声波功率300 W的条件下考察提取温度(30、 40、 50、 60、 70 ℃)对绿原酸得率的影响,结果见图1(c)。
考虑到温度对活性物质稳定性的影响,将30~70 ℃作为考察范围。从图1(c)可知,当温度在30~50 ℃时,绿原酸得率先增大后降低。40 ℃时绿原酸得率最高,为30.56 mg/g,随后温度增加,绿原酸得率增幅不大。考虑到实际工业应用,故选择40 ℃继续研究。
2.2.4超声波功率 准确称取杜仲叶粉0.5 g于锥形瓶中,加入10 mL甜菜碱/L-乳酸/水NADES溶液,提取温度40 ℃,提取时间30 min的条件下考察超声波功率(100、 200、 300、 400、 500 W)对绿原酸得率的影响,结果见图1(d)。

a.液料比liquid-to-material ratio; b.提取时间extraction time; c.提取温度extraction temp.; d.超声波功率ultrasonic power
由图1(d)可知,绿原酸得率随着功率的增加先增高后降低,当超声波功率达到400 W时绿原酸得率最高,为30.46 mg/g。超声波的功率升高可使溶剂的扩散率提高,并提高化合物的解吸率和溶解性,从而促进成分的溶出。而功率继续升高,有可能导致部分绿原酸解吸,因而得率降低。因此,适宜的超声波功率为400 W。
2.3 杜仲叶绿原酸提取工艺响应面优化
2.3.1响应面优化及实验结果分析 根据溶剂筛选及单因素试验结果,可知提取时间、超声波功率、NADES中水用量对绿原酸得率均有显著影响,故选取提取时间(X1)、超声波功率(X2) 、NADES中水用量(X3)为自变量,绿原酸得率(Y)为因变量,液料比为30 ∶1(mL ∶g),提取温度40 ℃,根据Box-Behnken 中心组合设计原理进行响应面优化,具体方案和结果见表2。
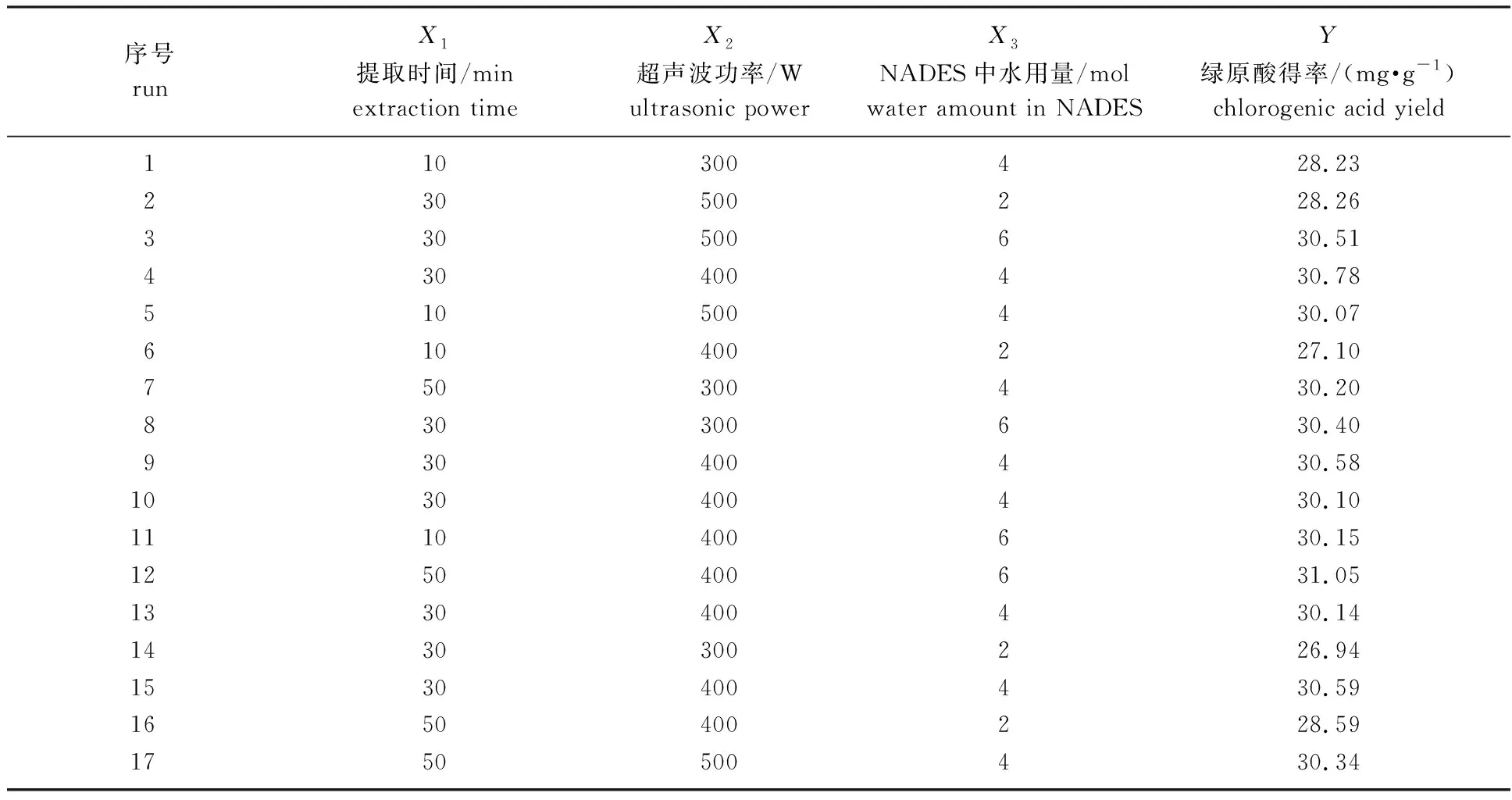
表2 响应面优化结果
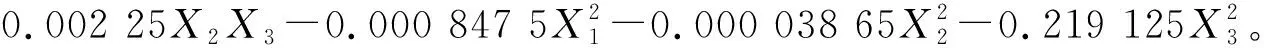
对模型的二次回归方程进行方差分析,结果见表3。

表3 方差分析Table 3 Regression statistical analysis
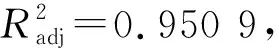
2.3.2最佳条件确定 通过绘制响应曲面图可以更加直观地探讨相关变量之间的交互关系以及变量对响应值的影响趋势。模型的响应曲面图和等高线图如图2,等高线的形状能反映两个因素之间的相互作用情况。若等高线呈椭圆形,则两个因素之间存在显著交互作用;若等高线呈圆形,则两个因素之间的交互作用无显著性。

a.Y=f(X1,X3); b.Y=f(X1,X2); c.Y=f(X2,X3)
由图2可知,提取时间和超声波功率对绿原酸得率有显著交互影响;超声波功率和NADES中水用量对绿原酸得率有显著交互影响。当超声波功率、提取时间、NADES中水用量增加时,响应值呈现出先增加后减少的趋势。响应面试验结果与单因素试验结果相吻合。在响应面设计的因素范围内,按照回归模型利用Design-Expert 10.0.7软件分析得出的绿原酸提取最佳条件为:提取时间42.35 min,超声波功率342.47 W,NADES中水用量为5.43 mol,模型预测最佳绿原酸得率为31.25 mg/g。
2.3.3最佳条件验证 为证实预测结果以及便于实验操作,修正提取条件为甜菜碱、L-乳酸与水的物质的量比为1 ∶1 ∶4,液料比为30 ∶1(mL ∶g),提取温度40 ℃,提取时间42 min,超声波功率340 W,低共熔溶剂中水用量为5 mol,实际绿原酸得率为(31.46±0.25)mg/g,与理论值接近。由此可见,应用响应面优化法确定的绿原酸提取条件具有实际应用价值。与在同等条件下用水或者60%乙醇提取绿原酸相比,NADES提取绿原酸得率分别提高了18.23%(26.61 mg/g)和14.82%(27.40 mg/g)。
2.4 绿原酸提取物抗氧化能力测试
2.4.1DPPH自由基清除率 如图3(a)所示,在质量浓度10~100 mg/L的范围内,杜仲叶绿原酸提取物对DPPH·清除活性表现出剂量依赖性且随着质量浓度的增加逐渐增大,在质量浓度为100 mg/L时NADES提取物对DPPH·的清除率达到最大,为63.80%。计算各物质的半数抑制质量浓度( IC50)值,结果表明:Vc、NADES、水和60%乙醇提取物的IC50值分别为17.36、 75.16、 94.33和67.67 mg/L。由此可知,NADES提取物对DPPH·的清除效果较好,清除率强于水提物低于Vc和醇提物。杜仲叶绿原酸提取物含丰富酚羟基,保证了它提供质子的能力,从而达到清除DPPH·的效果,其具体的机理还有待进一步研究。
2.4.2ABTS自由基清除率 如图3(b)所示,在质量浓度5~50 mg/L的范围内,杜仲叶绿原酸提取物对ABTS·清除活性表现出剂量依赖性且随着质量浓度的增加逐渐增大,在质量浓度为50 mg/L时NADES提取物对ABTS·的清除率达到最大,为80.54%。计算各物质的IC50值,结果表明:Vc、NADES、水和60%乙醇提取物的IC50值分别为6.58、 19.98、 40.03和25.14 mg/L。由此可知,NADES提取物对ABTS·的清除效果较好,清除率强于水提物和醇提物略低于Vc。
2.4.3OH自由基清除率 如图3(c)所示,在质量浓度100~500 mg/L的范围内,杜仲叶绿原酸提取物对·OH清除活性表现出剂量依赖性且随着质量浓度的增加逐渐增大,在质量浓度为500 mg/L时NADES提取物对·OH清除率达到最大,为82.74%。计算各物质的IC50值,结果表明:Vc、NADES、水和60%乙醇提取物的IC50值分别为224.50、 314.20、 448.40和400.10 mg/L。由此可知,NADES提取物对·OH的清除效果较好,清除率强于水提物和醇提物略低于Vc。

图3 不同提取物对DPPH·(a)、ABTS·(b)和·OH(c)消除率的影响
3 结 论
3.1采用超声波辅助NADES提取杜仲叶绿原酸,以绿原酸得率为响应值,通过响应面试验确定杜仲叶绿原酸的最佳提取工艺为:甜菜碱、L-乳酸与水的物质的量比为1 ∶1 ∶4,低共熔溶剂中水用量为5 mol,液料比为30 ∶1(mL ∶g),提取温度40 ℃,提取时间42 min,超声波功率340 W,在此条件下提取杜仲绿原酸得率为31.46 mg/g。
3.2杜仲叶绿原酸NADES提取物具有良好的抗氧化活性,在一定浓度范围内其自由基清除效果与质量浓度呈正相关,清除DPPH自由基的能力强于水提物弱于Vc和醇提物,清除ABTS自由基和羟基自由基的能力强于水提物和醇提物略弱于Vc。
