山东省2022年普通高中学业水平等级考试化学试题解析及主观题参考评分标准
2022-03-15湖北省教育考试院张思佩
■湖北省教育考试院 张思佩
■湖北省武汉外国语学校 孟凡盛(特级教师)
总体评价:本套化学试题很好地落实了“评价学生化学学科核心素养的发展状况和学业质量标准的达成程度”的考试目的,体现了新课程改革的理念。试题设计恰到好处地融合了必修模块和选择性必修模块的内容,考查的知识综合性强、信息丰富、形式多样、考查能力层次分明。试卷难度符合赋分制新高考背景要求,区分度高。
【试题部分】
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 Ti 48 Co 59
一、选择题:本题共10小题,每小题2分。每小题只有一个选项符合题目要求。
1.古医典富载化学知识,下述之物见其氧化性者为( )。
A.金(Au):“虽被火亦未熟”
B.石灰(CaO):“以水沃之,即热蒸而解”
C.石硫黄(S):“能化……银、铜、铁,奇物”
D.石钟乳(CaCO3):“色黄,以苦酒(醋)洗刷则白”
2.下列试剂实验室保存方法错误的是( )。
A.浓硝酸保存在棕色细口瓶中
B.氢氧化钠固体保存在广口塑料瓶中
C.四氯化碳保存在广口塑料瓶中
D.高锰酸钾固体保存在棕色广口瓶中
A.X的中子数为2
B.X、Y互为同位素
4.下列高分子材料制备方法正确的是( )。
5.AlN、GaN属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在N—Al键、N—Ga键。下列说法错误的是( )。
A.GaN的熔点高于AlN
B.晶体中所有化学键均为极性键
C.晶体中所有原子均采取sp3杂化
D.晶体中所有原子的配位数均相同
6.实验室用基准Na2CO3配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定Na2CO3标准溶液。下列说法错误的是( )。
A.可用量筒量取25.00 mL Na2CO3标准溶液置于锥形瓶中
B.应选用配带塑料塞的容量瓶配制Na2CO3标准溶液
C.应选用烧杯而非称量纸称量Na2CO3固体
D.达到滴定终点时溶液显橙色
7.γ-崖柏素具天然活性,有酚的通性,结构如下。关于γ-崖柏素的说法错误的是( )。
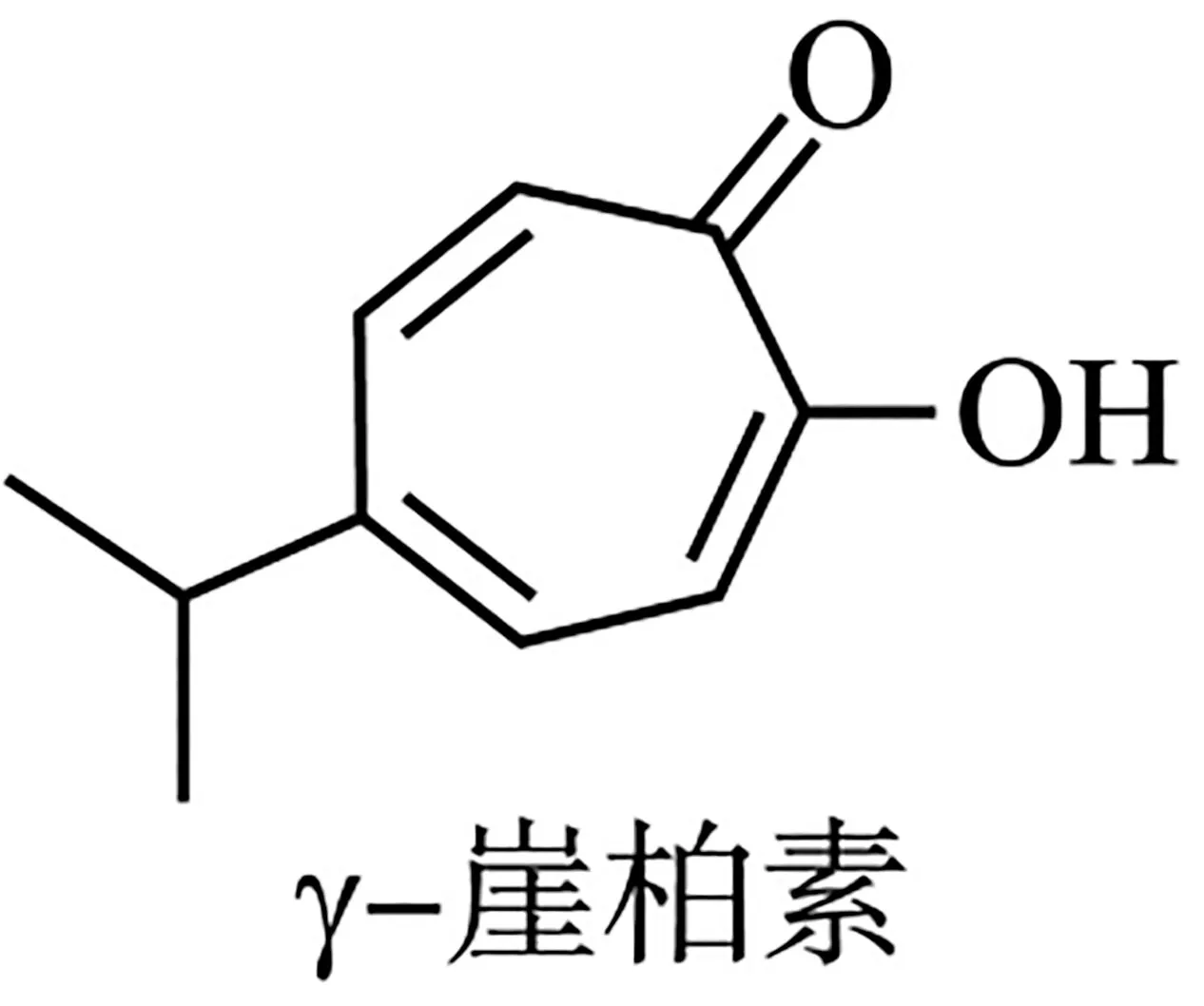
A.可与溴水发生取代反应
B.可与NaHCO3溶液反应
C.分子中的碳原子不可能全部共平面
D.与足量H2加成后,产物分子中含手性碳原子
8.实验室制备KMnO4过程为:①高温下在熔融强碱性介质中用KClO3氧化MnO2制备K2MnO4;②水溶后冷却,调溶液pH至弱碱性,K2MnO4歧化生成KMnO4和MnO2;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得KMnO4。下列说法正确的是( )。
A.①中用瓷坩埚作反应器
B.①中用NaOH作强碱性介质
C.②中K2MnO4只体现氧化性
D.MnO2转化为KMnO4的理论转化率约为66.7%
9.已知苯胺(液体)、苯甲酸(固体)微溶于水,苯胺盐酸盐易溶于水。实验室初步分离甲苯、苯胺、苯甲酸混合溶液的流程如下。下列说法正确的是( )。

A.苯胺既可与盐酸也可与NaOH溶液反应
B.由①③分别获取相应粗品时可采用相同的操作方法
C.苯胺、甲苯、苯甲酸粗品依次由①②③获得
D.①②③均为两相混合体系
10.在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如下所示。下列说法错误的是( )。

A.含N分子参与的反应一定有电子转移
B.由NO生成HONO的反应历程有2种
C.增大NO的量,C3H8的平衡转化率不变
D.当主要发生包含②的历程时,最终生成的水减少
二、选择题:本题共5小题,每小题4分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.某同学按图1所示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液。下列物质组合不符合要求的是( )。

图1

气体 液体 固体粉末A CO2 饱和Na2CO3溶液 CaCO3 B Cl2 FeCl2溶液 Fe C HCl Cu (NO3)2溶液 Cu D NH3 H2O AgCl
12.高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下。

可能用到的数据见表1。
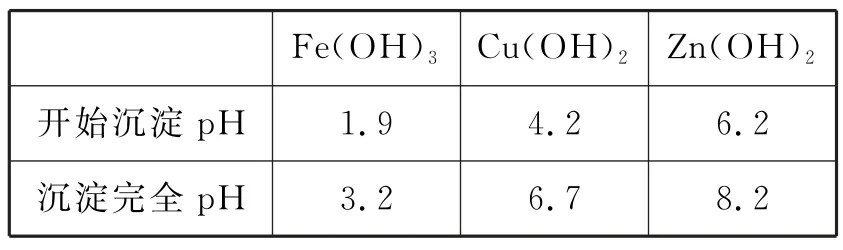
表1
下列说法错误的是( )。
A.固体X主要成分是Fe(OH)3和S,金属M为Zn
B.浸取时,增大O2压强可促进金属离子浸出
C.中和调pH的范围为3.2~4.2
D.还原时,增大溶液酸度有利于Cu的生成
13.设计如图2所示装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是( )。

图2
A.装置工作时,甲室溶液pH逐渐增大
B.装置工作一段时间后,乙室应补充盐酸
C.乙室电极反应式为LiCoO2+2H2O+e-+4H+Li++Co2++4OH
D.若甲室Co2+减少200 mg,乙室Co2+增加300 mg,则此时已进行过溶液转移
14.工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1 mol·L-1、1.0 mol·L-1Na2CO3溶液,含SrSO4(s)的0.1 mol·L-1、1.0 mol·L-1
Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/mol·L-1]随pH的变化关系如图3所示。下列说法错误的是( )。

图3
A.反应SrSO4(s)+SrCO3(s)+的平衡常数
B.a=-6.5
C.曲线④代表含SrCO3(s)的1.0 mol·L-1溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
15.Cu2-xSe是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图4所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是( )。

图4
A.每个Cu2-xSe晶胞中Cu2+个数为x
B.每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为8
C.每个NaCuSe晶胞中0价Cu原子个数为1-x
D.当NayCu2-xSe转化为NaCuSe时,每转移(1-y) mol电子,产生(1-x) mol Cu原子
三、非选择题:本题共5小题,共60分。
16.(12分)研究笼形包合物结构和性质具有重要意义。化学式为Ni(CN)x·Zn(NH3)y·zC6H6的笼形包合物四方晶胞结构如图5所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为a=b≠c,α=β=γ=90°。回答下列问题:

图5
(1)基态Ni原子的价电子排布式为_____,在元素周期表中位置为_____。
(2)晶胞中N原子均参与形成配位键,Ni2+与Zn2+的配位数之比为____;x∶y∶z=_____;晶胞中有d轨道参与杂化的金属离子是____。
A.2s轨道 B.2p轨道
C.sp杂化轨道 D.sp2杂化轨道
(4)在水中的溶解度,吡啶远大于苯,主要原因是①____,②____。
17.(13分)工业上以氟磷灰石[Ca5F(PO4)3,含SiO2等杂质]为原料生产磷酸和石膏,工艺流程如下。

回答下列问题:
(1)酸解时有HF产生。氢氟酸与SiO2反应生成二元强酸H2SiF6,离子方程式为_____。
(2)部分盐的溶度积常数见表2。精制Ⅰ中,按物质的量之比n(Na2CO3)∶n)=1∶1加入Na2CO3脱氟,充分反应后,c(Na+)=_____mol·L-1;再分批加入一定量的BaCO3,首先转化为沉淀的离子是_____。

表2

图6

图7
A.65℃、P2O5%=15、SO3%=15
B.80℃、P2O5%=10、SO3%=20
C.65℃、P2O5%=10、SO3%=30
D.80℃、P2O5%=10、SO3%=10
18.(12分)实验室利用FeCl2·4H2O和亚硫酰氯(SOCl2)制备无水FeCl2的装置如下页图8所示(加热及夹持装置略)。已知SOCl2沸点为76 ℃,遇水极易反应生成两种酸性气体。回答下列问题:

图8
(1)实验开始先通N2。一段时间后,先加热装置____(填“a”或“b”)。装置b内发生反应的化学方程式为_____。装置c、d共同起到的作用是____。
(2)现有含少量杂质的FeCl2·nH2O,为测定n值进行如下实验:
实验Ⅰ:称取m1g样品,用足量稀硫酸溶解后,用c mol·L-1K2Cr2O7标准溶液滴定Fe2+达终点时消耗V mL(滴定过程中Cr2转化为Cr3+,Cl-不反应)。
实验Ⅱ:另取m1g样品,利用上述装置与足量SOCl2反应后,固体质量为m2g。
则n=_____;下列情况会导致n测量值偏小的是____(填标号)。
A.样品中含少量FeO杂质
B.样品与SOCl2反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
(3)用上述装置、根据反应TiO2+CCl4TiCl4+CO2制备TiCl4。已知TiCl4与CCl4分子结构相似,与CCl4互溶,但极易水解。选择合适仪器(如图9)并组装蒸馏装置对TiCl4、CCl4混合物进行蒸榴提纯(加热及夹持装置略),安装顺序为①⑨⑧_____(填序号),先馏出的物质为 。

图9
19.(12分)支气管扩张药物特布他林(H)的一种合成路线如下:

已知:


回答下列问题:
(1)A→B反应条件为____;B中含氧官能团有____种。
(2)B→C反应类型为____,该反应的目的是_____。
(3)D结构简式为____;E→F的化学方程式为____。
(4)H的同分异构体中,仅含有—OCH2CH3、—NH2和苯环结构的有____种。
(5)根据上述信息,写出以4-羟基邻苯二甲酸二乙酯为主要原料制备合成的路线:___。
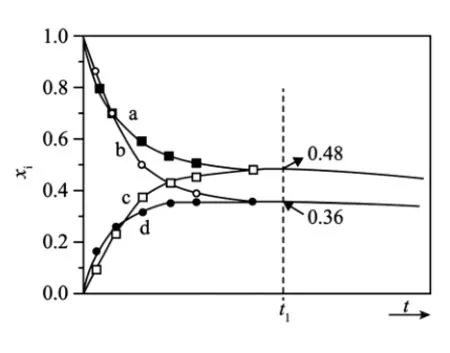
20.(11分)利用γ-丁内酯(BL)制备1,4-丁二醇(BD),反应过程中伴有生成四氢呋喃(THF)和1-丁醇(BuOH)的副反应,涉及反应如下:

已知:①反应Ⅰ为快速平衡,可认为不受慢反应Ⅱ、Ⅲ的影响;②因反应Ⅰ在高压H2氛围下进行,故H2压强近似等于总压。回答下列问题:
(1)以5.0×10-3mol BL或BD为初始原料,在493 K、3.0×103kPa的高压H2氛围下,分别在恒压容器中进行反应。达平衡时,以BL为原料,体系向环境放热X kJ;以BD为原料,体系从环境吸热Y kJ。忽略副反应热效应,反应Ⅰ焓变ΔH(493 K,3.0×103kPa)=_____kJ·mol-1。
(2)初始条件同上。xi表示某物种i的物质的量与除H2外其他各物种总物质的量之比,xBL和xBD随时间t变化关系如图10所示。实验测得X 图10 (3)(xBD/xBL)max为达平衡时xBD与xBL的比值。(493 K,2.5×103kPa)、(493 K,3.5×103kPa)、(513 K,2.5×103kPa)三种条件下,以5.0×10-3mol BL为初始原料,在相同体积的刚性容器中发生反应,随时间t变化关系如图11所示。因反应在高压H2氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中,(xBD/xBL)max最大的是____(填代号);与曲线b相比,曲线c达到=1.0所需时间更长,原因是_____。 图11 【参考答案及评分标准】 1.C 提示:金(Au)“虽被火亦未熟”,是指金单质在空气中被火灼烧也不反应,即“真金不怕火炼”,说明金的化学性质很稳定,与其氧化性无关,A项错误。石灰(CaO)“以水沃之,即热蒸而解”,是指CaO+H2OCa(OH)2,反应放热产生大量的水蒸气,CaO由块状变为粉末状,未发生氧化还原反应,与其氧化性无关,B项错误。石硫黄(S)“能化……银、铜、铁,奇物”,是指2Ag+SAg2S,Fe+SFeS,2Cu+SCu2S,反应中S作氧化剂,与其氧化性有关,C项正确。石钟乳(CaCO3)“色黄,以苦酒(醋)洗刷则白”,是 指CaCO3+2CH3COOH(CH3COO)2Ca+H2O+CO2↑,未发生氧化还原反应,与其氧化性无关,D项错误。 3.B 提示:根据核反应前后质子数之和相等、质量数之和相等计算:a=6,b=2,m=4,n=2,即X微粒为e,Y微粒为根据质量数等于质子数加中子数可知,X微粒(He)的中子数为4,A项错误。X微粒为He,Y微粒为He,二者质子数相同,中子数不同,故互为同位素,B项正确。由题干信息“与的半衰期很短”,不宜用作示踪原子研究化学反应历程,C项错误。自然界中不存在与是因为与的半衰期很短,很容易发生核变化,转化为其他原子,D项错误。 5.A 提示:AlN、GaN为与金刚石结构相似的共价晶体,Al和Ga均为第ⅢA元素,Al原子的半径小于Ga,N—Al的键长小于N—Ga的键长,则N—Al的键能较大,键能越大则其对应的共价晶体的熔点越高,故GaN的熔点低于AlN,A项错误。不同种元素的原子之间形成的共价键为极性键,故AlN、CaN两种晶体中所有化学键均为极性键,B项正确。AlN、GaN晶体中,N原子与其相邻的4个Al原子或4个Ga原子形成3个普通共价键和1个配位键,则其晶体中所有原子均采取sp3杂化,C项正确。AlN、GaN晶体中,N原子与其相邻的4个Al原子或4个Ga原子形成4个σ键,Al原子或Ga原子与其相邻的4个N原子形成4个σ键,则其晶体中所有原子的配位数均为4,D项正确。 6.A 提示:量筒准确度较低,无法量取25.00 mL溶液,应该用碱式滴定管或移液管量取25.00 mL Na2CO3标准溶液置于锥形瓶中,A项错误。Na2CO3水解有NaOH生成,溶液显碱性,盛放Na2CO3溶液的玻璃容器不能用玻璃塞,以防NaOH腐蚀玻璃,产生有黏性的硅酸钠溶液,将瓶塞粘住,故应选用配带塑料塞的容量瓶配制Na2CO3标准溶液,B项正确。 Na2CO3有吸水性且有一定的腐蚀性,故应选用烧杯而非称量纸称量Na2CO3固体,C项正确。Na2CO3溶液显碱性,甲基橙滴入Na2CO3溶液中显黄色,当滴入最后半滴盐酸时,溶液由黄色突变为橙色且半分钟之内不变色即为滴定终点,故达到滴定终点时溶液显橙色,D项正确。 【易错提醒】甲基橙为指示剂,以盐酸滴定Na2CO3标准溶液,滴定终点时溶液中的溶质是NaCl和过量的H2CO3(或溶解的CO2),终点时溶液的pH约为4,所以终点时的现象是溶液由黄色变为橙色。 7.B 提示:根据题中信息可知,γ-崖柏素有酚的通性,具有类似的酚羟基的性质。酚可与溴水发生取代反应,γ-崖柏素有酚的通性,且γ-崖柏素的环上有可以被取代的H,故γ-崖柏素可与溴水发生取代反应,A项正确。酚类物质不与NaHCO3溶液反应,γ-崖柏素分子中没有可与NaHCO3溶液反应的官能团,故其不可与NaHCO3溶液反应,B项错误。γ-崖柏素分子中有一个异丙基,异丙基中的次甲基的碳原子是sp3杂化,该碳原子与其相连的3个碳原子不共面,C项正确。γ-崖柏素与足量H2加成后转化为,产物分子中含手性碳原子(与羟基相连的C原子是手性碳原子),D项正确。 8.D 提示:根据题意,高温下在熔融强碱性介质中用KClO3氧化MnO2制备K2MnO4,再水溶后冷却调溶液pH至弱碱性,使K2MnO4歧化生成KMnO4和MnO2,Mn元素的化合价由+6变为+7和+4。①中高温下熔融强碱性介质会腐蚀瓷坩埚,故不能用瓷坩埚作反应器,A项不正确。制备KMnO4时为防止引入杂质离子,①中用KOH作强碱性介质,不能用NaOH,B项不正确。②中K2MnO4歧化生成KMnO4和MnO2,故其既体现氧化性又体现还原性,C项不正确。根据化合价的变化分析,K2MnO4歧化生成KMnO4和MnO2的物质的量之比为2∶1,由Mn元素守恒知,MnO2中的Mn元素只有转化为KMnO4,因此,MnO2转化为KMnO4的理论转化率约为66.7%,D项正确。 【刨根问底】①的化学方程式为KClO3+3MnO2+6KOH3K2MnO4+KCl+3H2O;②中通常是通入CO2调溶液pH至弱碱性,化学方程式为3K2MnO4+2CO22KMnO4+MnO2↓+2K2CO3,若CO2过量,体系呈中性或弱酸性,化学方程式为3K2MnO4+4CO2+2H2O2KMnO4+MnO2↓+4KHCO3。 9.C 提示:根据题给流程可知,向甲苯、苯胺、苯甲酸的混合溶液中加入盐酸,盐酸将微溶于水的苯胺转化为易溶于水的苯胺盐酸盐,分液得到水相Ⅰ和有机相Ⅰ;向水相中加入氢氧化钠溶液将苯胺盐酸盐转化为苯胺,分液得到苯胺粗品①;向有机相中加入水洗涤除去混有的盐酸,分液得到废液和有机相Ⅱ,向有机相Ⅱ中加入碳酸钠溶液将微溶于水的苯甲酸转化为易溶于水的苯甲酸钠,分液得到甲苯粗品②和水相Ⅱ;向水相Ⅱ中加入盐酸,将苯甲酸钠转化为苯甲酸,经结晶或重结晶、过滤、洗涤得到苯甲酸粗品③。 氨基的孤电子对能以配位键结合H+而显碱性,故苯胺能与盐酸反应但不能与氢氧化钠溶液反应,苯胺与盐酸反应生成盐酸苯胺:C6H5NH2+HCl--→C6H5Cl-, A项错误。水相Ⅰ中的盐酸苯胺与NaOH反应生成液态的苯胺:C6H5Cl-+NaOHC6H5NH2+NaCl+H2O,得到苯胺粗品①的分离方法为分液,水相Ⅱ中苯甲酸钠与盐酸反应生成微溶于水的苯甲酸固体:C6H5COONa+HCl--→C6H5COOH↓+NaCl,得到苯甲酸粗品③的分离方法为过滤、洗涤,获取两者的操作方法不同,B项错误。苯胺粗品、甲苯粗品、苯甲酸粗品依次由①②③获得,C项正确。①是液态苯胺与氯化钠水溶液的两相混合体系,②为液态甲苯的有机相,不是两相混合体系,③为苯甲酸的悬浊液与氯化钠溶液的两相混合体系,D项错误。 10.D 提示:根据反应机理图知,含N分子发生的反应有NO+·OOHNO2+·OH,NO+NO2+H2O2HONO,NO2+·C3H7C3H6+HONO,HONONO+·OH,含N分子NO、NO2、HONO(亚硝酸)中N元素的化合价依次为+2价、+4价、+3价,上述反应中均有元素化合价的升降,都为氧化还原反应,一定有电子转移,A项正确。读反应机理图知,由NO生成HONO的反应历程有①和②2种,B项正确。NO是催化剂,增大NO的量可以加快反应速率,但不能使平衡发生移动,故C3H8的平衡转化率不变,C项正确。无论反应历程如何,在NO催化下丙烷与O2反应制备丙烯的总反应都为2C3H8+O22C3H6+2H2O,最终生成的水不变,D项错误。 11.A 提示:饱和Na2CO3溶液通入CO2气体依次发生反应CO2+Na2CO3+H2O2NaHCO3↓,CaCO3+H2O+CO2Ca(HCO3)2,相同温度下NaHCO3的溶解度小于Na2CO3,最终瓶中仍有NaHCO3白色晶体析出,不会得到澄清溶液,A项不符合要求。FeCl2溶液通入Cl2,发生反应Cl2+2FeCl22FeCl3,2FeCl3+Fe3FeCl2,最终Fe消失,得到澄清溶液,B项符合要求。Cu (NO3)2溶液通入HCl,在酸性条件下会表现强氧化性,发生离子反应3Cu+8H++23Cu2++2NO↑+4H2O,最终Cu完全溶解得到澄清溶液,C项符合要求。AgCl在水中存在溶解平衡AgCl(s)Ag+(aq)+Cl-(aq),通入NH3后,Ag+与NH3结合成[Ag(NH3)2]+,使AgCl的溶解平衡正向移动,最终AgCl完全溶解得到澄清溶液,D项符合要求。 【易错提醒】由于常温时碳酸氢钠的溶解度小于碳酸钠、氢氧化钠、氯化钠,且三者完全转化为碳酸氢钠时溶质的质量增加,所以,分别向饱和碳酸钠溶液、饱和烧碱溶液、氨化饱和食盐水中通入过量CO2均有碳酸氢钠晶体析出。 12.D 提示:工艺流程分析如下: CuS精矿(含有杂质Zn、Fe元素)在高压O2作用下,用硫酸溶液浸取,CuS反应产生为CuSO4、S、H2O,Fe2+被氧化为Fe3+,然后加入NH3调节溶液pH,使Fe3+形成Fe(OH)3沉淀,而Cu2+、Zn2+仍以离子形式存在于溶液中,过滤得到的滤渣固体X中含有S、Fe(OH)3;滤液中含有Cu2+、Zn2+;然后向滤液中通入高压H2,根据元素活动性:Zn>H>Cu,Cu2+被还原为Cu单质,通过过滤分离出来;而Zn2+仍然以离子形式存在于溶液中,再经一系列处理可得到Zn单质。 由上述分析知,固体X主要成分是S、Fe(OH)3,金属M为Zn,A项正确。CuS难溶于硫酸,在溶液中存在沉淀溶解平衡CuS(s)Cu2+(aq)+S2-(aq),增大O2压强实质是增大O2的浓度,可以氧化S2-使之转化为S,从而使沉淀溶解平衡正向移动,促进金属离子的浸取,B项正确。根据流程图可知,用NH3调节溶液pH时,要使Fe3+转化为沉淀,而Cu2+、Zn2+仍以离子形式存在于溶液中,结合表1中离子沉淀的pH,可知中和时应该调节溶液pH范围为3.2~4.2,C项正确。在用H2还原Cu2+变为Cu单质时,H2失去电子被氧化为H+,若还原时增大溶液的酸度,c(H+)增大,抑制H2失去电子还原Cu单质,因此不利于Cu的生成,D项错误。 13.BD 提示:电化学原理图分析如下:(1)池的判断。依据题干中“右侧装置为原电池”和“设计如图装置回收金属钴”可判断左侧装置为电解池。(2)电极名称的判断和电极反应的书写。由题干中“降解乙酸盐生成CO2”知,乙酸根失去电子发生氧化反应,故左侧电解池的左边电极为阳极,右侧原电池左边电极为负极,这两个电极的反应均为CH3COO--8e-+2H2O2CO2↑+7H+,结合“回收金属钴”和“LiCoO2转化为Co2+”知,左侧电解池右边阴极反应式为Co2++2e-Co,右侧原电池右边正极(乙室)反应式为LiCoO2+e-+4H+Li++Co2++2H2O。 根据题干中“保持细菌所在环境pH稳定”知,装置工作时,左侧电解池左边阳极产生的H+通过阳膜进入到阴极甲室溶液中,c(H+)逐渐增大,pH逐渐减小,A项错误。装置工作时为“保持细菌所在环境pH稳定”,右侧的负极室产生的H+穿过阳膜进入到乙室(正极),由正极反应(LiCoO2+e-+4H+Li++Co2++2H2O)知,正极消耗的H+大于通过阳膜移入的H+,故装置工作一段时间后,乙室应补充盐酸,B项正确。电解质溶液为酸性,乙室电极反应不可能生成OH-而是生成H2O: LiCoO2+e-+4H+Li++Co2++2H2O,C项错误。若甲室Co2+减少200 mg,电子转移物质的量为n(e-)=×2=0.006 8 mol,乙室Co2+增加300 mg,转移电子的物质的量为n(e-)=×1=0.005 1 mol,转移电子的物质的量不相等,说明此时已进行过溶液转移,D项正确。 【解法提醒】“三标明”:在电化学装置中标明电极名称,外电路上标明电子移动方向,电解质溶液中标明阴离子和阳离子移动的方向,有利于准确快速解题。 14.D 提示:图像中隐藏的化学信息分析如下:硫酸是强酸,pH变化溶液中c)几乎不变,则含SrSO4(s)的Na2SO4溶液中c(Sr2+)几乎不变,pH相同时,溶液中c()越大,c(Sr2+)越小,所以曲线①代表含SrSO4(s)的0.1 mol·L-1Na2SO4溶液的变化曲线,曲线②代表含SrSO4(s)的1 mol·L-1Na2SO4溶液的变化曲线;碳酸是弱酸,溶液pH减小,溶液中c)越小,c(Sr2+)越大,pH相同时,1 mol·L-1Na2CO3溶液中c()大于0.1 mol·L-1Na2CO3溶液,则曲线③表示含SrCO3(s)的0.1 mol·L-1Na2CO3溶液的变化曲线,曲线④表示含SrCO3(s)的1 mol·L-1Na2CO3溶液的变化曲线。 反应SrSO4(s)+(aqSrCO3(s)+(aq)的平衡常数A项正确。曲线①代表含SrSO4(s)的0.1 mol·L-1Na2SO4溶液的变化曲线,则SrSO4的溶度积Ksp(SrSO4)=10-5.5×0.1=10-6.5,温度不变,溶度积不变,溶液pH为7.7时,c(Sr2+)=10-6.5,则a为-6.5, B项正确。曲线④表示含SrCO3(s)的1 mol·L-1Na2CO3溶液的变化曲线,C项正确。硫酸是强酸,pH变化溶液中c()几乎不变,则含SrSO4(s)的Na2SO4溶液中c(Sr2+)几乎不变,所以SrSO4的生成与溶液pH无关, D项错误。 15.BD 提示:由Cu2-xSe晶胞结构知,位于顶点和面心的Se2-个数为位于体内的铜离子和亚铜离子的个数之和为8,设晶胞中的Cu2+和Cu+的个数分别为a和b,则a+b=8-4x,根据化合价代数和为0有2a+b=4×2,解得a=4x,A项错误。Na2Se转化为Cu2-xSe的电极反应式为Na2Se-2e-+(2-x)CuCu2-xSe+2Na+,由Na2Se晶胞结构知,位于顶点和面心的Se2-个数为=4,则每个晶胞中含有4个Na2Se,转移电子数为8,B项正确。由NaCuSe晶胞结构知,位于顶点和面心的硒离子个数为则每个晶胞中含有4个NaCuSe,晶胞中0价铜原子个数为(4-4x),C项错误。NayCu2-xSe转化为NaCuSe的电极反应式为NayCu2-xSe+(1-y) e-+(1-y) Na+NaCuSe+(1-x)Cu,所以每转移(1-y)mol电子,产生(1-x) mol Cu原子,D项正确。 16.(1)3d84s2(1分) 第4周期第Ⅷ族(1分) 参考评分细则:Ⅷ不能写成V I I I,单写周期或族不给分,写ⅧB不给分。 参考评分细则:第3空答对一种给1分,汉字写镍离子、锌离子正确;汉字本身写错不给分,写原子不给分。上标的大小不做要求,但必须是对的,如+2或仅2按错处理。 (3)D(1分) (4)吡啶与水分子间形成氢键(1分)吡啶是极性分子,比非极性分子苯更易溶于水(1分) 参考评分细则:写相似相溶或极性分子易溶于水(极性溶剂)也可以;两个答案不分先后。 解析:(1)Ni是28号元素,基态Ni原子的价电子排布式为3d84s2,在周期表中第四横行第10纵列即位于第4周期第Ⅷ族。 观察晶胞示意图,利用均摊法计算如下:一个晶胞中含有Ni2+个数为=1,Zn2+个数为8×=1,含有CN-个数为8×=4,NH3个数为8×=2,苯环个数为4×=2,该晶胞的化学式为Ni(CN)4·Zn(NH3)2·2C6H6,x∶y∶z=4∶2∶2=2∶1∶1;Ni2+的配位数为4且为平面正方形,Ni2+采用dsp2杂化(若Ni2+采用sp3杂化应为四面体,不可能为平面四边形),Zn2+的配位数为6且为正八面体,Zn2+采用sp3d2杂化,即晶胞中有d轨道参与杂化的金属离子是Ni2+和Zn2+。 (4)苯分子为非极性分子,吡啶分子是极性分子,H2O分子为极性分子,且吡啶中N原子上的孤电子对能与H2O分子形成分子间氢键,从而导致吡啶在水中的溶解度远大于苯。 (5)—CH3为推电子基团,—Cl是吸电子基团,N原子电子云密度大小顺序为结合题干信息“碱性随N原子电子云密度的增大而增强”推断,碱性最弱的为。 17.(1)SiO2+6HF2H+++2H2O(2分) 参考评分细则:等号写成箭头、单线不扣分,写错不给分,非离子方程式不给分,未配平不给分。 (2)2.0×10-2(2分)(2分) 参考评分细则:第1空以下均可:0.020、0.02、2×10-2。第2空写成硫酸根(离子)或者硫酸根、钡离子也给分。 (3)CaSO4·0.5H2O(2分) 抑制CaSO4溶解(2分) 酸解(1分) AD(2分) 参考评分细则:第1空正确答案唯一。 第2空,答出抑制和溶解两个关键点即可得2分;抑制的同义词均可,如降低、减少、阻碍等;CaSO4写为石膏、沉淀、溶质、晶体、产品也可;对在水中和硫酸中的溶解度做了比较也可,如在硫酸中溶解度更小等;用同离子效应作解释逻辑通顺可给分;防止硫酸钙溶于水可给分;硫酸钙微溶于水(单写不给分)后加解释,比如会溶解或者减少产品,造成产品的损失,可给分;降低硫酸钙或者固体溶解度可给分;防止固体溶解造成的产品损耗可给分;单独写防止产品损耗不给分;逻辑不通不给分,有错误信息不给分;减少产物损失不给分。 第3空写成酸解单元或酸解操作均可给分。 第4空,漏选给1分,错选不给分。 解析:考查考生理解工艺流程中的陌生化学反应,“酸解”和“精制Ⅰ中加入Na2CO3脱氟”都运用了强酸生成弱酸的原理。“酸解”的主要反应是Ca5F(PO4)3+5H2SO45CaSO4+3H3PO4+HF↑、SiO2+6HFH2SiF6+2H2O;精制Ⅰ中加入Na2CO3脱氟反应方程式为H2SiF6+Na2CO3Na2SiF6↓+CO2↑+H2O。 (1)氢氟酸(弱酸)与SiO2反应生成二元强酸H2SiF6(氟硅酸),根据质量守恒和离子方程式的书写规则推知还有水生成,且强酸氟硅酸拆成H+和,该反应的离子方程式为SiO2+6HF2H+++2H2O。 (2)精制Ⅰ中,按物质的量之比n(Na2CO3)∶n()=1∶1加入Na2CO3脱氟,依据强酸制弱酸的反应写出该反应的化学方程式为H2SiF6+Na2CO3Na2SiF6↓+CO2↑+H2O,充分反应后得到沉淀Na2SiF6和饱和的Na2SiF6溶液,且c(Na+)=2c),由Na2SiF6的溶度积计算:Ksp= c2(Na+)· c()=4c3(),c() ==1.0×10-2mol·L-1,c(Na+)=2c()=2.0×10-2mol·L-1。粗磷酸中还有硫酸、氟硅酸、硫酸钙等,根据Ksp(BaSiF6)=1.0×10-6>Ksp(BaSO4)=1.0×10-10,可以快速判断出首先转化为沉淀的离子是。 (3)由坐标图的信息知:酸解后,在所得100 ℃、P2O5%为45的混合体系中,石膏存在形式为CaSO4·0.5H2O;根据同离子效应,硫酸电离出的硫酸根离子可以抑制CaSO4的溶解;洗涤液X中含有硫酸,酸解时使用的也是硫酸,故回收利用洗涤液X的操作单元是酸解。“结晶转化”是指生成CaSO4·2H2O(石膏);65 ℃、P2O5%=15,SO3%=15,晶体以CaSO4·2H2O形式存在,能实现酸解所得石膏结晶转化,A项正确。80 ℃、P2O5%=10,SO3%=20,晶体以CaSO4·0.5H2O形式存在,不能实现酸解所得石膏结晶转化, B项错误。65 ℃、P2O5%=10,SO3%= 30,晶体以CaSO4·0.5H2O形式存在,不能实现酸解所得石膏结晶转化,C项错误。80 ℃、P2O5%=10、SO3%=10,晶体以CaSO4·2H2O形式存在,能实现酸解所得石膏结晶转化,D项正确。 18.(1) a(1分) FeCl2·4H2O+4SOCl2FeCl2+4SO2+8HCl(2分) 冷凝并回收利用SOCl2(冷凝回流)(2分) 参考评分细则:化学方程式的书写只看物质和系数,可逆号,单箭头,不带加热符号也不扣分,系数加倍也对,注意配平。第3空答提高利用率给分,答冷凝回流气体不给分,要体现①冷凝回流,②原料利用,③SOCl2。 参考评分细则:(也对)没有进一步化简的也对。第2空错选不得分,单选A或B得1分。 (3)⑥⑩③⑤(2分) CCl4(1分) 参考评分细则:第1空顺序必须对。第2空写名称“四氯化碳”也给分。 解析:SOCl2与H2O反应生成两种酸性气体,FeCl2·4H2O与SOCl2制备无水FeCl2的反应原理为SOCl2与FeCl2·4H2O受热失去的结晶水反应生成SO2和HCl,HCl可抑制FeCl2的水解,从而制得无水FeCl2。 (1)先加热装置a,使SOCl2在76 ℃沸腾转化为气体充满装置,然后再加热装置b;b内SOCl2与FeCl2·4H2O受热失去的结晶水反应生成SO2和HCl,HCl可抑制FeCl2的水解,从而制得无水FeCl2:FeCl2·4H2O+4SOCl2FeCl2+4SO2+8HCl。装置c、d的共同作用是冷凝并回收利用SOCl2。 (2)滴定过程中Cr2将Fe2+氧化成Fe3+,自身被还原成Cr3+,反应的离子方程式为6Fe2++ Cr2+14H+6Fe3++2Cr3++7H2O,则m1g样品中n(FeCl2)=6n(Cr2)=6cV×10-3mol;m1g样品中结晶水的质量为(m1-m2)g,结晶水物质的量为mol,n(FeCl2)∶n(H2O)=1∶n=(6cV×10-3mol):mol,解得n=。样品中含少量FeO杂质,溶于稀硫酸后生成Fe2+,导致消耗的K2Cr2O7溶液的体积V偏大,使n的测量值偏小,A项正确;样品与SOCl2反应时失水不充分,则m2偏大,使n的测量值偏小,B项正确;实验Ⅰ称重后,样品发生了潮解,样品的质量不变,消耗的K2Cr2O7溶液的体积V不变,使n的测量值不变,C项不符合题意;滴定达到终点时发现滴定管尖嘴内有气泡生成,导致消耗的K2Cr2O7溶液的体积V偏小,使n的测量值偏大,D项不符合题意。 (3)组装蒸馏装置对TiCl4、CCl4混合物进行蒸馏提纯,按由下而上、从左到右的顺序组装,安装顺序为①⑨⑧,然后连接冷凝管,蒸馏装置中应选择直形冷凝管⑥,不选用球形冷凝管⑦,接着连接尾接管⑩,TiCl4极易水解,为防止外界水蒸气进入,③后连接⑤,安装顺序为①⑨⑧⑥⑩③⑤;由于TiCl4、CCl4分子结构相似,TiCl4的相对分子质量大于CCl4,TiCl4分子间的范德华力较大,TiCl4的沸点高于CCl4,先馏出的物质为CCl4。 19. (1) 浓硫酸,加热(1分) 2(1分) 参考评分细则:浓H2SO4/硫酸/ H2SO4均可;稀硫酸不给分;加热可以写加热符号。 (2)取代反应(1分) 保护酚羟基(1分) 参考评分细则:答案超过一个0分,只写取代,给分 。保护羟基/防止反应物被氧化/防止羟基被氧化,均给分;保护反应物不给分 (3)CH3COOC2H5(2分) 参考评分细则:出现CH3COOCH3或CH3COOC3H7或CH3COOPh等其他酯均对。 反应物、产物只写分子式不得分;反应条件写可逆号得分、写等号不得分;CH3COOH写在反应物中0分;CH3COOH写成 HAc得分。 (4)6(1分) 参考评分细则:共3步,每步1分;中间产物写错0分;条件错、产物正确0分;后两步并一步均0分。 20.(1)-200(X+Y)(2分) (2)ac(2分) 8.3×10-8(2分) 0.08(1分) 39%(1分) 参考评分细则:只写a或者c得1分,写错不给分。 8.3×10-8写成分数不给分。 (3)c(2分) c与b温度一致,但c氢气压强更大,BL平衡转化率较大,需时更长。(1分) 参考评分细则:只看BL平衡转化率较大这一部分,可以替换为平衡正向移动,反应正向进行,反应的限度更大,转化得更多等,不影响得分。 解析:(1)根据题意,在同温同压下,以等物质的量的BL或BD为初始原料,达到平衡时的状态为等效平衡状态。则以5.0×10-3mol BL为起始原料达到平衡时放出X kJ热量,与以5.0×10-3mol BD为起始原料达到平衡时吸收Y kJ热量,二者能量差值为(X+Y) kJ,则1 mol时二者能量差值为200(X+Y) kJ,反应Ⅰ为放热反应,因此焓变ΔH =-200(X+Y) kJ·mol-1。 (2)BL为初始原料的可逆反应为BL(g)+2H2(g)BD(g) ΔH<0,BD为初始原料的可逆反应为BD(g)BL(g)+2H2(g) ΔH>0,实验测定X 以BL为原料时,根据题给反应Ⅰ、Ⅱ、Ⅲ可知,体系总物质的量的增加量=BD参与反应Ⅱ、Ⅲ的量=生成H2O(g)的物质的量,设t1时BL转化了a mol,BD转化了b mol,则体系总物质的量为(5.0×10-3+b) mol,得到=0.36,求得×10-3,则t1时刻=0.08;此时BD的产率为×100%≈39%。 (3)依题意,反应Ⅰ是正向放热过程,以BL为初始原料,温度升高则平衡逆向移动,温度越高,反应速率越快,达到平衡时的时间越短,(xBD/xBL)max越小,的值越大;相同温度时,压强增大,BD的比重增大,(xBD/xBL)max增大,又可忽略压强对反应速率的影响,则(xBD/xBL)max最大即最小,对应曲线c。 c与b温度一致,但c氢气压强更大,题干中“可忽略压强对反应速率的影响”,压强大反应Ⅰ的平衡向气体分子数减少的正向移动,BL平衡转化率更大,故达到平衡需时更长。