原子结构和元素周期律相关试题类型总结
2022-03-15河南省郑州市第一中学刘善超王逢云
■河南省郑州市第一中学 刘善超 王逢云
原子结构、元素周期律等知识是高考考查的热点,主要以选择题的形式呈现。笔者对近几年高考中的相关试题进行了归纳和整合,以便给同学们提供一个做题的方法和思路,希望能对广大考生的复习备考有所帮助。
第一类:常规型
例1原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )。
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
答案:B
点拨:本题属于这部分内容的常规题型,其中元素的推断是基础,可以说推出元素才是做出此类试题的第一环节,推出元素后还要根据选项逐一分析,各个击破。本题难度适中,但是在审题的过程中,同学们要注意到“b和c的次外层有8个电子”,说明b和c为第3周期的元素。
第二类:有机型
例2短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol ·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图1所示。下列说法正确的是( )。
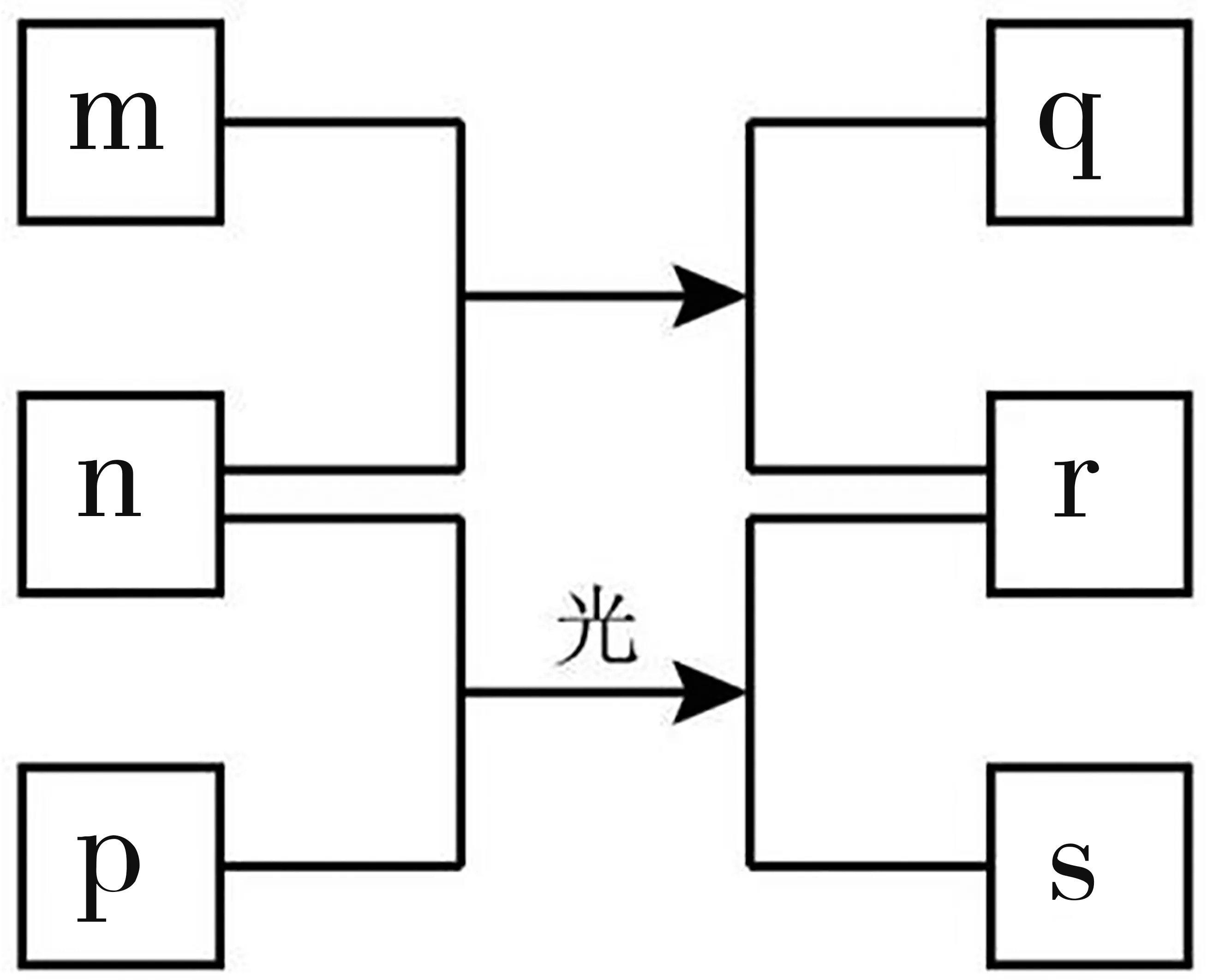
图1
A.原子半径的大小W B.元素的非金属性Z>X>Y C.Y的氢化物常温常压下为液态 D.X的最高价氧化物的水化物为强酸 解析:短周期元素W、X、Y、Z的原子序数依次增加,经推导,元素分别为H、C、O、Cl。这里需要注意的是,物质p为烃,不一定为CH4。在W、X、Y中,X原子的半径最大,选项A错误。在X、Y、Z中,Y的非金属性最强,选项B错误。Y为氧元素,Y的氢化物为H2O或H2O2,常温常压下为液态,选项C正确。X为C元素,其最高价氧化物对应的水化物碳酸为弱酸,选项D错误。 答案:C 点拨:本题是把有机化学内容渗透到元素周期律里面的试题,出题的方向值得同学们关注。 理解原子结构中质子数和质量数的含义,掌握核反应方程式的意义及反应过程中各种微粒的数量关系,准确推断出元素。在核反应方程式中,要保证方程式前元素的质量数之和等于方程式后的质量数之和,方程式前元素的质子数之和等于方程式后的质子数之和。 例3自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加深,元素周期表中的成员数目不断增加。 回答问题:2016年IUPAC确认了四种新元素,其中一种为Mc,中文名为“镆”。元素Mc可由反应Am+--→288Mc+得到。该元素的质子数为____,287Mc与288Mc互为____。 答案:115 同位素 点拨:2019年开始考查到了核化学反应的内容,难度不是很大,做题时认真细心即可得分。 例41934年约里奥-居里夫妇在核反应中用α粒子(即氦He)轰击金属原,得到核素Y,开创了人造放射性核素的先河:其中元素X、Y的最外层电子数之和为8。下列叙述正确的是( )。 B.X、Y均可形成三氯化物 C.X的原子半径小于Y的 D.Y仅有一种含氧酸 解析:根据题目分析,元素X的质量数W为27,关于这一点,若是考生能记住Al的原子量为27,问题就迎刃而解;若是考生没有记住Al的原子量,还有一种方法可以预判,一般情况下,大部分短周期元素原子的质量数约为其原子序数的2倍,因此可以13.5,推知元素X为13号元素或14号元素,而通过题中信息“其中元素X、Y的最外层电子数之和为8”,可以推出元素X就是Al的相对原子质量为27,故A项错误。X(Al)、Y(P)均可形成三氯化物,分别为AlCl3、PCl3,故B项正确。根据同一周期元素从左到右原子半径依次减小推知,X(Al)的原子半径大于Y(P)的,故C项错误。Y(P)有多种含氧酸,如H3PO2、H3PO3和H3PO4等,故D项错误。 答案:B A.H3XO3可用于中和溅在皮肤上的NaOH溶液 B.Y单质在空气中燃烧的产物是Y2O2 C.X和氢元素形成离子化合物 D.6Y和7Y互为同素异形体 解析:根据核反应可知,X的质量数N为4+7-1=10,又根据大部分元素原子的质量数是其原子序数的2倍,可以推知X可能为5号元素B;若X为B元素,则Y为元素Li,又知元素Y在化合物中呈+1价,进一步证实Y就是元素Li,其质子数p=3。H3BO3为弱酸,氢氧化钠溶液具有腐蚀性,若不慎将NaOH溶液溅到皮肤上,则需先用大量水冲洗,同时涂抹H3BO3中和碱液,故选项A正确。Y为元素Li,在空气中燃烧的产物只有Li2O,故B选项错误。X为元素B,与氢元素可以形成B2H6,B元素与H元素之间以共价键相结合,属于共价化合物,故选项C错误。6Li和7Li两者的质子数均为3,中子数不同,所以两者互为同位素,故选项D错误。 答案:A 例6科学家合成出了一种新化合物(如图2所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,下列叙述正确的是( )。 图2 A.WZ的水溶液呈碱性 B.元素非金属性的顺序为X>Y>Z C.Y的最高价氧化物的水化物是中强酸 D.该新化合物中Y不满足8电子稳定结构 解析:W、X、Y、Z为同一短周期元素,根据图示分析,W为第ⅠA族元素,失去一个电子显示+1价,因此W可能为H、Li或Na,需要注意的是,离子化合物才能形成图示的结构,因此W元素排除了是H元素的可能性。在阴离子结构中,有6个Z,并且Z原子只形成一个共价键,因此元素Z可能为H、F、Cl元素,其中W、X、Y、Z为同一短周期元素,因此也排除了Z是H元素的可能性。在阴离子结构中,有2个X,并且每个X原子只形成四个共价键,因此X为第ⅣA族元素,可能为C或Si元素。本题最容易推错的是Y元素,因为Y元素原子连2个共价键,很多同学会误认为Y元素为第ⅥA族元素,可能为O或S,其实不然,W 元素在失去一个电子后形成的为W+,这个电子只能被Y元素得到,这是因为结构中Y原子只有1个,X原子有2个,Z原子有6个,一般而言,要是得到电子的话,同种元素原子均应该得到电子,即X原子需要得到2个电子,Z原子需要得到6个电子,因此一定是元素Y得到了电子。Y得电子以后形成稳定的8电子结构,并且Y形成了2个共价键,说明Y最外层有5个电子,其中有3个单电子,则Y一定是第ⅤA元素,可能为N或P元素。再根据“Z核外最外层电子数是X核外电子数的一半”,可以推知元素X为Si元素。至此,所有元素全部推出,W、X、Y、Z分别为Na、Si、P、Cl。 答案:C 点拨:(1)Y为P元素,其最高价氧化物的水化物是H3PO4,H3PO4属于弱酸的范畴,并且是弱酸中酸性较强的一种酸,因此也称为中强酸。(2)关注P元素的其他含氧酸,比如说次磷酸H3PO2分子中虽然有3个H原子,但是次磷酸为一元弱酸。 例7一种由短周期主族元素组成的化合物(如图3所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是( )。 图3 A.该化合物中,W、X、Y之间均为共价键 B.Z的单质既能与水反应,也可与甲醇反应 C.Y的最高化合价氧化物的水化物为强酸 D.X的氟化物XF3中原子均为8电子稳定结构 解析:题干主要呈现了两个信息:①短周期主族元素W、X、Y、Z的原子序数依次增大、且总和为24;②物质的结构式图。后者是主要的突破口,W只能形成一个共价单键,Z可形成+1价阳离子,结合原子序数的信息,可推断W为氢元素,Z为钠元素,X有四条单键,两个Y原子均为三条单键,而阴离子团只带一个负电荷,可推断Y形成三条共价键达到稳定结构,为氮元素,根据原子序数和及成键数目,推断X为5号元素硼。根据上述推断,该化合物中,H、B、N之间均以共用电子对形成共价键,A选项正确。Na单质既能与水反应生成氢氧化钠和氢气,也能与甲醇反应生成甲醇钠和氢气,B选项正确。N的最高价氧化物的水化物HNO3为强酸,C选项正确。BF3中B原子最外层只有6个电子,未达到8电子稳定结构,D选项错误。 答案:D 点拨:这一类型的题目,化合物的结构式图是重要的突破口,利用结构式图可以判断化学键类型及化合物类型,同时可以判断元素间的共价键数目或离子所带的电荷数,从而推断出元素的最外层电子数。因此同学们要熟练掌握短周期主族元素的电子排布特点和成键特点,熟练掌握化合物的电子式书写规则,能根据陌生物质的结构式,推断元素成键数目或最外层电子数目,达到确定元素的目的。 例8一种麻醉剂的分子结构式如图4所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是( )。 图4 A.XEZ4是一种强酸 B.非金属性:W > Z > Y C.原子半径:Y > W > E D.ZW2中,Z的化合价为+2价 解析:题干信息显示,X的原子核只有1个质子,可知X为H元素。“元素Y、Z、W原子序数依次增大,且均位于X的下一周期”,结合题中所给结构式,Y形成4条共价键,可推知Y是C元素。Z形成两条共价键,可推知Z是O元素。W只能形成1条共价键,则W为F元素,而“元素E的原子比W原子多8个电子”,可推知E为Cl元素。根据上述推断,可知XEZ4是HClO4,是一种强酸,A项正确。同一周期主族元素从左至右非金属性逐渐增强,所以非金属性F>O>C,B项正确。同一主族元素从上至下原子半径逐渐增大,原子半径Cl>F,C项错误。在OF2中,F为-1价,则O的化合价为+2价,D项正确。 答案:C 半衰期:放射性元素衰变到原来一半数量所需的时间,天然存在的放射性元素具有一定的半衰期。 例9放射性同位素14C可用来推算文物的“年龄”。14C的含量每减少一半要经过约5 730年。某考古小组挖掘到一块动物骨骼,经测定14C还剩余,推测该动物生存年代距今约为( )。 A.5 730×3年 B.5 730×4年 C.5 730×6年 D.5 730×8年 答案:A 点拨:本题是2007年高考题,虽然这种题型在目前高考真题中出现的频率低些,但是同学们可以关注一下这类题型,近几年高考考到的几率还是有的。 例10X、Y为第三周期元素,Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]-的形式存在。下列说法错误的是( )。 A.原子半径:X>Y B.简单氢化物的还原性:X>Y C.同周期元素形成的单质中Y氧化性最强 D.同周期中第一电离能小于X的元素有4种 答案:D 点拨:利用题中所给的信息可以推导出Y是Cl元素,然后根据[XCl4]+或者[XCl6]-均可以推出X为+5价的P元素,因此本题难度并不大。本题是由一道全国高中生化学竞赛试题改编而成的。通过这道试题可以看出,同学们要适当拓展知识面,若是平时学习的过程中已经了解过这些信息,一旦在考试中出现此类试题,就能够轻松推出相应的元素,达到事半功倍的效果。 【反馈练习】(关于月球土壤方面的内容) 1.人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为( )。 2.我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的He,每百吨He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以He 的形式存在。下列说法正确的是( )。 3.据报道,月球上有大量3He存在,以下关于3He的说法正确的是( )。 A.3He是4He的同分异构体 B.3He比4He多一个中子 C.3He是4He的同位素 D.3He比4He少一个质子 4.地球上氦元素主要以4He形式存在,而月球土壤中吸附着数百万吨3He,据估算3He核聚变所释放的能量可供人类使用上万年。下列说法正确的是( )。 ①3He、4He的化学性质基本相同 ②3He、4He具有相同的中子数 ③3He核聚变是化学变化 ④3He液化是物理变化 A.①② B.①④ C.②③ D.③④ 5.我国嫦娥五号探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似,土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15,X、Y、Z为同周期相邻元素,且均不与W同族,下列结论正确的是( )。 A.原子半径大小顺序为W>X>Y>Z B.化合物XW中的化学键为离子键 C.Y单质的导电性能弱于Z单质的 D.Z的氧化物的水化物的酸性强于碳酸 答案:1.B 2.B 3.C 4.B 5.B第三类:核化学型
第四类:结构式型



第五类:半衰期型
第六类:其他类型
