大型海藻裂片石莼藻粉对赤潮异弯藻光合作用抑制的研究
2022-03-15余娇娇张超雯赵建刚叶长鹏
余娇娇 刘 洪 张超雯 赵建刚 叶长鹏
(暨南大学水生生物研究中心, 广东省教育厅富营养化和赤潮防治重点实验室, 广州 510632)
赤潮是近年来主要的海洋灾害之一, 赤潮的频繁暴发, 对全球海洋生态环境造成了严重的影响,同时引起了巨大的经济损失, 并危害人类健康[1]。赤潮防治已成为全世界最为关注的研究课题之一[2]。传统的赤潮防治方法如物理和化学方法均有一定的局限性, 并且存在二次污染的可能性。生物防治法则具有成本低和环境友好等特点, 在防治赤潮方面有巨大潜力和应用前景[3]。
许多研究报道水生植物、微生物对赤潮微藻有良好的抑制作用[4—6], 但都有利用规模和区域的限制。而大型藻类作为海洋生态系统中资源丰富和环境友好的土著种, 具有较强的吸收氮磷营养盐的能力[7,8], 是治理赤潮的理想生物材料。大量研究表明大型海藻可以通过竞争和化感作用抑制赤潮微藻[8,9]。例如张善东等[10]研究了大型海藻龙须菜(Gracilaria lemaneiformis)通过营养竞争抑制赤潮微藻的生长; 刘之威等[11]在海域规模培养龙须菜的研究同样表明大型海藻可以降低海水富营养化程度、抑制有害藻华发生。南春容和董双林[12]研究则表明即使在无营养竞争的情况下, 高密度的大型海藻孔石莼(Ulva pertusa)依然能抑制赤潮微藻的生长; 罗丽娜[13]研究的4种大型海藻均能化感抑制赤潮异弯藻(Heterosigma akashiwo); Ye等[14,15]、卢慧明[16]、余江等[17]的多个研究报道显示龙须菜可以抑制多种赤潮微藻, 并在其中提取出化感物质。此外, 还有大量研究报道了多种大型海藻对赤潮微藻的抑制作用, 如蜈蚣藻(Grateloupia filicina)、裙带菜(Undaria pinnatifida)[9]、浒苔(Enteromorpha prolifera)[18,19]和紫菜(Porphyra yazoensis)[20]。
裂片石莼(Ulva fasciata)是一种常见的大型海藻, 广泛分布于我国沿海地区, 具有生长快速, 低成本、易于收集和环保的优势[21], 一直被视为开发食品[22]、保健品[23]、饲料[24]和燃料[25]等重要海洋资源。同时, 裂片石莼还可以净化水质, 吸收重金属元素[26], 在降低近海岸及海产养殖区富营养化的同时, 减少有害水华的发生[27]; 裂片石莼对多种赤潮微藻有化感抑制作用, 从中分离出的一些化感物质并已被证实对多种赤潮微藻有良好的抑制效果[28], 是控制赤潮藻的潜在材料。赤潮异弯藻是一种广温广盐性赤潮藻, 在温带水域的夏、秋季生长最快。赤潮异弯藻能产生溶血性毒素,是引起鱼类大量死亡的主要有害藻种之一[29]。裂片石莼具有强抑藻活性, 但已有研究主要侧重于从表观生长和基础光合效率的角度观察抑藻效果,裂片石莼对赤潮微藻光合作用结构和功能抑制机制没有详细解析。因此本研究选取大型海藻裂片石莼和典型的赤潮微藻赤潮异弯藻作为研究对象。光合作用是赤潮藻生长的原初动力, 叶绿体是光合作用的发生场所, 为了更好地阐明大型海藻对微藻的抑制机理, 有必要对大型海藻介导下赤潮微藻的光合作用过程, 以及叶绿体相应的微观结构变化进行更系统的研究。为此, 本文展开了大型海藻裂片石莼干粉(以下简称石莼藻粉)对赤潮异弯藻的光合抑制研究, 以期阐释裂片石莼对赤潮异弯藻抑制的光合生理生物学机制, 为大型海藻的赤潮治理提供理论依据和数据支持。
1 材料与方法
1.1 实验材料
研究所采用的赤潮异弯藻源自暨南大学水生生物研究中心藻种室, 使用f/2培养基培养。调节培养液为盐度30‰, pH8.0; 培养条件为温度20℃, 光照强度70 μmol·photons/(m2·s)(白光), 光照周期12h∶12h(L∶D)。大型海藻裂片石莼采自广东省汕头南澳海域, 低温运至实验室后立即用经0.22 μm滤膜过滤并灭菌的天然海水漂洗多次后, 置于室温下风干至恒重, 再研磨成粉, 收集经80目绢筛过筛后的石莼藻粉, 常温保存备用。
1.2 实验方法
取初始密度为2.0×104cells/mL的赤潮异弯藻0.3 L放入规格为1 L的锥形瓶中, 再加入石莼藻粉。石莼藻粉装入由100 μm筛绢制成, 并加入了适量玻璃珠(使藻粉沉入瓶底)的无菌缩口小袋中, 浓度梯度设置为0、0.6、1.2、2.4和4.8 g/L, 每个梯度设置3个平行。实验培养条件为温度20℃, 光照强度为70 μmol·photons/(m2·s)(白光), 光照周期L∶D=12h∶12h。实验周期为4d, 每天早上8点定时采集等体积藻液来测定相关指标。
1.3 光合色素含量的测定
用甲醇提取法测定叶绿素a与类胡萝卜素含量,根据Wellburn[30]的公式计算:
叶绿素a: Chl.a(μg/mL)=[16.29×(A665-A750)-8.54×(A652-A750)]×Va/Vb
类胡萝卜素: Car (μg/mL)=7.6×[(A480-A750)-1.49×(A510-A750)]×Va/Vb
赤潮异弯藻生物量变化用叶绿素a含量来表征。
1.4 叶绿素荧光参数的测定
叶绿素快速荧光动力学曲线由植物效率分析仪(PEA, Hansatech)测定。JIP指标(JIP-test)测定是依据能量流动模型[31—33], 各参数含义如表1。

表1 叶绿素快速荧光动力学参数及含义Tab. 1 Parameters derived from chlorophyll fluorescence transients and their meaning
1.5 细胞微观结构的测定
利用透射电子显微镜(TEM)测定赤潮异弯藻叶绿体等微观结构变化。在实验72h时, 取对照组和最高浓度处理组进行透射电镜观察, 比较微观结构异同之处。
1.6 数据统计与分析
实验数据经Excel 2010进行处理, 用SPSS作单因素方差分析,P<0.05时为显著差异。用Origin 9.0和Ai进行作图。
2 结果
2.1 对赤潮异弯藻光合色素的影响
赤潮异弯藻暴露于不同生物量石莼藻粉后, 随着时间的延长, 石莼藻粉对微藻的生长产生了显著抑制作用, 不同生物量梯度处理组下的赤潮异弯藻色素含量相较于同时期的对照组下降明显, 且呈现出较强的剂量效应和时间效应(图1)。2h时, 所有石莼藻粉处理组的赤潮异弯藻叶绿素(Chl.a)、类胡萝卜素(Car)含量与对照组相比均无显著差异; 而24h开始至实验结束, 各浓度梯度处理组赤潮异弯藻的2种色素含量显著低于对照组(P<0.05); 在72h时, 0.6、1.2、2.4和4.8 g/L石莼藻粉处理组对赤潮异弯藻抑制率分别为19.6%、46.5%、71.4%和79.4%。石莼藻粉对赤潮异弯藻的生长抑制效果明显。

图1 裂片石莼藻粉对赤潮异弯藻叶绿素a和类胡萝卜素含量的影响Fig. 1 Effects of dried U. fasciata on Chlorophyll a and carotenoid contents of H. akashiwo
2.2 对赤潮异弯藻叶绿素快速荧光动力学曲线的影响
石莼藻粉对赤潮异弯藻OJIP曲线的影响同样有较强的时间效应和剂量效应(图2)。2h时, 各个浓度处理组的I相、P相对于对照组就有了小幅度的下降; 72h时, 各个处理组OJIP曲线相对于对照组的下降幅度与石莼藻粉生物量呈正相关, 4个处理组中只有0.6 g/L处理组的OJIP曲线依然清晰可辨,1.2 g/L处理组OJIP相较平缓, 2.4和4.8 g/L处理组则近似一条直线。
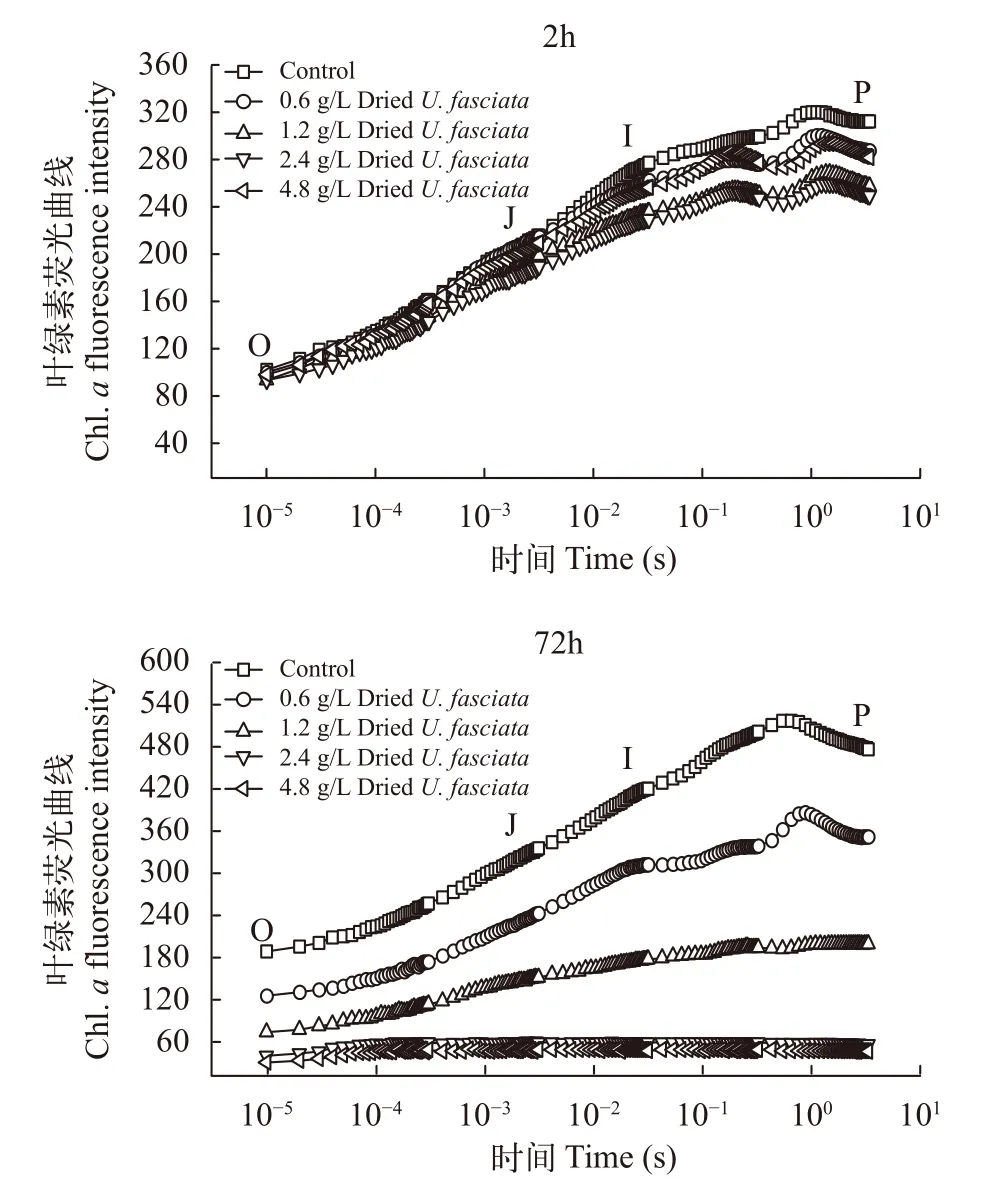
图2 裂片石莼藻粉对赤潮异弯藻OJIP曲线的影响Fig. 2 Effects of dried U. fasciata on Chlorophyll a fluorescence transients of H. akashiwo
2.3 对赤潮异弯藻PSⅡ能量流动比活性的影响
如图3所示, 经裂片石莼藻粉处理2h后, 各个处理组的赤潮异弯藻ABS/RC、TRo/RC值与对照组无显著性差异, 而各处理组ETo/RC已经显著低于对照组。72h后, 2.4和4.8 g/L两处理组的ABS/RC、TRo/RC值显著高于对照组, 1.2、2.4和4.8 g/L三组的ETo/RC值显著低于对照组; 4.8 g/L处理组的单位反应中心吸收的能量ABS/RC和用于还原QA的能TRo/RC分别上升至对照组的15倍和1.5倍, 而电子传递的能量ETo/RC则下降了81.3%, 说明赤潮异弯藻的光反应中心Ⅱ(PSⅡ)遭破坏, 并且电子传递效率下降。
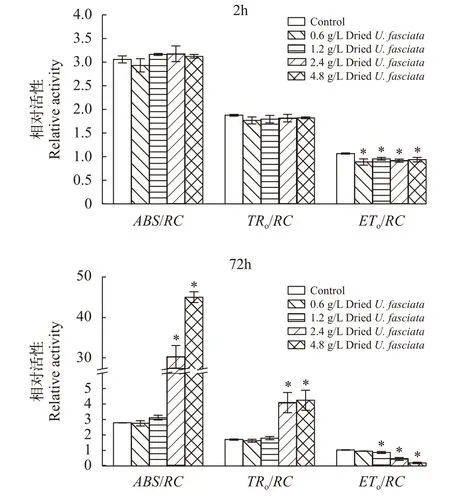
图3 裂片石莼藻粉对赤潮异弯藻比活性参数的影响Fig. 3 Effects of dried U. fasciata on specific energy fluxes per RC of H. akashiwo
2.4 对赤潮异弯藻PSⅡ能量分配比率的影响
石莼藻粉对赤潮异弯藻PSⅡ能量分配比率的影响同样有一定的时间效应和剂量效应(图4)。2h时, 各处理组的3种量子产额基本都显著低于对照组。然而在72h时, 除0.6 g/L处理组相对于对照组没有显著变化, 其他3个处理组均显著低于对照组。这可能是低生物量的石莼藻粉对赤潮异弯藻的影响有限, 对其抑制作用会随着时间削弱。高生物量的石莼藻粉(4.8 g/L)使赤潮异弯藻最大光化学效率ψPo、电子传递所用的量子产额ψEo和QA下游能量占总能量的比率Ψo分别下降81.2%、91.7%和81.7%, 赤潮异弯藻光合效率下降, 并且电子传递阻断于QA处。

图4 裂片石莼藻粉对赤潮异弯藻能量分配比率的影响Fig. 4 Effects of dried U. fasciata on energy flux ratios of H.akashiwo
2.5 对赤潮异弯藻细胞微观结构的影响
赤潮异弯藻, 无细胞壁, 细胞核一般较小。叶绿体7—15个, 有淀粉核, 无眼点、伸缩泡和黏液泡。对照组和处理组培养时间均为72h。
在对照组(图5a)的赤潮异弯藻细胞中, 叶绿体(C)内物质丰富, 呈圆盘状, 分布在细胞质外侧, 类囊体(Thy)片层排列整齐, 在每个叶绿体中都是沿着一个方向排列(图5b), 并且有靠近细胞外侧分布密集而靠近细胞内侧分布松散的趋势, 这样的分布便于叶绿体吸收光能进行光合作用, 类囊体片层部分位置垛叠密集, 形成类似高等植物的类囊体基粒结构。而在处理组 (图5c)细胞中, 叶绿体内物质稀疏, 分布散乱, 叶绿体外膜破裂, 类囊体分布没有明确的趋向性, 排列也没有方向性, 类囊体片层(图5d)多处断开, 许多叶绿体变得模糊, 膜系统融合、混成一团。
在对照组(图5a)中可以看到, 赤潮异弯藻细胞膜(Cm)完整, 整个细胞形态完整清晰, 细胞核(N)处于细胞中央, 核仁(Nc)明显, 多个叶绿体(C)分布在细胞质外围, 线粒体内膜向内折叠形成非常密集的内脊。由于缺乏细胞壁的保护, 处理组(图5c)的细胞受损非常明显, 细胞膜破裂严重导致难以观察、分辨出细胞膜的存在, 细胞内物质散落杂乱, 线粒体变的肿胀, 外膜出现裂口, 内脊减少、退化, 非常松散, 少数脊突结构从外膜裂口散出。核膜有破裂,整个核形态较难识别, 核内的核仁也难以分辨。

图5 赤潮异弯藻细胞微观结构的变化Fig. 5 Changes in cell microstructure of H. akashiwo
3 讨论
3.1 对赤潮异弯藻生长的影响
藻类光合色素含量是反映其光合效率的重要指标, Tang 和 Gobler[34]的研究结果显示, 1 g/L的石莼藻粉就能显著抑制锥状斯氏藻(Scippsiella trochoidea)、中肋骨条藻(Skeletonema costatum)和海洋原甲藻的生长; 罗丽娜[13]研究发现, 1 g/L的裂片石莼、龙须菜和细基江蓠(Gracilaria tenuistipitata)藻粉都能显著抑制赤潮异弯藻的生长, 并且1 g/L的石莼藻粉在48h时对赤潮异弯藻就有了53%的抑制率,比本研究的抑制率更强, 这可能是因本实验赤潮异弯藻起始生物量与罗丽娜实验不一致所致。在本研究中, 石莼藻粉同样能有效抑制赤潮异弯藻的生长, 这与同类研究结果较一致[13—15]。
大型海藻可以通过化感作用抑制赤潮微藻的生长, 在不同处理方式下对赤潮微藻的影响效果不同, 例如Tang和 Gobler[34]的研究表明, 与新鲜的大藻相比, 等量的孔石莼藻粉对有害藻类的抑制效果相当或更好; 罗丽娜[13]同样发现3种大型海藻藻粉在实验前期对赤潮异弯藻的抑制效果更好, 而在实验后期鲜藻的抑制效果更好; 南春容和董双林[12]研究发现即使在营养盐充足情况下, 新鲜的石莼依然可以抑制赤潮微藻生长。这些研究结果说明大型海藻粉可能更快地释放化感物质抑制赤潮微藻的生长, 而新鲜的大藻则可能持续释放化感物质, 抑制赤潮微藻。不同溶液的大藻浸提物对赤潮微藻也有不同的抑制效果, 韩秀荣等[35]发现浒苔有机提取物抑藻效果强于水相提取物; 崔峰[19]同样发现不同溶液的浒苔提取物抑藻效果不同, 对不同藻类抑制效果也有差别。卢慧明[16]在龙须菜中分离出多种有抑藻活性的化感物质, 其中亚油酸有较强的抑藻活性。这说明大型海藻中有多种化感物质, 它们共同作用下可以对多种赤潮微藻产生强烈的抑制作用。在本研究中, 裂片石莼藻粉对赤潮赤潮异弯藻的抑制效果强烈, 具体表现为OJIP曲线下降, 相关叶绿素荧光参数改变, 并有较强的时间效应和剂量效应, 实验所用的石莼藻粉放置于缩口小袋中,所以对赤潮异弯藻并无遮光作用和营养竞争, 也排除了微生物的干藻, 因此石莼藻粉对赤潮异弯藻的抑制作用很可能是其化感物质所致, 这也与同类研究结果和结论一致[13—15,28]。实验的裂片石莼干燥后被研磨成粉, 这一过程可能促进了化感物质的释放, 增强了抑制效果[36]。如前文所述, 在本研究结果中, 石莼藻粉的抑藻效果低于罗丽娜研究结果[13],其原因可能是赤潮异弯藻的起始生物量不同。而孙颖颖等[20]的实验表明添加大藻粉不会造成营养盐加剧的情况, 说明大型海藻防治赤潮有很高的实际可行性。
3.2 对赤潮异弯藻细胞微观结构的影响
高生物量(4.8 g/L)的裂片石莼藻粉能破坏赤潮异弯藻的细胞结构, 导致其叶绿体破裂, 类囊体排列混乱、片层断开或融合, 同时破坏了线粒体、细胞核和细胞膜等结构。石莼藻粉中的化感物质可能是破坏赤潮异弯藻细胞结构的关键。张庭廷等[37]发现亚油酸能使铜绿微囊藻(Microcystis aeruginosa)细胞内离子外流、DNA等生物大分子向外释放; 卢慧明[16]和余江等[17]在龙须菜中同样分离出化感物质亚油酸, 对2种赤潮微藻的细胞微观结构也有类似的破坏作用。关于大型海藻的化感物质对赤潮微藻细胞结构的损伤机制报道并不多, 本实验中石莼藻粉对赤潮异弯藻微观结构破坏明显, 其机制需要更进一步研究。另外, 仅少数藻类中有“基粒类囊体”结构, 本实验的透射电镜结果表明赤潮异弯藻中无“基粒类囊体”。在研究藻类时, 不仅需要注意其表观生长和光合效率的变化, 结合优质的透射电镜观察结果研究其微观结构变化也十分重要。
3.3 对赤潮异弯藻光合效率的影响
叶绿素荧光参数是反映植物光合效率的重要指标, 在石莼藻粉的作用下, 赤潮异弯藻的OJIP曲线趋于直线、ABS/RC上升和Ψo下降等情况说明赤潮异弯藻的光合效率下降。有研究认为OJIP曲线平缓是因QA以后的电子传递链受到损坏[38]; 也有研究认为是因为放氧复合体不能向PSⅡ提供电子[39];还有研究者认为J-P相下降的原因是电子供侧体受到了抑制[40]。在本研究中, PSⅡ最大光化学效率ψPo降低、超过QA的电子占比率Ψo和用于电子传递的能量ETo/RC减少也同样说明了石莼藻粉破坏了赤潮异弯藻PSⅡ反应中心, 使其光化学效率下降, 供侧体提供电子减少, 电子传递链被阻断在QA到QB处。许多同类研究也得到了类似的结果,然而相关研究者们没有对这个结果做进一步的解释。本研究的透射电镜结果表明叶绿体内的微观结变化可能是微藻光合效率下降的主要因素之一。
反应中心处于类囊体膜上, 类囊体结构的破坏将导致PSⅡ个数减少、性能下降, 这很可能是处理组单位反应中心吸收光能量ABS/RC增多(图3)而最大光化学效率ψPo降低的原因。在电子传递链中,电子可以自发传递到QA处, 但是从QA传到QB需要伴随着质子的跨膜流动, 并随后扩散到类囊体膜中进行下一步传递。光合电子传递链的几个重要反应都偶联发生类囊体腔内质子的累积, 腔内pH的降低会自动使电子传递速度慢下来, 类囊体膜是维持质子浓度梯度的关键。由电镜照片结果可知, 裂片石莼藻粉使赤潮异弯藻类囊体片层断裂、融合, 这很可能导致膜两侧质子梯度消失, 无法推动电子从QA传到QB, 能量堆积于QA, 具体表现为单位反应中心用于还原QA的能量TRo/RC增多(图3)而传递超过QA的电子占比率Ψo减少。同时电子也难以有效的在断开、融合的类囊体膜中进行下一步传播, 整个电子传递链所利用的能量减少, 即单位反应中心捕获的用于电子传递的能量ETo/RC和用于电子传递的量子产额ψEo减少。此外, 裂片石莼藻粉还破坏了赤潮异弯藻的线粒体、细胞核和细胞膜, 这将从能量代谢、遗传和增殖等方面抑制其生长, 详尽的机制还需要进一步的工作予以解析。
4 结论
(1)大型海藻裂片石莼藻粉可以显著降低赤潮异弯藻的光合色素含量, 使PSⅡ供侧体和反应中心性能下降, 阻断电子传递, 从而降低光合效率; 同时裂片石莼藻粉可以破坏赤潮异弯藻的细胞结构, 并且类囊体结构的破坏可能是电子传递阻断的主要原因之一。(2)大型海藻裂片石莼是一种潜在的防治以赤潮异弯藻为优势种所引发赤潮的“工具藻”,需对其生物防治赤潮实际应用做更深入的研究。
