不同修复植被类型的三峡库区消落带土壤细菌群落分析
2022-03-15李彦杰蒋梦芸杨俊年刘仁华
李彦杰, 蒋梦芸, 杨俊年, 刘仁华, 钟 彦, 王 晶
(1.重庆三峡学院 生物与食品工程学院, 重庆 404100; 2.重庆三峡学院 教师教育学院, 重庆 404100)
三峡大坝建成后,因水库调度引起的水库水位变动,使得库区两岸形成了垂直落差达30 m的周期性水淹—露出交替地带,即三峡库区消落带。水库水位变化破坏了消落带原有植被生态系统,进而引发了诸多生态环境问题,恢复和重建消落带生态系统是消落带治理的关键。
土壤细菌可促进地球养分循环,改良土壤结构,提高土壤有机质转化,进而促进植物生长,对维持植被-土壤生态系统的稳定具有重要作用[1]。土壤细菌群落具有明显的时空特征,受土壤pH值、养分、质地、气候条件、人工措施、地理位置和植被类型等影响[2-3]。土壤细菌群落结构受多种非生物胁迫因子的驱动,塑造后的新群落既作用于逆境下由细菌介导的土壤养分转化及利用过程,也通过和植物的物质交流等共同调节植物的抗逆性[4-5],故分析重建后的细菌群落结构对揭示植物的抗逆机制具有重要意义。此外,土壤细菌群落结构多样性及功能对植物生存环境状况及植被-土壤系统的重建评价也具有一定的指示价值。目前,已有多个研究表明植被状况(有植被区和无植被区等)[6-8]和水淹高程[9-10]均会影响三峡库区消落带土壤细菌群落多样性,而不同类型的修复植被对土壤细菌群落的影响鲜见报道。本研究在重庆市万州区沱口“三峡水库消落区植被修复试验示范基地”内,分别选择纯草地、纯林地和覆草林地3种修复植被样地土壤为研究对象,探讨不同样地对土壤细菌群落结构的影响,以期为后续研究消落带土壤微生物如何影响植物的耐淹性提供基础。
1 材料与方法
1.1 研究区概况
研究区块位于重庆市万州区百安坝沱口片区长江边的“三峡水库消落区植被修复试验示范基地”(30.77°N,108.43°E)内,属三峡库区自然消落带。万州区位于四川盆地东缘,重庆市东北边缘,地处长江中上游结合部,属亚热带季风湿润气候,四季分明,日照充足,冬暖多雾,霜雪稀少,夏热多伏旱,雨量充沛;多年平均气温17.7℃,极端最高气温42℃,最低气温零下3.7℃,平均年日照时数1 484 h,多年平均降水1 243 mm。示范基地在三峡大坝175 m蓄水前大部分为旱作缓坡耕地和梯田耕地。
1.2 试验设计及采样方法
示范基地为三峡库区自然消落带,每年随着三峡大坝的水位变化均经历周期性的水淹—露出的过程。示范基地有纯草地、纯人工林地、覆草人工林地和混交林等多种不同类型修复植被区。纯草地有原生区和多年移栽区,分布于145~175 m水淹高程,优势种均为狗牙根(Cynodondactylon),零星可见野古草(Arundinellaanomala)、牛鞭草(Hemarthriacompressa)和苍耳(Xanthiumsibiricum)等。纯人工林地和覆草人工林地主要位于165~175 m高程,林木均为2012年来陆续种植的中山杉(Taxodium‘Zhongshanshan’),其中覆草林地草本优势种为狗牙根。经9个周期性水淹—露出试验,人工林和覆草林地的中山杉成活率超过85%,2012年移栽的纯草地和覆草人工林的狗牙根成活率接近100%。2020年4月选择示范基地165~167 m水淹高程(每年经历最大水淹深度为10~12 m,水淹时间约为200 d)地势平缓、露出水面的纯草地(A1)、纯林地(A2)和覆草林地(A3)为研究对象,每个样地设置3个重复样带(5 m×10 m),各样带间隔10 m,3种样地共有9个样带。
样带内采取5点取样法,取5个样点表层0—20 cm土壤混合后作为该样点土样,树下土壤采样在以树体为原点的50 cm半径范围内完成。取样时首先去除土壤残枝、落叶和石砾等物,取样后低温保存并迅速带回实验室。一部分土样-80℃保存用于微生物多样性分析,剩余土样风干后用于土壤理化性质测定。
1.3 土壤理化性质测定
土壤pH值采用水浸提电位法,按土水比为1∶2.5混匀,静置30 min后测定;土壤有机碳(soil organic carbon,SOC)采用重铬酸钾氧化-外加热法(NY/T1121.6—2006)测定;土壤全氮(total nitrogen,TN)采用凯氏法(HJ717—2014)测定;土壤全磷(total phosphorus,TP)采用NaOH碱熔-钼锑抗分光光度法(HJ632—2011)测定。
1.4 土壤DNA提取及16S rDNA测序
用MN NucleoSpin 96 Soi试剂盒(MACHEREY-NAGEL,Germany)提取土壤DNA,并用1%琼脂糖凝胶电泳和Synergy HTX多功能微孔板检测仪(BioTek,USA)检测DNA的完整性和纯度。用338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物扩增细菌16S rDNA的V3—V4区。50 μl扩增体系:100 ng模板DNA,1.5 μl引物(10 μmol/L),25 μl 2×PCR buffer for KOD FX Neo(Toyobo,Japan),1.0 μl KOD FX Neo高效PCR酶(1.0 U/μl) (Toyobo,Japan)和10 μl dNTP(2 mmol/L)。扩增条件为:95℃预变性5 min,95℃变性40 s,55℃退火40 s,72℃延伸40 s,25个循环,72℃延伸7 min。PCR产物经1.8%的琼脂糖凝胶电泳检测后,切胶回收,送至北京百迈客生物科技有限公司用Illumina Hiseq 2500平台测序。
1.5 数据处理
原始测序数据经过滤、拼接、嵌合体去除和长度筛选后,在97%相似性水平作OTUs聚类;基于RDP classifier比对Silva 16S rRNA基因数据库对所有OTUs代表序列作物种注释;基于Mothur v.1.30计算样品的ACE指数、Chao1指数、辛普森指数和香浓指数。采用Excel 2019(Microsoftware,USA)作数据整理,统计分析采用R包,其中Kruskal-Wallis法用于评价样本间的微生物多样性指数的差异显著性(α=0.05),单因素分析和Turkey法用于评价样本间理化因子的差异显著性(α=0.05),斯皮尔曼相关系数(Spearman correlation coefficient,ρ)用于评价土壤理化因子与细菌多样性指数、优势菌属与土壤理化因子的相关性;采用Canoco 5.0(Microcomputer power, USA)作冗余分析(redundancy analysis, RDA)。
2 结果与分析
2.1 不同样地土壤理化性质
由表1可知,纯草地(A1)、纯林地(A2)和覆草林地(A3)的土壤酸碱度均趋于中性,且三者间无显著性差异;A1和A3的土壤有机碳(SOC)含量之间无显著性差异,但均显著高于A2(p<0.05);3种样地的全氮(TN)和全磷(TP)含量之间无显著性差异。
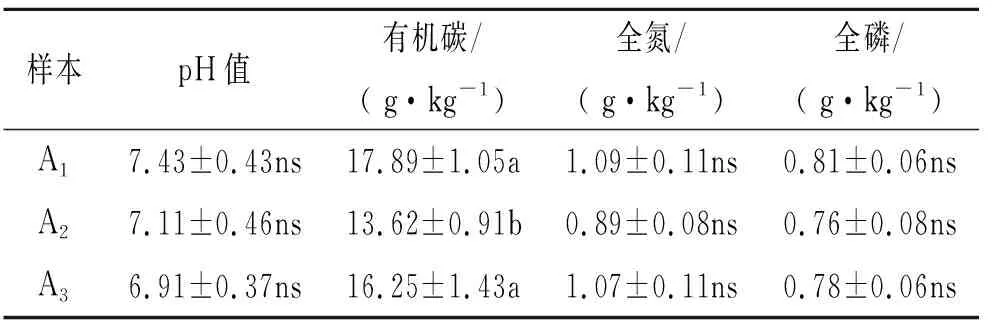
表1 不同样地土壤的理化性质
2.2 土壤细菌群落的α多样性
对测序原始数据预处理及OTUs聚类,结果显示,A1组共有1 296条OTUs,其中特有OTUs数目为217;A2共有1 294条OTUs,其中特有OTUs数目为12;A2共有1 222条OTUs,其中特有OTUs数目为38;三者共有OTUs数目为852。基于ACE指数、Chao1指数、辛普森指数和香浓指数评估A1,A2和A3的细菌群落丰富度和多样性,结果显示不同样地之间的细菌群落丰富度和多样性指数差异均不显著(表2)。
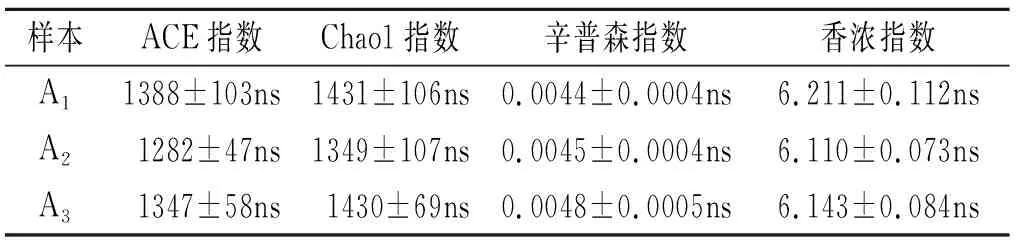
表2 不同样地土壤细菌的α多样性指数
2.3 土壤理化因子与细菌群落多样性
相关性分析结果显示(表3),土壤的SOC和TN含量均与细菌ACE丰富度指数和香浓多样性指数显著正相关(p<0.05),SOC含量与Chao1指数显著正相关(p<0.05)。
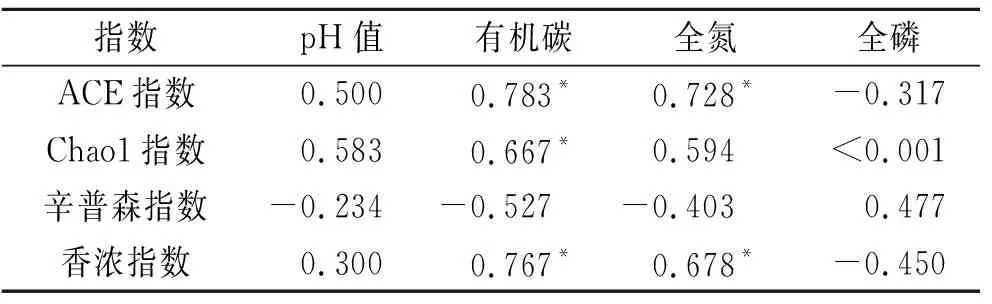
表3 土壤理化因子与细菌群落α多样性指数的相关性
2.4 不同样地的细菌群落组成特征
统计A1,A2和A3样地在门水平可注释的相对丰度排序前10的微生物优势种群依次为变形菌门(Proteobacteria)(36.67%,28.48%,30.67%)、酸杆菌门(Acidobacteria)(20.66%,23.66%,25.79%)、绿弯菌门(Chloroflexi)(13.38%,5.60%,7.61%)、放线菌门(Actinobacteria)(4.27%,11.51%,6.99%)、芽单胞菌门(Gemmatimonadetes)(8.21%,8.42%,7.33%)、Rokubacteria(2.69%,6.04%,5.91%)、拟杆菌门(Bacteroidetes)(4.40%,1.07%,1.89%)、Latescibacteria(3.75%,3.00%,3.08%)、硝化螺旋菌门(Nitrospirae)(2.47%,3.46%,3.40%)和厚壁菌门(Firmicutes)(0.95%,3.65%,2.39%)(图1A)。3种样地的变形菌门、酸杆菌门、绿弯菌门、放线菌门和芽单胞菌门等种群相对丰度较高,其中变形菌门和酸杆菌门两者约占土壤细菌丰度的52%以上。
如图1B所示,A1,A2和A3样地在纲水平上的主要优势种群依次为γ-变形菌纲(Gammaproteobacteria)(16.53%,12.62%,15.52%)、Subgroup_6(12.28%,6.87%,11.57%)、α-变形杆菌纲(Alphaproteobacteria)(10.61%,9.13%,7.83%)、δ-变形菌纲(Deltaproteobacteria)(9.53%,6.73%,7.32%)、芽单胞菌纲(Gemmatimonadetes)(7.55%,8.30%,7.04%)、NC10(2.69%,6.04%,5.91%)、酸杆菌纲(Acidobacteriia)(2.47%,6.84%,4.47%)、厌氧绳菌纲(Anaerolineae)(8.58%,1.69%,2.83%)、拟杆菌纲(Bacteroidia)(3.98%,0.89%,1.82%)和芽孢杆菌纲(Bacilli)(0.79%,3.20%,1.89%)。3种样地的γ-变形菌纲、α-变形杆菌纲、δ-变形菌纲和芽单胞菌纲等种群占比较高,其中变形菌门的3种变形菌纲种群占比为30%左右。
2.5 属水平细菌优势种群与土壤理化因子的相关性
在属水平,A1,A2和A3的群落中平均相对丰度大于1%的可注释优势种群有uncultured_bacterium_c_Subgroup_6(12.20%,6.87%,11.56%),uncultured_bacterium_f_Gemmatimonadaceae(7.25%,7.79%,6.54%),uncultured_bacterium_o_Rokubacteriales(2.56%,6.01%,5.83%),RB41(0.58%,5.36%,4.44%),uncultured_bacterium_p_Latescibacteria(3.40%,2.99%,3.02%),鞘氨醇单胞菌属(Sphingomonas)(3.60%,2.19%,2.31%),MND1(1.88%,2.34%,3.61%),硫杆菌属(Thiobacillus)(3.40%,0.33%,1.14%),uncultured_bacterium_f_Anaerolineaceae(3.30%,0.54%,1.02%),芽胞杆菌属(Bacillus)(0.41%,2.44%,1.00%)。属水平的细菌优势种群(相对丰度大于1%)与土壤理化因子的相关性分析结果显示(表4),uncultured_bacterium_c_Subgroup_6,硫杆菌属(Thiobacillus)和uncultured_bacterium_f_Anaerolineaceae等种群的相对丰度均与土壤SOC和TN含量显著正相关(p<0.05),RB41和芽胞杆菌属(Bacillus)等种群的相对丰度均与土壤SOC和TN含量显著负相关(p<0.05),uncultured_bacterium_o_Rokubacteriales种群的相对丰度与土壤SOC含量显著负相关(p<0.05)。

图1 不同样地细菌群落结构
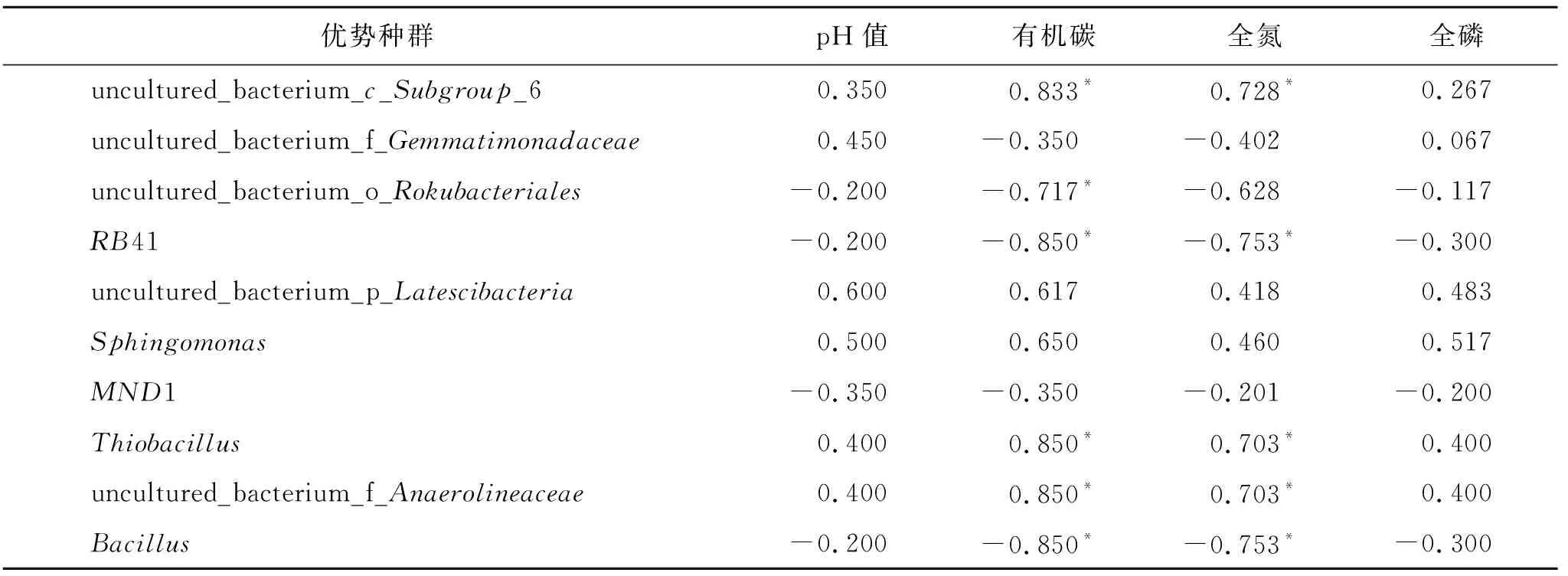
表4 属水平细菌优势种群与理化因子的相关性
进一步采取RDA对土壤理化性质和目水平细菌群落优势种群(相对丰度Top 10)进行限制性排序分析(图2),RDA1可解释总方差的71.85%,RDA2可解释总方差的5.16%,两者累积可解释总方差的77.01%。SOC,TN,pH值和TP均与RDA1负相关。条件效应分析结果显示,SOC是模型的显著性因子(pseudo-F=10.8,校正p=0.032),其解释率为60.7%,即SOC是影响三峡库区消落带土壤细菌群落结构的主要显著性因子(p<0.05)。
3 讨 论
3.1 消落带不同修复植被的土壤理化因子特征
与一般的陆生及水生系统不同的是,消落带土壤长期处于周期性的淹水—露出环境中,其土壤理化性质不但受土壤植被的影响,也受水文特征及人类活动等影响[11-12]。已有研究表明,长期水淹生境下,消落带酸性或碱性土壤的pH值均逐渐趋于中性,本研究中消落带不同修复植被的土壤pH值间无显著性差异,且均接近中性,其形成可能与消落带土壤被江水长期浸泡,以及露出时受雨水冲刷导致的有机质流失有关[13-14]。土壤SOC储量不仅受气候、地形和土壤理化性质等自然因素和管理措施、土地利用方式等人为因素的影响,也受植被状况及其生物凋落物的影响[15-16]。由于纯草地(A1)和覆草林地(A3)能提供更多植物凋落物,进而导致土壤SOC增加,故这两种样地的SOC含量均显著高于纯林地(A2)(p<0.05),这与已有研究结果类似[17-18]。土壤TN和TP含量与土母质、风化淋溶程度、气候、人为活动和植物凋落物等有关[19-20]。本研究中,3种不同植被样地的TN和TP含量均较高,且无明显差别,这与部分研究结果不符[21]。取样区域在三峡水库蓄水完成前为旱作梯田耕地,且蓄水后在175 m高程以上仍有成片坡菜地,这可能与人工添加的N和P元素迁移有关。
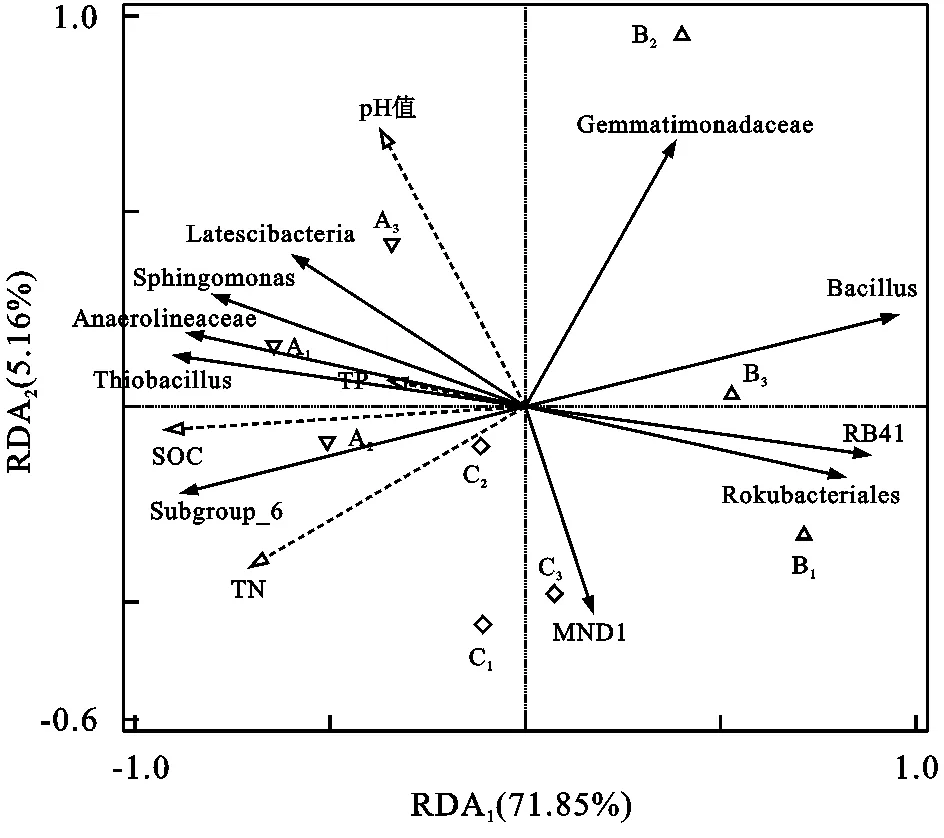
图2 目水平土壤细菌优势种群与理化因子的RDA分析
3.2 消落带不同修复植被的土壤细菌群落特征
土壤细菌群落结构与植被类型、植物多样性关系密切。植物根系分泌物及凋落物为土壤细菌的生长提供了氨基酸和碳水化合物等重要营养和能源,同时植物通过根系呼吸作用影响土壤的气体组分、pH值和氧化还原电位进而改善土壤微环境,共同促进土壤细菌生长及驱动细菌群落的演替。有研究显示针叶林、常绿阔叶林、针-阔混交林和竹林4种不同森林植被的土壤细菌群落显著不同,不同植被区土壤均有其特定优势种群[22]。土壤理化性质也可单独或和植被等共同影响特定土壤环境下的细菌群落结构。研究表明,在亚热带森林生态系统早期演替过程中,土壤理化因子、植被类型及多样性可分别解释细菌群落总变异的28%,12%,即两者共同影响土壤细菌群落结构[23]。水淹作为一种非生物胁迫因子,其缺氧和低光环境可直接影响细菌的群落结构。此外,水淹环境影响植被生长,进而影响土壤有机碳等营养组分循环和累积,也间接影响土壤细菌群落结构。有研究显示,水淹环境影响三峡库区消落带土壤细菌群落结构和多样性,其中水位变化是驱动消落带土壤细菌群落结构演替的重要因素[24]。本研究选择相近水淹高程的消落带研究样地,其多年水位变化基本一致,结果显示3种修复植物样地的细菌群落丰富度和多样性无明显差异。SOC显著影响属水平的细菌Top10优势种群(p<0.05),结合表1的土壤理化性质,推测相近高程下消落带的不同修复植被通过可提供给土壤的有机碳数量影响土壤细菌群落结构。
3种样地的优势菌门均为变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria),且其门、纲水平的Top10优势种群及相对丰度与多个相近环境中土壤细菌群落组成类似[25]。已有研究表明,变形菌门主要由γ-变形菌纲(Gammaproteobacteria)、δ-变形菌纲(Deltaproteobacteria和α-变形菌纲(Alphaproteobacteria)等组成,相对丰度约占土壤细菌的30%,其可参与土壤的有机物降解及N元素等养分循环过程[26]。本研究中,变形菌门(Proteobacteria)γ-变形菌纲(Gammaproteobacteria)和δ-变形菌纲(Deltaproteobacteria)的平均相对丰度在纯草地(A1)和覆草林地(A3)土壤较高,α-变形菌纲(Alphaproteobacteria)的平均相对丰度在3种样地基本一致,显示不同修复植被对消落带土壤的固氮种群无明显影响。酸杆菌门(Acidobacteria)具有嗜酸和寡营养等特点,其通过参与纤维素降解和金属元素循环等在土壤生态过程中起重要作用。从A1,A2到A3样地,土壤的pH值呈下降趋势,酸杆菌门的相对丰度呈上升趋势,这与多个研究发现的土壤中酸杆菌的相对丰度与土壤pH值负相关的结论相符[27]。绿弯菌门(Chloroflexi)厌氧绳菌纲(Anaerolineae)广泛分布于水生及湿地土壤中,其功能主要与土壤有机碳的降解有关[28-29]。纯草地(A1)和覆草林地(A3)比纯林地(A2)可提供更多植物残体,可促进与有机质降解的细菌种群增殖,故这两种样地的厌氧绳菌纲(Anaerolineae)相对丰度较高。
4 结 论
(1) 相近水淹高程下,三峡库区消落带不同修复植被类型样地土壤pH值、TN和TP含量无明显差别,其中经长期淹没—露出周期后不同样地土壤的pH值均接近中性。
(2) 相近水淹高程下,三峡库区消落带不同修复植被类型样地土壤的细菌群落丰富度和多样性无明显差异。3种样地土壤的细菌群落优势种群基本一致,其中变形菌门和酸杆菌门约占门水平土壤细菌丰度的52%以上,γ-变形菌纲、α-变形杆菌纲、δ-变形菌纲和芽单胞菌纲等约占纲水平土壤细菌丰度的30%左右。
(3) 消落带土壤细菌在属水平的多个优势种群与土壤SOC和TN显著相关(p<0.05),其中SOC是三峡库区消落带土壤细菌群落的主要影响因子(p<0.05),这可能与不同修复植被类型可提供的有机质数量有关。
