阿维巴坦联合头孢他啶、氨曲南或美罗培南对耐碳青霉烯类肺炎克雷伯菌的体外抗菌活性
2022-03-15王玉洁于清华胡付品
于 梦,王玉洁,于清华,胡付品
(1. 青岛市市立医院检验科,山东 青岛 266000;2. 复旦大学附属华山医院抗生素研究所,上海 200040)
碳青霉烯类抗生素能够有效抵抗革兰阴性菌感染,并广泛应用于临床,导致耐碳青霉烯类肠杆菌目细菌(carbapenem-resistant Enterobacterales,CRE),尤其是肺炎克雷伯菌的分离率呈快速上升趋势。同时研究[1-2]显示,CRE感染患者面临临床治疗失败率高、病死率高的困境,给临床有效抗感染治疗带来巨大挑战。美国疾病控制与预防中心(CDC)在2019年《抗生素耐药性威胁报告》中指出,CRE是“最紧迫的威胁”之一。以上情况凸显了新型抗生素在抗病原体感染方面的重要性。产碳青霉烯酶是包括肺炎克雷伯菌在内的肠杆菌目细菌耐碳青霉烯类抗生素的最主要机制,而酶抑制剂在对抗产酶菌株中发挥着重要作用。阿维巴坦作为一种已投入临床使用的新型β-内酰胺酶抑制剂,其自身虽无抗菌活性[3],但能长效、可逆的结合A类[包括超广谱β-内酰胺酶(extended-spectrum β-lactamases,ESBLs)和KPC酶(Klebsiellapneumoniaecarbapenemase)]、C类 (AmpC酶)和部分D类β-内酰胺酶(如OXA-48)[4-6],以此恢复与之联合使用的β-内酰胺类抗生素的抗菌活性。本研究探讨头孢他啶/阿维巴坦,氨曲南/阿维巴坦,美罗培南/阿维巴坦对耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistantKlebsiellapneumoniae,CRKP)的抗菌活性,现将结果报告如下。
1 材料与方法
1.1 菌株来源 收集青岛市市立医院2018—2020年临床分离的CRKP菌株,剔除同一患者重复分离的菌株。
1.2 主要试剂及仪器 包括梅里埃VITEK MS全自动快速微生物质谱检测仪,梅里埃VITEK 2 Compact全自动药敏分析仪,TAKARA普通PCR仪[TaKaRa(大连)生物工程有限公司],美国伯乐Bio-rad PowerPac基础电泳仪,美国伯乐Bio-Rad GelDoc XR 凝胶成像系统,Premix Tag[翌圣生物科技(上海)有限公司]。头孢他啶(130484-201806)、氨曲南(130507-201303)、美罗培南(130506-201403)均购于自中国食品药品检定研究院,阿维巴坦(20160831-2)由正大天晴药业集团股份有限公司提供。
1.3 细菌鉴定及药敏试验 采用梅里埃VITEK MS质谱仪及梅里埃VITEK 2 Compact全自动药敏分析仪分别进行菌株鉴定及常规药敏测定,依照2020年美国临床实验室标准协会(CLSI)M100对药敏结果进行判定,替加环素敏感性判定参考美国食品药品监督管理局(Food and Drug Administration,FDA)推荐的标准,最低抑菌浓度(MIC)≤2 μg/mL为敏感,MIC≥8 μg/mL为耐药;氨曲南/阿维巴坦、美罗培南/阿维巴坦药敏结果判断分别参照氨曲南及美罗培南折点判定标准。铜绿假单胞菌ATCC 27853、大肠埃希菌ATCC 25922质控标准菌株均购自国家卫生健康委临床检验中心。采用微量肉汤稀释法测定头孢他啶、头孢他啶/阿维巴坦、氨曲南、氨曲南/阿维巴坦、美罗培南、美罗培南/阿维巴坦的MIC,阿维巴坦固定浓度为4 μg/mL。
1.4 耐药基因检测 采用聚合酶链反应(PCR)方法检测所有受试菌5种常见碳青霉烯酶基因(blaKPC、blaNDM、blaOXA、blaVIM、blaIMP)携带情况,阴性菌株首先按照2020年CLSI M100 ESBLs初筛实验进行表型筛查,若阳性则进行ESBLs耐药基因检测,阴性者则进行AmpC酶耐药基因(blaMOX、blaCIT、blaDHA、blaACC、blaEBC、blaFOX)筛查,PCR引物及产物大小见表1。

表1 碳青霉烯类耐药基因PCR引物及产物大小
1.5 MIC及最低杀菌浓度(MBC)测定 在96孔板上采用微量肉汤稀释法对受试菌进行相关抗菌药物MIC检测,严格按照标准的操作步骤及试验方法制备受试菌菌悬液、抗菌药物等。将保存菌株接种于MH营养琼脂培养16~18 h,取适量单菌落配制成0.5麦氏单位的菌悬液,采用双倍CAMHB肉汤按照1∶100比例进行稀释。向96孔药敏板中加入制备好的抗菌药物,再将50 μL稀释后菌悬液依次加入每孔,使头孢他啶、氨曲南、美罗培南最终浓度范围为0.06~128 μg/mL,头孢他啶/阿维巴坦、氨曲南/阿维巴坦、美罗培南/阿维巴坦最终浓度范围为0.03/4~64/4 μg/mL,同时每孔菌悬液的最终浓度为105CFU/mL。在头孢他啶/阿维巴坦、氨曲南/阿维巴坦、美罗培南/阿维巴坦受试菌株的MIC基础上,取100 μL肉眼未见细菌生长孔中的受试菌液均匀涂布于普通营养琼脂平板,经过夜孵育后计算相应平板菌落数,若该平板上生长的菌落数<0.1%的初始接种菌量,则相应肉汤孔中的药物浓度为该抗菌药物对受试菌的MBC。
1.6 统计分析 应用WHONET 5.6分析细菌对抗菌药物的耐药率。
2 结果
2.1 一般资料 63株CRKP菌株标本来源于痰28株(44.4%),血18株(28.6%),尿11株(17.5%)及其他类型标本6株(9.5%,包括腹腔积液2株,支气管肺泡灌洗液、胆汁、分泌物、穿刺液各1株),从男性患者分离株多于女性患者(73.0% VS 27.0%),老年人分离菌株占69.8%,重症监护室(ICU)分离菌株占47.6%。见表2。
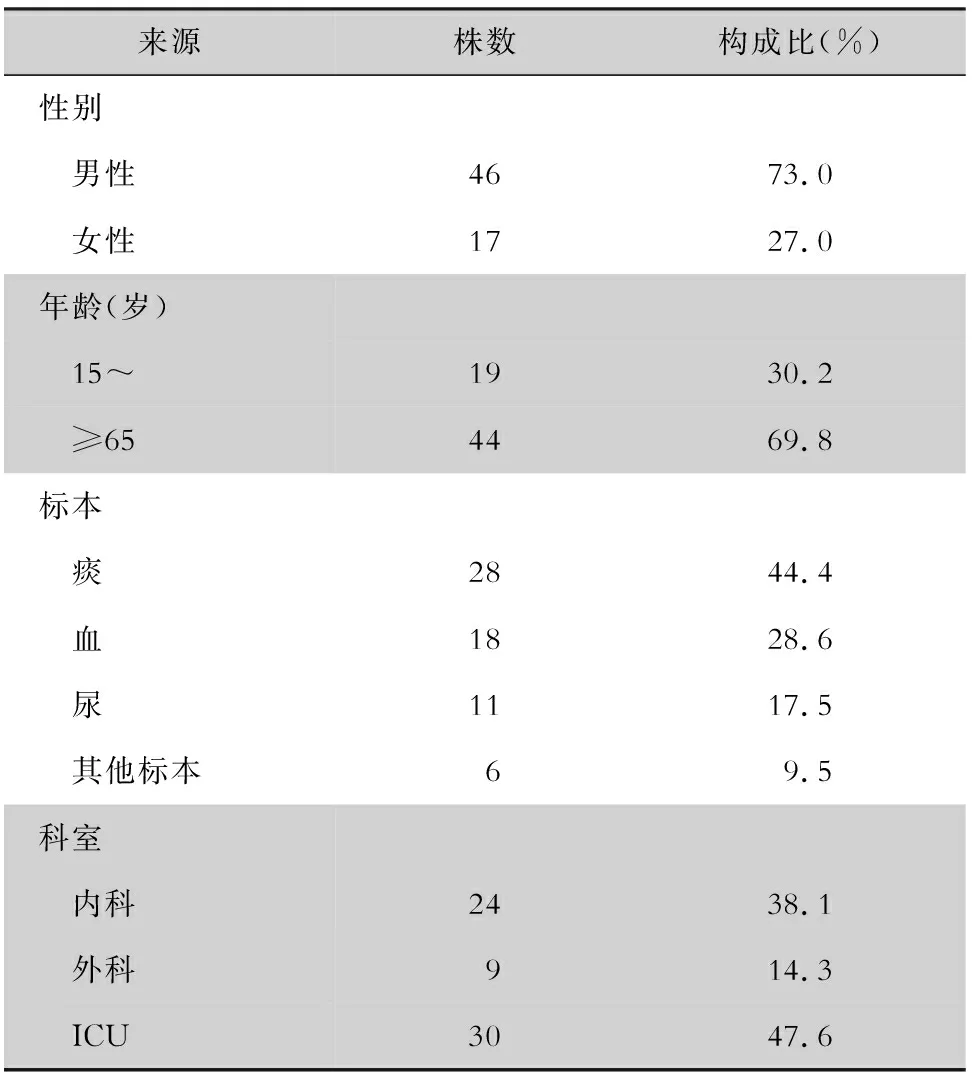
表2 63株CRKP菌株来源分布情况
2.2 药敏结果 CRKP菌株对β-内酰胺类抗生素(头孢他啶、头孢吡肟、亚胺培南、美罗培南),以及β-内酰胺酶抑制剂的复合制剂(阿莫西林/克拉维酸、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦)耐药率均>95%,对喹诺酮类(环丙沙星、左氧氟沙星)以及单环β-内酰胺类药物氨曲南的耐药率也>95%,对氨基糖苷类亦呈现出较高的耐药率(61.9% ~74.6%),对替加环素耐药率较低(1.6%),对头孢他啶/阿维巴坦、美罗培南/阿维巴坦的耐药率为3.2%~7.9%,未检出对氨曲南/阿维巴坦耐药的菌株。见表3。

表3 CRKP对抗菌药物的药敏结果
2.3 耐药基因检测结果 63株CRKP菌株中,57株(90.5%)检出blaKPC-2基因 ,2株(3.2%)检出blaNDM-1基因,各有1株(1.6%)检出blaNDM-5、blaIMP-4、blaIMP-69基因,1株CRKP 5种常见碳青霉烯酶基因菌均未检出,但检出AmpC酶基因blaDHA。见图1。

M:DNA Marker;阴:阴性对照;阳:KPC-2基因阳性对照;泳道1、3、5~8:临床KPC-2基因阳性菌株;泳道4:临床KPC-2基因阴性菌株。
2.4 MIC和MBC检测结果 头孢他啶/阿维巴坦对 57株携带blaKPC-2基因的CRKP株菌的 MIC50、MIC90分别为2/4、8/4 μg/mL,阿维巴坦可将头孢他啶MIC50及MIC90均下降96.9%;氨曲南/阿维巴坦对其MIC50、MIC90分别为0.5/4、2/4 μg/mL,阿维巴坦可将氨曲南MIC50及MIC90分别下降99.8%、99.2%;美罗培南/阿维巴坦对其MIC50、MIC90分别为0.125/4、0.5/4 μg/mL,阿维巴坦可将美罗培南MIC50、MIC90分别下降99.8%、99.6%。5株表达金属β-内酰胺酶(MBLs)基因的CRKP菌株,阿维巴坦未使头孢他啶、美罗培南MIC90值有所下降,但阿维巴坦可使氨曲南MIC90下降达99.8%。头孢他啶/阿维巴坦、氨曲南/阿维巴坦、美罗培南/阿维巴坦对63株CRKP株菌的MBC50、MBC90值与其相应的MIC50、MIC90值相同。见表4。
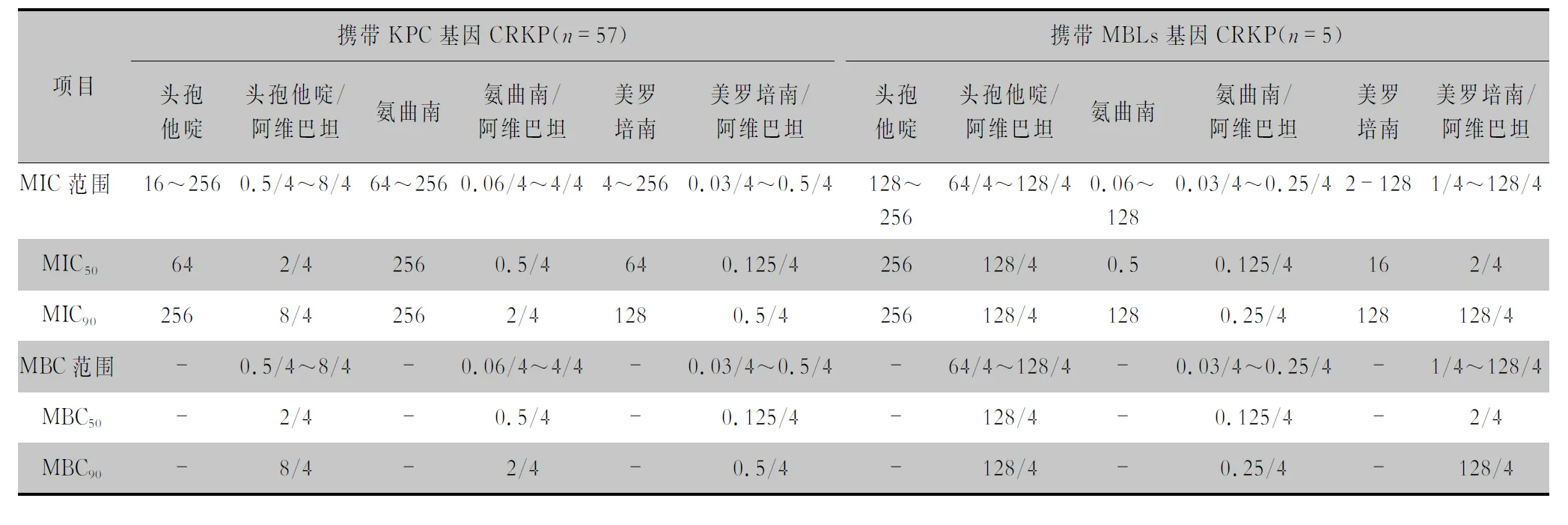
表4 抗生素及其阿维巴坦复合制剂对携带不同基因CRKP菌株的MIC和MBC检测结果(μg/mL)
3 讨论

本组研究发现,57株携带blaKPC-2基因的CRKP株菌,阿维巴坦可将头孢他啶、氨曲南和美罗培南对其MIC50及MIC90下降96.9%~99.8%;5株表达金属酶的CRKP菌株,阿维巴坦未使头孢他啶、美罗培南对其MIC90值有所下降,但阿维巴坦可使氨曲南对其MIC90值下降99.8%。
综上所述,阿维巴坦联合常见β-内酰胺类抗生素(头孢他啶、氨曲南或美罗培南)可有效抑制携带blaKPC-2基因的CRKP菌株,却不能有效抑制MBLs基因阳性的CRKP菌株;与氨曲南联合可有效抑制blaKPC基因阳性及MBLs基因阳性的CRKP菌株。本研究受试菌株数特别是表达金属酶的菌株有限,可以扩大受试菌株数及增加其他耐药机制的菌株以获取更多数据,为临床抗CRKP感染治疗提供更好的选择。
利益冲突:所有作者均声明不存在利益冲突。
