抑制p38MAPK信号转导通路对钛颗粒诱导RAW264.7巨噬细胞的影响
2022-03-15陈德胜刘子歌宋国瑞郭凤英
陈德胜,张 晨,刘子歌,宋国瑞,郭凤英,李 燕
(1.宁夏回族自治区人民医院骨科,银川 750002;2.宁夏医科大学临床医学院,银川 750004;3.宁夏医科大学基础医学院,银川 750004)
人工关节置换术作为关节终末期疾病和老年股骨颈骨折的有效治疗手段,明显提高了患者的生活质量[1-2]。在术后15~20年,10%~15%的患者因各种因素造成无菌性松动,最终导致人工关节失效,需采取人工关节返修术。人工关节产生的磨损颗粒诱导的假体周围骨溶解是引起人工假体松动的首要原因,直接影响人工假体的使用寿命。有研究[3-4]证实,磨损颗粒在关节间隙大量积聚。界膜巨噬细胞被磨损颗粒激活后释放了大量强效溶骨细胞因子和炎性介质,包括肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、基质金属蛋白酶(MMP)等。这些细胞因子主要通过信号转导通路,诱导破骨细胞形成与活化,并刺激巨噬细胞和破骨细胞引起邻近骨质吸收、骨重建紊乱。
随着人们对人工假体周围骨溶解发病机制的进一步了解,使得药物预防人工假体周围骨溶解成为可能。近期研究[5-6]发现,p38MAPK不仅参与骨重建的调节,还与炎性反应有关。本文以小鼠RAW264.7巨噬细胞为研究对象,以钛(Ti)颗粒为研究因素,以p38MAPK信号转导通路为作用靶点,探讨p38MAPK选择性抑制剂SB203580在无菌性松动中的潜在治疗和预防价值。
1 材料与方法
1.1 实验材料
磨损颗粒选用Ti颗粒,购自Alfa Aesar公司(Ward Hill,MA),要求颗粒直径<20 μm。小鼠RAW巨噬细胞株购自中国科学院上海细胞所,内毒素检测试剂盒购于厦门市鲎试剂实验厂有限公司,四甲基偶氮噻唑蓝(MTT)和酶联免疫法(ELISA)试剂盒均购自美国Sigma公司。
1.2 实验方法
1.2.1 磨损颗粒的内毒素去除处理并检测 在干燥箱内180℃将Ti颗粒焙烤6 h,浸泡于70%乙醇,然后以2 000 r·min-1速度离心15 min,沉淀出Ti颗粒。多次循环操作,再加入PBS洗涤、离心、干燥,通过紫外线持续照射,消毒处理颗粒,加入无菌PBS,制成浓度为300 mg·mL-1的Ti颗粒悬液,4℃保存备用。Ti颗粒悬液加入内毒素检测试剂,全部标本恢复到室温,根据标准品吸光度测量结果绘制标准曲线,然后计算每个样品内毒素含量。Ti颗粒去除内毒素处理。
1.2.2 小鼠RAW264.7巨噬细胞系复苏与培养 从医用液氮罐中取出小鼠RAW264.7巨噬细胞株冷冻管放入38℃水浴中,持续摇动,加入培养基6 mL,离心机中离心后去除上清液。沉淀加入2 mL培养基(由10%的小牛血清、青霉素100 U·mL-1、链霉素100 μg·mL-1添加的DMEM)悬浮细胞,转入小鼠RAW264.7巨噬培养瓶中,37℃、5% CO2细胞培养箱中培养。
1.2.3 小鼠RAW264.7巨噬细胞分组与处理 将选用的Ti颗粒(0.1 mg·mL-1)、p38MAPK抑制剂(SB203580,120 nmol·L-1为最适宜浓度)、RANKL(50 ng·mL-1)和脂多糖(LPS 2 mg·mL-1)作为作用物。A组:单纯细胞培养组;B组:细胞+Ti颗粒培养组;C组:细胞+RANKL培养组;D组:细胞+Ti颗粒+RANKL培养组;E组:细胞+Ti颗粒+RANKL+SB203580培养组。分组培养6 d,每3 d换液1次(加RANKL时,先加入RANKL与细胞共同培养2 h后再加入其他作用物)。
1.2.4 抗酒石酸酸性染色(TRAP)检测SB203580对Ti颗粒刺激RAW264.7细胞向破骨细胞转化能力的影响 将各组细胞接种于6孔板中,1×104/孔,37℃、5%CO2培养箱中培养过夜,去除培养细胞的上清液,选用无菌PBS洗涤,用柠檬酸盐/丙酮溶液固定30 s,在TRAP染液(萘酚ASBI磷酸盐作为底物)中37℃孵育1 h。蒸馏水洗涤3次,苏木素复染2 min,干燥后二甲苯透明,DPX(聚苯乙烯+酞酸二丁酯+二甲苯)封固。选用倒置电子显微镜下观察计数TRAP阳性细胞,并进行统计分析。
1.2.5 MTT比色法检测SB203580对Ti颗粒刺激RAW264.7巨噬细胞生长抑制作用的影响 将贴壁小鼠RAW264.7巨噬细胞制成悬浮细胞放置于DMEM的培养液中,培养在24孔培养皿中铺板,每孔1 mL(2×105个细胞/孔),37℃、5%CO2培养箱中培养24 h。各加入0、60、120、240 nmol·L-1的SB203580,每组设定为6个复孔。按照上述条件进行分组培养24、48和72 h。移液枪吸取后弃去每孔中培养液,加入含10%MTT(5 mg·mL-1)的DMEM培养液(不含小牛血清),继续培养4 h。移液枪吸取弃去细胞上清液,每孔加入二甲亚砜(DMSO)150 μL振荡10 min,酶标仪测量570 nm的吸光度,制图表并进行统计分析。
1.2.6 ELISA检测SB203580对Ti颗粒刺激RAW 264.7细胞分泌TNF-α、MMP-9细胞因子的影响 设定LPS为阳性对照组,将贴壁小鼠RAW264.7巨噬细胞制成悬浮细胞于DMEM的培养液中,在96孔培养皿中铺板,每孔1 mL(2×105个细胞/孔),37℃、5% CO2培养箱中培养24 h。分为巨噬细胞+不同浓度(0、0.25、0.50、1.00 mg·mL-1)Ti颗粒组、巨噬细胞+不同浓度(0、0.25、0.50、1.00 mg·mL-1)Ti颗 粒+120 nmol·L-1SB203580组,其中将巨噬细胞+0 mg·mL-1Ti颗粒设为单纯细胞对照组。每组设定为6个复孔,继续培养24 h。收集各孔培养细胞的上清液,采用ELISA法检测TNF-α和MMP-9的含量。
1.2.7 实时荧光定量RT-PCR检测SB203580对Ti颗粒刺激RAW264.7巨噬细胞分泌TNF-α、MMP-9的mRNA表达情况 总RNA快速提取试剂盒提取小鼠RAW264.7巨噬细胞、Ti颗粒(1 mg·mL-1)刺激的小鼠RAW264.7巨噬细胞及p38信号通路抑制剂SB203580(120 nmol·L-1)和Ti颗粒(1 mg·mL-1)刺激下小鼠RAW264.7巨噬细胞中的总RNA。将细胞预处理、混匀、洗脱,获取总RNA。按照Prime ScriptTMRT reagent Kit反转录试剂盒说明书进行操作,进行TNF-α及MMP-9的PCR扩增,采用2×Taq PCR MasterMix进行PCR扩增,见表1。
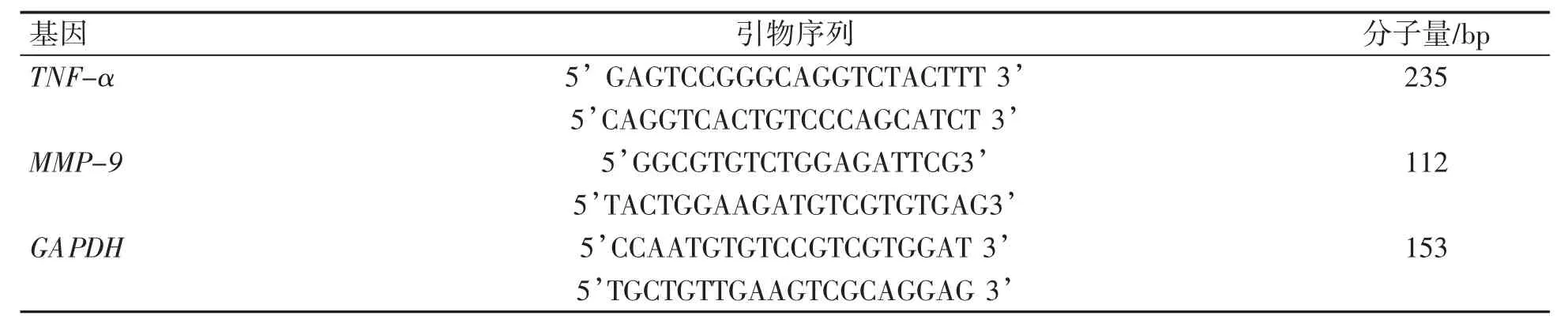
表1 运用Primer 5软件设计PCR扩增引物
Real-Time PCR反应按照SYBRR Premix Ex TaqTMⅡ试剂盒说明书进行。Real-Time PCR结果分析应用IQ5快速实时定量PCR软件系统,按照设定的阈值,从扩增曲线中直接获得循环阈值(Ct),并对Ct值进行相对定量分析。
1.3 统计学方法
所有数据采用SPSS 22.0软件进行统计分析。计量资料进行方差齐性检验后以均数±标准差(±s)表示,组间比较采用单因素方差分析(oneway ANOVA)。P≤0.05为差异有统计学意义。
2 结果
2.1 TRAP染色法检测SB203580对Ti颗粒刺激RAW264.7巨噬细胞向破骨细胞转化能力的影响
经TRAP染色可见,阳性细胞胞浆大多数呈紫红色,小鼠RAW264.7巨噬细胞周围有许多细长的伪足样突起,细胞胞核数目比较多,细胞内可见到大量的胞浆,细胞胞浆内含空泡结构,细胞胞核大、核仁清晰。TRAP阳性细胞数随着Ti颗粒浓度(0.25、0.50、1.00 mg·mL-1)增高而相应增多,加入抑制剂SB203580后,TRAP阳性细胞数明显减少。TRAP染色结果证实通过RAW264.7巨噬细胞培养,加入Ti颗粒后进一步培养的TRAP染色阳性细胞为破骨细胞,抑制剂SB203580能够抑制小鼠钛颗粒诱导下RAW264.7巨噬细胞向破骨细胞增殖、成熟和活化(图1)。
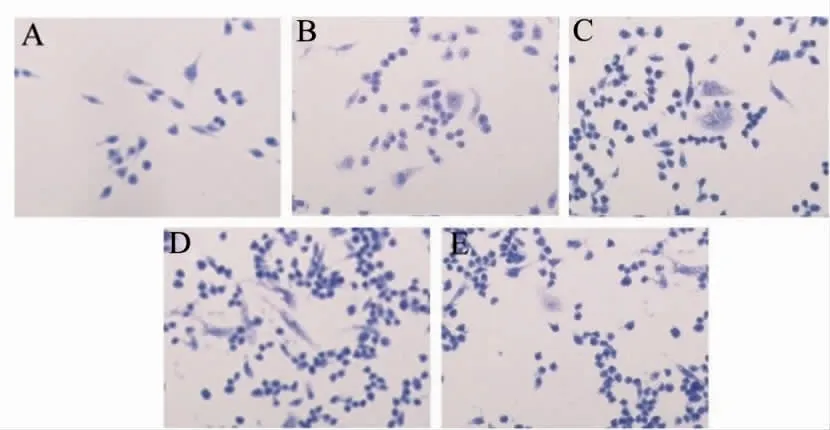
图1 各组RAW264.7巨噬细胞向破骨细胞转化结果(TRAP×40)
2.2 MTT比色法检测SB203580对RAW264.7巨噬细胞生长抑制作用的影响
在24、48和72 h时,0 nmol·L-1与60、120、240 nmol·L-1p38MAPK特异性抑制剂SB203580对RAW264.7巨噬细胞的生长抑制作用差异无统计学意义(P均>0.05),见图2。说明本次实验所使用的p38MAPK抑制剂SB203580浓度范围内并未影响小鼠RAW264.7巨噬细胞的正常增殖。
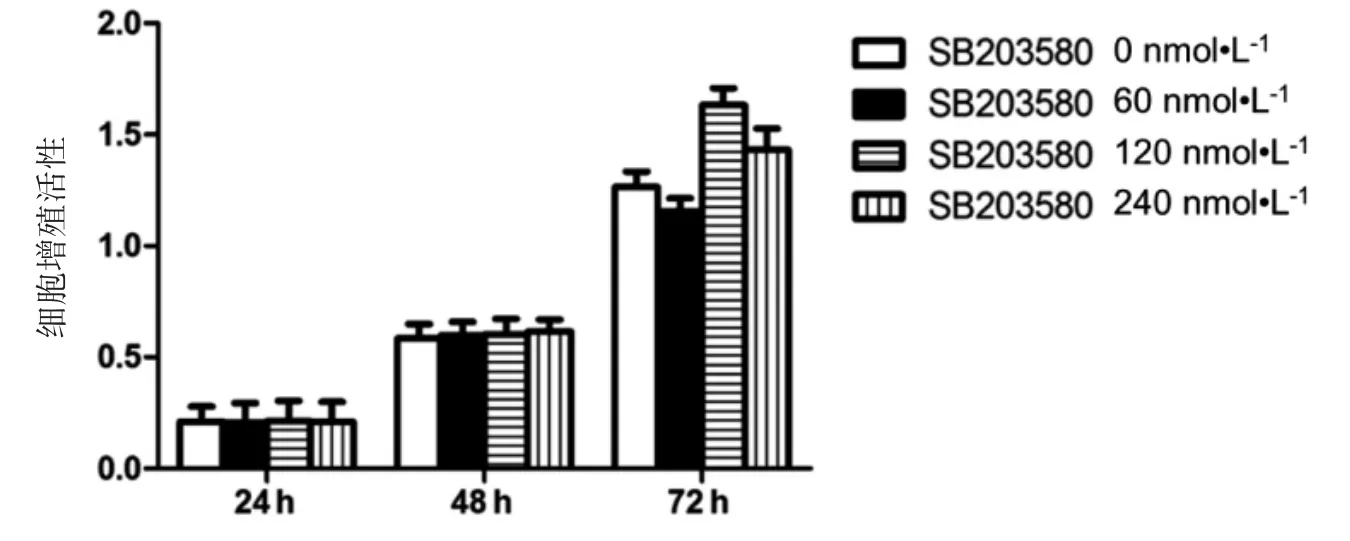
图2 不同浓度SB203580对细胞增殖的影响
2.3 ELISA法检测SB203580对Ti颗粒刺激RAW 264.7巨噬细胞分泌TNF-α、MMP-9细胞因子表达的影响
在Ti颗粒作用下,对小鼠RAW264.7巨噬细胞培养上清液中炎性因子含量随Ti颗粒浓度(0.25、0.50、1.00 mg·mL-1)的增高而增加,TNF-α分别为(254.31±7.49)pg·mL-1、(597.88±15.31)pg·mL-1、(873.85±36.28)pg·mL-1,加入120 nmol·mL-1SB203580后,TNF-α水平[(137.22±5.45)pg·mL-1、(271.35±4.98)pg·mL-1、(341.65±17.16)pg·mL-1]降低(P均<0.05),见图3。

图3 ELISA法检测上清液中TNF-α含量
Ti颗粒浓度为0.25、0.50、1.00 mg·mL-1时,MMP-9分别为(194.23±6.02)pg·mL-1、(482.13±10.09)pg·mL-1、(654.11±11.53)pg·mL-1,当加入120 nmol·mL-1SB203580后,MMP-9水平[(102.73±15.27)pg·mL-1、(223.79±5.06)pg·mL-1、(275.41±6.72)pg·mL-1]降低(P均<0.05),见图4。

图4 ELISA法检测上清液中MMP-9含量
2.4 实时荧光定量RT-PCR检测SB203580对Ti颗粒刺激RAW264.7细胞分泌TNF-α、MMP-9的mRNA表达情况
结果表明,12、24、48和96 h时,Ti颗粒刺激下小鼠RAW264.7巨噬细胞产生MMP-9和TNF-α的mRNA表达较control组增加,SB203580-p38的MAPK抑制剂能降低Ti颗粒刺激下小鼠RAW264.7巨噬细胞产生MMP-9和TNF-α的mRNA表达(P均<0.05),见图5、图6。说明p38MAPK特异性抑制剂SB203580对磨损颗粒刺激小鼠RAW264.7巨噬细胞产生的MMP-9和TNF-α的mRNA表达有下调作用。
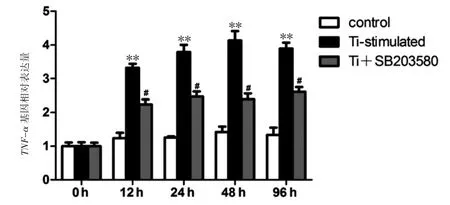
图5 实时荧光定量RT-PCR检测不同时间段TNF-α的mRNA表达
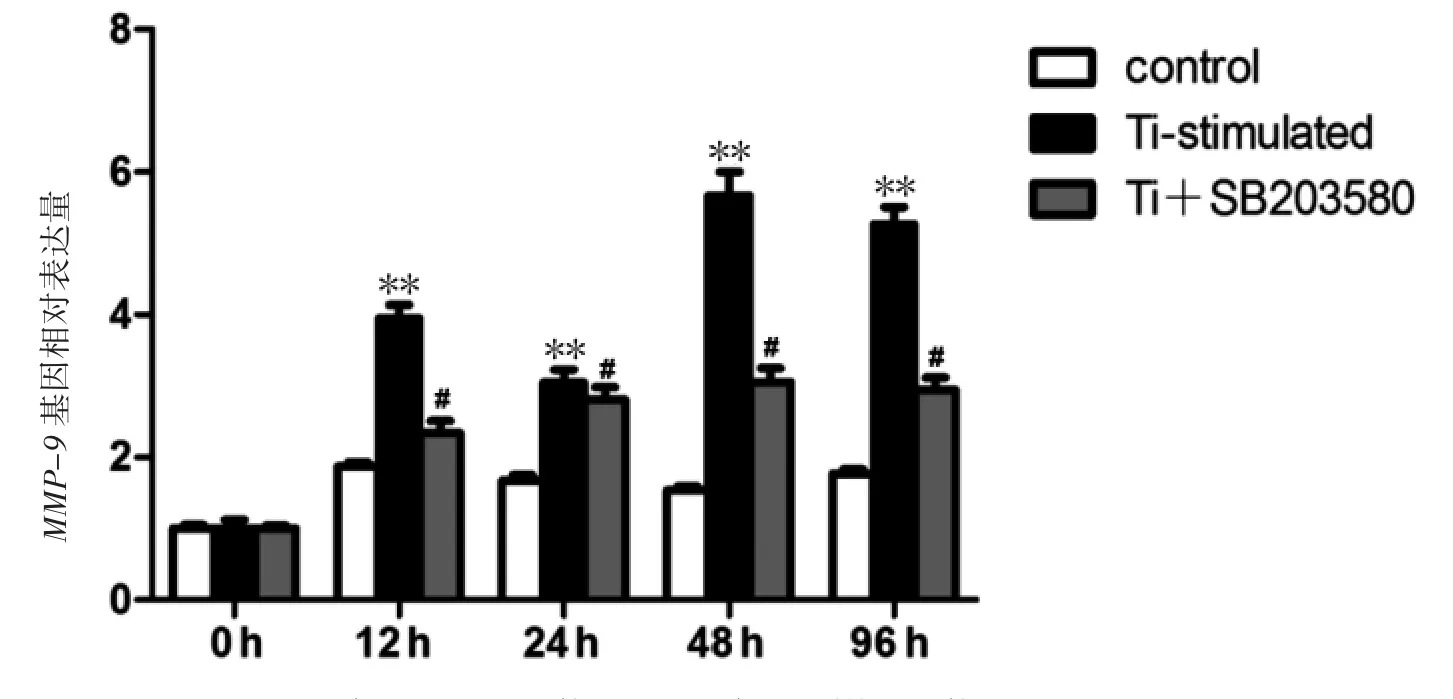
图6 实时荧光定量RT-PCR检测不同时间段MMP-9的mRNA表达
3 讨论
人工关节置换术作为骨关节终末期疾病和老年股骨颈骨折等疾病最为有效的治疗手段,可以明显提高患者的生活质量[1-2]。人工关节无菌性松动是人工关节置换术后最主要的并发症。大量研究表明[7-8],磨损颗粒—界膜巨噬细胞—骨溶解—无菌性松动之间存在一定的内在联系,该联系的一个关键环节为巨噬细胞被磨损颗粒激活后释放的大量的细胞因子和炎性介质,主要有TNF-α、IL-1、MMP等细胞因子,诱导破骨细胞形成,并刺激巨噬细胞和破骨细胞引起邻近骨质吸收、骨重建紊乱[3-4]。
介导破骨细胞分化成熟的各种细胞因子都会通过多种信号传导通路直接或间接地调控关键核基因的表达,从而促进破骨细胞分化成熟。丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号转导途径的改变可能是参与破骨细胞调控的中心环节,因而可能调控人工关节磨损颗粒诱导的骨溶解。
MAPK是一类丝/苏氨酸蛋白激酶,其广泛存在于包括哺乳动物在内的多种生物细胞中,MAPK家族的信号传导途径主要包括细胞外信号调控的蛋白激酶(extracellular signal regulated protein kinase,ERK)、c-Jun N端激酶(c-Jun Nterminal kinase,JNK)/应激活化的蛋白激酶(stress activated protein kinase,SAPK)、p38丝裂原活化蛋白激酶(p38 mitogen activated protein kinases,p38MAPK)以及ERK5/大丝裂素活化蛋白激酶1(big MAP kinase,BMK1)四条途径[9]。p38MAPK参与了生物凋亡、细胞生长发育、细胞转录调节及细胞骨架识别等,是许多细胞信息传递的交汇点和共同通路[10]。p38MAPK信号转导途径与破骨细胞的溶骨性改变有着密切的相关性。有实验研究[11]表明,人工假体产生的磨损颗粒可以刺激和激活炎性反应微环境中的前炎性因子如RANKL及TNF-α,而这些因子能激活转录因子NF-κB和MAPK,其中MAPK也包括c-JNK、ERK和p38,这些转录因子均可参与破骨细胞的增殖和分化。
TNF-α为破骨细胞吸收刺激因子主要作用于未成熟的成骨细胞和骨髓基质细胞,诱导其表达RANKL分子,并与破骨细胞前体细胞膜上受体RANK结合,使破骨细胞分化、成熟并产生活性。这些细胞因子和炎性介质刺激成骨细胞表达RANKL而成为局部骨吸收的重要潜在调节者[12]。TNF通过和细胞膜上特异性受体结合,实现促进细胞生长、分化、凋亡及诱发炎症等生物学效应。现已证明:TNF-α和RANKL相互作用可以增强破骨细胞活性[13]。
MMP-9主要来源于巨噬细胞,也是MMPs家族中分子量相对较大的酶。破骨细胞增殖、分化和成熟不断加强后出现骨溶解的作用。在这个过程中,MMP-9作为一种主要蛋白酶,能够降解各种细胞外基质。因此在破骨细胞中有多种细胞因子可以影响MMP-9的活性,除此之外,多种信号传导途径亦能调控其表达。Franco等[14]通过动物体内、体外实验证实,破骨细胞可在RANKL介导下出现分化增殖,也使得MMP-9的活性增加。
p38抑制剂被广泛应用于p38 MAPK对TNFα、IL-1、MCP-1等细胞因子调节活性的研究[15-17]。SB203580是p38MAPK的特异性的吡啶异咪哒唑类抑制剂[18-21],结构与腺嘌呤类似,可竞争性与磷酸化的p38α和p38β上的具有ATP酶活性的ATP盒结合,从而抑制p38MAPK对下游分子如ATF2的磷酸化,然而并不影响p38MAPK的磷酸化[22]。p38MAPK具有一个较小的氨基末端结构域和一个较大的羧基末端结构域,其氨基末端结构域主要由D折叠组成,而其羧基末端结构域主要为Ⅱ螺旋。两个结构域交界处形成一个裂隙,也即ATP结合位点。SB203580并不是通过抑制p38MAPK上游激酶的活性而发挥作用,而是结合于激活的p38MAPK及未被激活的p38MAPK的ATPK口袋,从而抑制下游底物MAPK APK2(MK2)的磷酸化及其功能的发挥[23]。吡啶异咪哒唑类化合物的药用潜力也被用于多种疾病,特别是炎症相关性疾病,并且取得了一定的效果[24-25]。
本研究以小鼠RAW264.7巨噬细胞为研究对象,证实Ti颗粒能在体外促进巨噬细胞部分细胞因子TNF-α和MMP-9的表达,并与Ti颗粒浓度呈正相关;p38MAPK抑制剂SB203580能通过p38MAPK信号转导途径抑制Ti颗粒诱导下的巨噬细胞释放TNF-α和MMP-9等的表达;同时,SB203580能抑制小鼠RAW264.7巨噬细胞向破骨细胞转化,通过p38MAPK信号转导通路影响破骨细胞活性。这可能是p38MAPK抑制剂SB203580能降低骨溶解的机制之一。应用ELISA法也证实前者的TNF-α水平低于后者,结果提示,SB203580抑制了p38 MAPK的酶活性,阻止了p38 MAPK对下游底物的激活,从而抑制了P38 MAPK信号传导途径,减少了细胞因子如TNF-α和MMP-9的释放。
本研究实验结果显示,Ti颗粒诱导的小鼠RAW264.7巨噬细胞的TNF-α和MMP-9表现为高表达,并出现过度凋亡现象,可与Ti颗粒的浓度呈正相关。磨损颗粒促进小鼠RAW264.7巨噬细胞向破骨细胞转化。p38MAPK抑制剂SB203580通过p38MAPK信号转导途径抑制Ti颗粒诱导下的小鼠RAW264.7巨噬细胞释放TNF-α和MMP-9等炎性因子;SB203580能促进巨噬细胞正常凋亡,抑制巨噬细胞向破骨细胞转化。
